HPLC法测定人血浆中游离亚胺培南浓度
2015-01-05温爱萍余俊先冀晓俊史丽敏段美丽首都医科大学附属北京友谊医院药剂科北京00050首都医科大学化学生物学与药学院北京00069首都医科大学附属北京友谊医院重症医学科北京00050
温爱萍,李 哲,李 任,余俊先,程 晟,冀晓俊,史丽敏,段美丽(.首都医科大学附属北京友谊医院药剂科,北京 00050;.首都医科大学化学生物学与药学院,北京 00069;.首都医科大学附属北京友谊医院重症医学科,北京 00050)
HPLC法测定人血浆中游离亚胺培南浓度
温爱萍1,李 哲2,李 任1,余俊先1,程 晟1,冀晓俊3,史丽敏1,段美丽3(1.首都医科大学附属北京友谊医院药剂科,北京 100050;2.首都医科大学化学生物学与药学院,北京 100069;3.首都医科大学附属北京友谊医院重症医学科,北京 100050)
目的:建立人血浆中游离亚胺培南浓度的HPLC测定方法。方法:血浆样本经超滤离心后,直接进样,采用Agilent Zorbax SB-C8色谱柱(4.6 mm × 250 mm,5 μm),以乙腈-0.5 mol·L-1醋酸铵溶液为流动相进行梯度洗脱,流速1.0 mL·min-1,以头孢他啶为内标,紫外检测波长为298 nm,柱温30 ℃。结果:亚胺培南在0.3 ~ 100.0 μg·mL-1范围内线性关系良好(r >0.999),质控样本(0.5、2.0、30.0、75.0 μg·mL-1)的方法学回收率分别为(104.54±3.17)%、(99.70±1.04)%、(98.93±1.12)%和(101.29±2.23)%;日内精密度RSD ≤ 3.03%,日间精密度RSD ≤ 5.11%。结论:本方法准确度高、灵敏度好、操作便捷,符合亚胺培南血药浓度监测和药代动力学研究的要求。
游离亚胺培南;HPLC;血浆;超滤
亚胺培南为碳青霉烯类药物,具有抗菌谱广、抗菌作用强、对多种β-内酰胺酶高度稳定的特点,主要用于多重耐药的革兰阴性杆菌感染、严重需氧菌与厌氧菌混合感染的治疗以及病原未查明的严重感染[1],是重症感染患者常用的抗感染药物之一。重症感染患者的病理生理情况特殊,可能直接影响亚胺培南的体内过程,如根据常规方案给药可能因血药浓度过高或过低而导致不良反应或治疗失败[2-8],因此对重症感染患者进行亚胺培南的治疗药物监测,可为临床制定合理的给药方案提供参考依据[6,9-11]。目前,国内外亚胺培南血药浓度的测定方法主要有亲水作用色谱-质谱检测法[12-13]和HPLC-紫外检测法[14-22],质谱检测法对仪器要求高,难以普及;多数HPLC-紫外检测法文献测定的是血浆中亚胺培南的总浓度[14-17,20-22],而血中的游离药物是产生药理效应的部分,也只有游离药物才能被机体转化和排泄,因此测定游离药物浓度更具有临床意义[23]。本研究建立人血浆中游离亚胺培南浓度的高效液相色谱测定方法,以期为考察亚胺培南在重症感染患者的药动学方面提供方法学基础。
1 仪器与试药
Agilent 1100 HPLC系统(美国Agilent公司);分析天平(德国Sartorius集团);离心机(德国Eppendorf公司);Amicon超滤管(0.5 mL,3 KD,美国Millipore公司);Milli-Q plus超纯水器(美国Millipore公司)。
注射用亚胺培南西司他丁(亚胺培南500 mg/西司他丁500 mg,美国默沙东公司);USP亚胺培南对照品(纯度93.2%,国药集团化学试剂北京有限公司,批号I1K226);内标头孢他啶(纯度84.2%,中国药品生物制品检定所,批号130484-200803)。乙腈,甲醇(色谱纯,德国Merck公司);乙酸铵、氢氧化钠(NaOH)、3-(N-吗啉基)丙磺酸(MOPS)均为分析纯。
2 方法与结果
2.1 色谱条件
色谱柱:Agilent Zorbax SB-C8柱(4.6 mm × 250 mm,5 μm),柱温30 ℃;流动相:乙腈和0.5 mol·L-1醋酸铵缓冲液(pH 6.8),以梯度方式洗脱(初始乙腈2%,经5 min按比例增至40%,再经5 min按比例减至2%),流速:1.0 mL·min-1;紫外检测波长:298 nm。
2.2 稳定液的配制
称取MOPS 2.64 g,用100 mL超纯水溶解,加入适量NaOH调节pH值至6.8。
2.3 储备液的配制
分别精密称取亚胺培南和内标头孢他啶对照品置于容量瓶中,加入稳定液配制成1 mg·mL-1的亚胺培南和500 μg·mL-1的头孢他啶储备液,分装后,– 70 ℃保存备用。
2.4 血浆样本处理
精密吸取血浆样本与稳定液混合液(1∶1,200 μL),加入内标头孢他啶储备液20 μL,涡旋混匀,移入超滤管中,离心(13 000 r·min-1,10 min),吸取超滤液,50 μL进样,记录色谱图。在本实验条件下,亚胺培南和内标头孢他啶分离良好,不受血浆色谱峰的干扰,见图1。危重症患者常用的万古霉素、利奈唑胺、伏立康唑、甲硝唑、阿奇霉素、阿昔洛韦、咪达唑仑、芬太尼、丙泊酚、奥美拉唑、泮托拉唑、二羟丙茶碱、氨溴索、乌拉地尔、地尔硫卓、苯海拉明、地塞米松、异甘草酸镁、还原型谷胱甘肽等药物对本测定方法无显著干扰。
2.5 标准曲线的制备
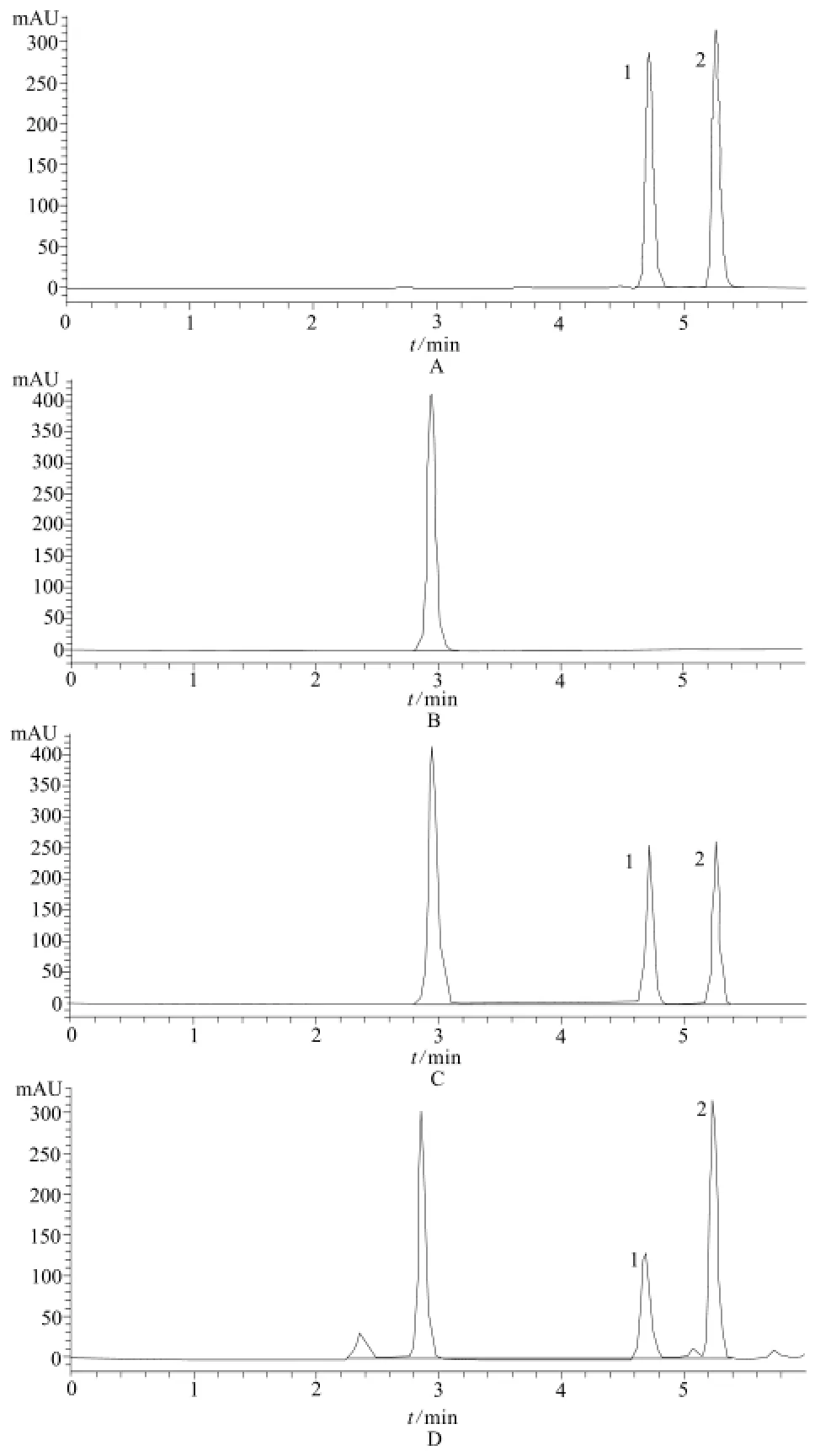
图1 HPLC色谱图A – 亚胺培南+头孢他啶标准溶液,B – 空白血浆,C – 空白血浆+亚胺培南+头孢他啶,D – 受试者血浆样本;1 – 亚胺培南,2 – 头孢他啶Fig 1 HPLC chromatogramsA – imipenem and ceftazidime standard solution, B – blank human plasma, C – blank plasma vortex with imipenem and ceftazidime, D –patient's plasma samples; 1 – imipenem, 2 – ceftazidime
以稳定液和亚胺培南储备液分别配制质量浓度为0.3、1.0、2.5、5.0、10.0、25.0、50.0、100.0 μg·mL-1的标准曲线溶液,测定当天,加入等比例空白血浆,按照“2.4”项下方法处理血浆样本后进样分析。以样本峰面积与内标峰面积之比为横坐标,血浆药物浓度为纵坐标,用加权最小二乘法(W = 1/C2)进行回归计算,求得标准曲线回归方程为:Y = 0.0334 X + 0.0010(r = 0.999 6),整个测定过程中相关系数在0.999 0 ~1.000 0之间。
2.6 准确度和精密度
另以稳定液和亚胺培南储备液分别配制质量浓度为0.5、2.0、30.0、75.0 μg·mL-1的质控溶液。分别取5份质控溶液样品各100 μL,测定当天,加入等比例空白血浆,按照“2.4”项下方法处理后进样分析,连续测定5 d,以实测浓度和真实浓度的比值计算相对回收率,反映方法学准确度;以日内和日间实测浓度的RSD反映方法学精密度。结果见表1。
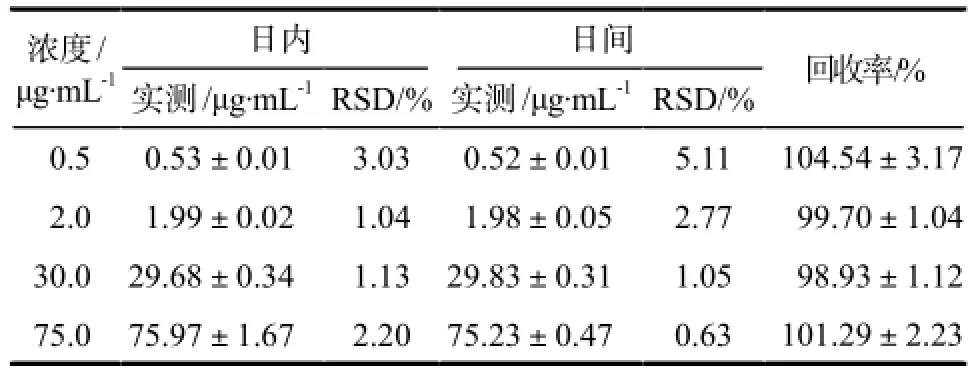
表1 亚胺培南测定方法的精密度和准确度.n= 5Tab 1 Precision and accuracy of determination method of imipenem.n= 5
2.7 提取回收率
分别取3份低、中、高浓度(2.0、30.0、75.0 μg·mL-1)的亚胺培南质控溶液样本各100 μL,测定当天,加入等比例空白血浆,按照“2.4”项下方法处理血浆样本后进样分析,以血浆稀释质控溶液样本的峰面积与同浓度的质控溶液样本经同倍数稳定液稀释后直接进样的峰面积比值计算提取回收率,结果分别为(98.23±0.35)%,(96.83±1.61)%和(97.22± 2.23)%。
2.8 稳定性
分别取50 μL亚胺培南和头孢他啶储备液,加入900 μL稳定液,涡旋混合后,50 μL进样分析,考察储备液长期放置95 d(n = 3)及室温放置6 h(n = 3)稳定性;取低、中、高3个浓度(2.0、30.0、75.0 μg·mL-1)的亚胺培南质控溶液样本,加入等比例空白血浆,考察反复冻融3次、室温放置6 h(n = 3)、– 70 ℃放置3个月(n = 3)及自动进样器放置6 h(n = 3)的稳定性。另外,将受试者血样(n = 3)分为两份,一份立即离心(3000 r·min-1,10 min),分离血浆,加入等比例稳定液,按照“2.4”项下方法处理血浆样本后进样分析;另一份放置于4 ℃冰盒中,2 h后进行离心,分离血浆,加入等比例稳定液,按照“2.4”项下方法处理血浆样本后进样分析,考察受试者血样4 ℃放置2 h的稳定性。结果表明在上述条件下,亚胺培南稳定性良好,储备液RSD值均小于5%,血浆样本RSD值均小于10%。
2.9 临床应用
经北京友谊医院伦理委员会批准,患者签署知情同意书后,已将本方法用于4例危重症患者游离亚胺培南血药浓度的测定。亚胺培南西司他丁给药方案为0.5 g(溶于100 mL 0.9%氯化钠注射液,持续输注1 h),每6 h给药一次,达稳态(连续给药至少48 h)后于给药前及给药后0.5、1、1.5、2、3、4和6 h采集血液样本,药-时曲线见图2。由图可见,实测游离亚胺培南血药浓度范围为0.49 ~ 26.08 μg·mL-1,均在本方法的线性范围内。相同的给药方案条件下,4例患者体内的游离亚胺培南浓度存在明显的个体差异,最高与最低峰浓度相差约4倍。
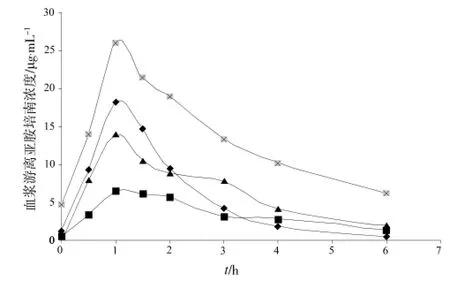
图2 4例危重症患者的药-时曲线Fig 2 Concentration-time curve of 4 critically ill patients
3 讨论
3.1 游离亚胺培南浓度测定方法
目前,游离药物测定方法主要有平衡透析法、超离心法、凝胶过滤法和超滤离心法,超滤离心法简便快捷,耗时较短,且结果稳定、可靠,已成为游离药物分析的首选方法[23-24]。根据文献报道[18-19],本研究应用超滤离心法对血浆样本进行处理,研究结果表明此方法提取回收率高且较为稳定,处理时间较蛋白沉淀法短,适合于临床患者血药浓度的快速测定及不稳定药物浓度的测定。
3.2 亚胺培南血浆样本的稳定性
亚胺培南在血浆中极不稳定,溶液的pH偏酸或偏碱均会加快其降解[20]。早在1986年,就有研究者考察了亚胺培南在0.9%氯化钠注射液及人血清中的稳定性情况[25],研究发现,2 ℃、25 ℃和37 ℃条件下,亚胺培南(2.5 mg·mL-1)在0.9%氯化钠注射液中的半衰期分别为44.42 h、6.21 h和2.05 h;20 ℃和37 ℃条件下,亚胺培南(100 μg·mL-1)在人血清中的半衰期分别为58.72 h和10.73 h。可见在测定过程中尤其需要关注亚胺培南的稳定性情况。在亚胺培南测定相关文献中,多在血浆样本中加入稳定液以提高亚胺培南测定过程中的稳定性,以满足测定要求。本研究以0.126 mol·L-1MOPS缓冲液(pH 6.8)作为稳定液,根据临床样本测定研究需要,重点考察了储备液长期放置及室温放置稳定性,血浆样品反复冻融、室温放置、– 70 ℃放置及自动进样器放置稳定性,以及受试者血样4 ℃冰盒放置稳定性,结果表明样本稳定性均可满足测定要求。
综上,在关注临床疗效相关性和测定样本稳定性的基础上,本研究建立了人血浆中游离亚胺培南浓度的HPLC测定方法,实际应用于4例危重症患者亚胺培南浓度测定。结果表明本研究的样本处理方法较为省时便捷,采血量少(仅需血浆样本100 μL),尤其适用于儿童及危重症患者的游离亚胺培南血药浓度监测和药动学研究。
[1] 汪复,张婴元.实用抗感染治疗学[M].2版.北京:人民卫生出版社,2012:278.
[2] Afshartous D, Bauer SR, Connor MJ, et al. Pharmacokinetics and pharmacodynamics of imipenem and meropenem in critically ill patients treated with continuous venovenous hemodialysis[J]. Am J Kidney Dis, 2014, 63(1): 170-171.
[3] Blot S, Lipman J, Roberts DM, et al. The influence of acute kidney injury on antimicrobial dosing in critically ill patients: are dose reductions always necessary?[J]. Diagn Microbiol Infect Dis, 2014, 79(1): 77-84.
[4] Blot SI, Pea F, Lipman J. The effect of pathophysiology on pharmacokinetics in the critically ill patient — Concepts appraised by the example of antimicrobial agents[J]. Adv Drug Deliv Rev, 2014, 77: 3-11.
[5] Scoville BA, Mueller BA. Medication dosing in critically ill patients with acute kidney injury treated with renal replacement therapy[J]. Am J Kidney Dis, 2013, 61(3): 490-500.
[6] Roberts JA, Abdul-Aziz MH, Lipman J, et al. Individualised antibiotic dosing for patients who are critically ill: challenges and potential solutions[J]. Lancet Infect Dis, 2014, 14(6): 498-509.
[7] 张娟娟,王英,张睢扬,等.成人脓毒血症患者不同负荷剂量的亚胺培南/西司他丁药动学/药效学参数差异的研究[J].中华肺部疾病杂志(电子版),2013,6(3):210-214.
[8] Couffignal C, Pajot O, Laouenan C, et al. Population pharmacokinetics of imipenem in critically ill patients with suspected ventilator-associated pneumonia and evaluation of dosage regimens[J]. Br J Clin Pharmacol, 2014, 78(5): 1022-1034.
[9] Roberts JA, Ulldemolins M, Roberts MS, et al. Therapeutic drug monitoring of beta-lactams in critically ill patients: proof of concept[J]. Int J Antimicrob Agents, 2010, 36(4): 332-339.
[10] 董玲芳,张伟,王文义,等.亚胺培南在重症感染患者体内的药物动力学研究[J].中华实用诊断与治疗杂志,2014,28(1):5-7.
[11] Goncalves-Pereira J, Povoa P. Antibiotics in critically ill patients: a systematic review of the pharmacokinetics of beta-lactams[J]. Crit Care, 2011, 15(5): R206.
[12] Hu ZY, Boucher BA, Laizure SC, et al. Nonvolatile salt-free stabilizer for the quantification of polar imipenem and cilastatin in human plasma using hydrophilic interaction chromatography/ quadrupole mass spectrometry with contamination sensitive offaxis electrospray[J]. J Mass Spectrom, 2013, 48(8): 945-950.
[13] Xu Y, Xie W, Miller-Stein CM, et al. Hydrophilic interaction chromatography/tandem mass spectrometry for the simultaneous determination of three polar non-structurally related compounds, imipenem, cilastatin and an investigational beta-lactamase inhibitor, MK-4698, in biological matrices[J]. Rapid Commun Mass Spectrom, 2009, 23(14): 2195-2205.
[14] Legrand T, Chhun S, Rey E, et al. Simultaneous determination of three carbapenem antibiotics in plasma by HPLC with ultraviolet detection[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2008, 875(2): 551-556.
[15] Dailly E, Bouquie R, Deslandes G, et al. A liquid chromatography assay for a quantification of doripenem, ertapenem, imipenem, meropenem concentrations in human plasma: application to a clinical pharmacokinetic study[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2011, 879(15-16): 1137-1142.
[16] Lopez KJ, Bertoluci DF, Vicente KM, et al. Simultaneous determination of cefepime, vancomycin and imipenem in human plasma of burn patients by high-performance liquid chromatography[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2007, 860(2): 241-245.
[17] Verdier MC, Tribut O, Tattevin P, et al. Simultaneous determination of 12 beta-lactam antibiotics in human plasma by high-performance liquid chromatography with UV detection: application to therapeutic drug monitoring[J]. Antimicrob Agents Chemother, 2011, 55(10): 4873-4879.
[18] Garcia-Capdevila L, Lopez-Calull C, Arroyo C, et al. Determination of imipenem in plasma by high-performance liquid chromatography for pharmacokinetic studies in patients[J]. J Chromatog B Biomed Sci Appl, 1997, 692(1): 127-132.
[19] Myers CM, Blumer JL. Determination of imipenem and cilastatin in serum by high-pressure liquid chromatography[J]. Antimicrob Agents Chemother, 1984, 26(1): 78-81.
[20] 刘松青,马文秀,代青,等.HPLC测定人血清中亚胺培南的浓度[J].中国抗生素杂志,1997,22(5):347-350.
[21] 孔维华,鞠浩爽,王晓雪,等.HPLC测定人血浆中亚胺培南、美罗培南、帕尼培南、法罗培南浓度[J].中国药学杂志,2014,49(14):1247-1251.
[22] 王盈盈,王陈翔,胡卢丰,等.HPLC测定人血浆中亚胺培南的浓度[J].中国现代应用药学,2013,30(12):1349-1352.
[23] 李金恒,许劲秋.游离药物测定在治疗药物监测中的意义[J].中国药理学通报,1999,15(1):14-17.
[24] 张耀东,段丽芳,叶驰霞.血游离霉酚酸浓度监测的研究进展[J].中国药物应用与监测,2013,10(6):352-354.
[25] Swanson DJ, DeAngelis C, Smith IL, et al. Degradation kinetics of imipenem in normal saline and in human serum[J]. Antimicrob Agents Chemother, 1986, 29(5): 936-937.
Determination of free imipenem in human plasma by HPLC
WEN Ai-ping1, LI Zhe2, LI Ren1, YU Jun-xian1, CHENG Sheng1, JI Xiao-jun3, SHI Li-min1, DUAN Mei-li3(1. Department of Pharmacy, Beijing Friendship Hospital Affiliated to Capital Medical University, Beijing 100050, China; 2. School of Chemical Biology and Pharmaceutical Sciences, Capital Medical University, Beijing 100069, China; 3. Department of Critical Care Unit, Beijing Friendship Hospital Affiliated to Capital Medical University, Beijing 100050, China)
Objective:To establish the HPLC method for determining the concentration of free imipenem in human plasma.Methods:Prior to analysis, free imipenem was isolated from plasma samples using ultrafiltration and centrifugation. Then, the extracts were injected directly into an Agilent Zorbax SB-C8column (4.6 mm × 250 mm, 5 μm). The mobile phase was consisted of acetonitrile-ammonium acetate solution (0.5 mol·L-1), and the gradient elution mode was applied in chromatographic separation. The flow rate was 1.0 mL·min-1. Ceftazidime was chosen as internal standard. The detection wavelength was set at 298 nm. The column temperature was 30 ℃.Results:The linear range of the calibration curve was 0.3 – 100.0 μg·mL-1with a good correlation coefficient (r > 0.999). The average recovery rates of quality control samples (0.5, 2.0, 30.0, 75.0 μg·mL-1) were (104.54 ± 3.17)%, (99.70 ± 1.04)%, (98.93 ± 1.12)% and (101.29 ± 2.23)%, respectively. The intra-day RSD was equal to or less than 3.03%, and interday RSD was equal to or less than 5.11%.Conclusion:The method was accurate, sensitive and simple, which was suitable for the therapeutic drug monitoring and clinical pharmacokinetic study of imipenem.
Free imipenem; HPLC; Plasma; Ultrafiltration
R917
A
1672 – 8157(2015)03 – 0151 – 04
2015-01-15
2015-04-01)
温爱萍,女,主管药师,主要从事临床药学工作。E-mail:wenaiping@126.com
