自身免疫性心肌炎中Th17/Treg细胞及其相关因子的动态变化
2015-01-04陈清泉房光萃杨秀霖陈开杰
陈清泉 房光萃 曾 彧 杨秀霖 陈开杰 陈 敏*
(1福建医科大学医学技术与工程学院医学检验系,福州350004;2厦门大学附属东南医院,漳州36000)
心肌炎(Myocarditis)是指各种病因引起的心肌肌层局限性或弥漫性的炎性病变,以病毒感染引起的急性心肌炎最常见,部分转为自身免疫性心肌炎,后期可发展至扩张型心肌病(Dilated Cardiomyopathy,DCM)。DCM患者预后差,至今无特效的治疗手段,在出现充血性心力衰竭的临床表现后病死率高[1]。因此,如何有效控制心肌炎发展,是当今医学急待解决的问题。研究发现自身免疫反应在心肌炎向扩张型心肌病发展过程中起着重要的作用,这与辅助性T细胞异常活化有关,并与慢性心肌炎和心肌纤维化的发生相关[2-4]。以往认为,心肌的炎症损伤机制是由IFN-γ介导的Th1细胞介导的免疫反应过强所致,近来发现Th17/Treg细胞平衡对于控制自身免疫反应的发展起关键作用。Th17细胞属于CD4+T辅助细胞亚群,其所分泌的IL-17是一种重要的促炎因子,与多种细胞因子产生协同作用以放大炎症反应[5,6]。视黄酸相关孤儿受体 (retinoic acid-related orphan receptor,RORγt),是调控Th17细胞分化发育的特异性转录因子。调节性T细胞(regulatory T cell,Treg)是发挥负向调节免疫作用的T淋巴细胞亚群,表达具有特异性调节作用的叉头样转录因子(foxhead box protein 3,Foxp3),活化后主要分泌IL-10和转化生长因子β(Transforming growth factor-β,TGF-β),抑制免疫细胞活化,从而抑制自身免疫反应[7,8]。有研究报道,Treg细胞数量减少、Th17/Treg细胞失衡与类风湿性关节炎、系统性红斑狼疮、重症肌无力等多种自身免疫性疾病的发生发展有关[9,10],但在自身免疫性心肌炎中Th17/Treg细胞分化的规律及其作用尚未清楚。本文通过实验性自身免疫性心肌炎(Experimental Autoimmune Myocarditis,EAM)小鼠模型,研究EAM小鼠心肌组织中Th17及Treg细胞相关的RORγt、Foxp3、IL-17和TGF-βm RNA表达水平,以及血清IL-17和TGF-β的变化,分析Th17细胞和Treg细胞相关因子在EAM小鼠心肌组织中的变化规律,为寻找自身免疫性心肌炎的免疫治疗方法提供新的思路和实验依据。
材料和方法
1.实验动物
36只11-12周雄性健康SPF级Balb/C小鼠(许可证号:SCXK(沪)2012-0002),体质量18-22 g,由上海斯莱克实验动物有限责任公司提供。饲养条件:室温20-25℃;空气流通,相对湿度40%-70%;动物自由摄食和饮水。
2.方法
2.1 EAM模型建立
参考Toyozaki等[11]的方法,将实验动物随机分为EAM组与正常对照两大组。EAM组小鼠18只:第0 d和第7 d,于小鼠左右侧腹股沟、腋下等部位多点皮下注射心肌肌球蛋白(Sigma公司)和弗氏完全佐剂混合乳0.2 ml(含心肌肌球蛋白0.1 mg);正常对照组18只:同剂量PBS代替心肌肌球蛋白。初次免疫后于7、21、56 d实验组和对照组随机抽取6只小鼠,眼眶采血后处死小鼠迅速取出心脏HE染色和PCR检测。
2.2 HE染色
组织切片常规脱蜡至水化,将脱蜡干净的切片浸入苏木素液5 min;自来水冲洗后,1%盐酸酒精分化15 s,自来水冲洗至细胞核蓝色,结缔组织无色;入蒸馏水5 min;甩干水分,浸入1%酒精伊红染色液染色3 min;浸入70%酒精快速清洗,之后梯度乙醇浸洗脱水,再经过二甲苯使切片透明,将染色完成的切片从二甲苯中取出,滴上中性树胶,盖上盖玻片,镜检。
2.3 RT-PCR 检 测 IL-17、RORγt、Foxp3 和TGF-βm RNA 表达
利用Trizol一步法提取心脏组织总RNA,并逆转录合成cDNA。以2μl cDNA为模板,应用上下游引物行PCR扩增。95℃预变性5 min;执行35个循环:94℃变性30 s,53℃退火30 s,72℃延伸60 s,最后72℃总延伸10 min。取5μl扩增产物行2%琼脂糖凝胶电泳,染色,在紫外线投射仪下观察电泳条带,目的基因mRNA表达量=目的基因DNA条带/β-actin DNA条带灰度值。引物序列详见表1。

表1 RT-PCR引物序列Table 1
2.4 ELISA 检测IL-17和 TGF-β
眼眶取血滴于1.5 ml EP管中,室温静置30 min,3000 r/min离心15 min,取上层血清。按照IL-17和TGF-β的ELISA试剂盒(R&D公司)说明书进行检测。
3.统计学分析
所有数据以均数 标准差表示,采用SPSS17.0软件进行分析。各组之间的均数比较采用单因素方差分析,组间两两比较采用Student-Newman-Keuls检验,P<0.05为差异有统计学意义。
结 果
1.各组心肌组织病理学变化
正常对照组小鼠心肌细胞排列整齐,细胞间隙正常(图A),EAM组小鼠出现不同程度的病理改变,7 d组小鼠心肌细胞肿胀,相邻细胞间隙增大,排列紊乱(图B),21 d组心外膜下及心肌间质有大量炎症细胞浸润,肌纤维排列紊乱,核大深染、异型(图C),56 d组炎症细胞浸润明显减少,部分心肌细胞断裂,纤维增生 (图D)。以上病理学变化表明EAM模型建立成功。
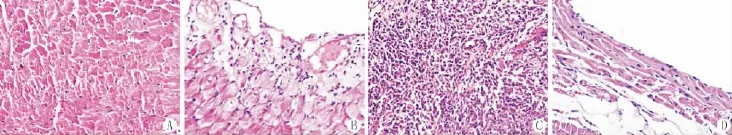
图1 心肌组织病理变化(HE染色×200)A:对照组,B:EAM 7 d组,C:EAM 21 d组,D:EAM 56 d组 (HE×200)Fig.1 The pathology changes of the myocardial tissue in each group(HE×200)A:Normal group;B:Experimental group 7 d;C:Experimental group 21 d;D:Experimental group 56 d.
2.各 组 心 肌 组 织 IL-17、RORγt、Foxp3 和TGF-βm RNA的表达水平
EAM 21 d组心肌组织IL-17、RORγt、Foxp3、TGF-βm RNA的表达水平明显高于正常对照组(P<0.01);EAM 7 d组、56 d组表达量与正常对照组的差异无显著性意义(P>0.05),但低于EAM 21 d组 (P<0.05);对照组各时点之间比较无差异(P>0.05)(图2)。
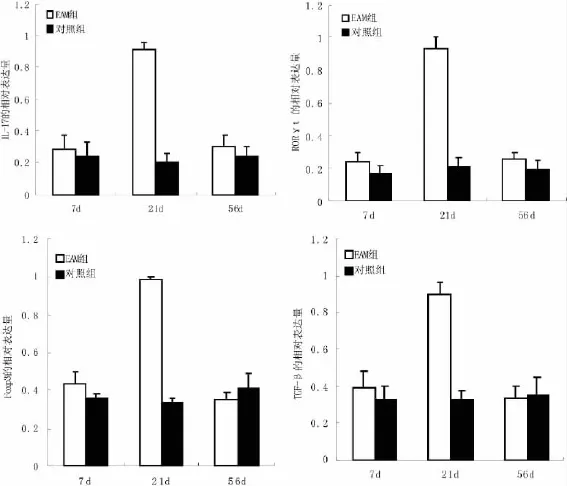
图2 各组心肌组织IL-17、RORγt、Foxp3和TGF-βmRNA的表达水平a P<0.01 vs对照组;b P<0.05 vs EAM 7 d组和56 d组Fig.2 the expression of the mRNA of IL-17,RORγt,Foxp3and TGF-βin cardial tissue of each group tested by RT-PCRa P<0.01 compared with normal group;b P<0.05compared with EAM group 7 d and 56 d
3.各组血清IL-17和TGF-β浓度变化
图3显示,EAM 21 d组外周血IL-17水平明显高于正常对照组(P<0.01),也高于EAM 7 d组和56 d组 (P<0.05),EAM 21 d和56 d组血清TGF-β水平较正常对照组升高 (P<0.05),EAM 7 d组血清IL-17和TGF-β水平与正常对照组比较无显著性差异(P>0.05)。
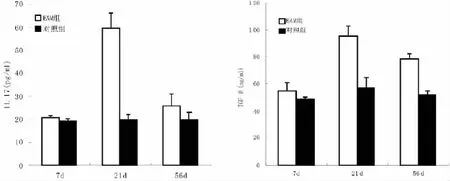
图3 ELISA法检测小鼠血清中IL-17、TGF-β含量变化a P<0.05 vs对照组;c P<0.05 vs EAM 7 d组和56 d组;e P<0.05 vsEAM 7 d组Fig.3 The level of IL-17 and TGF-βin mice peripheral blood serum tested by ELISAa P<0.05 compared with normal group 21 d;c P<0.05 compared with EAM group 7 d and 56 d;e P<0.05 compared with EAM group 7 d
4.心肌组织RORγt/Foxp3 mRNA相对表达量
EAM 21 d组与56 d组RORγt/Foxp3 m RNA比值较正常对照组明显升高(P<0.05)(图4)。
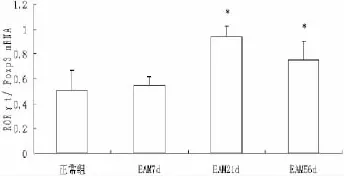
图4 各组小鼠RORγt/Foxp3 mRNA相对表达量*P<0.05 vs对照组和EAM 7 d组Fig.4 Expression of RORγt/Foxp3 m RNA in myocardial tissue of each group*P<0.05 compared with normal group and EAM group 7 d
讨 论
心肌炎是心肌自身的炎症病变,急性期多见于病毒感染等因素侵犯心肌引起直接损伤,后期可继发针对心肌肌球蛋白的免疫应答,造成进一步心肌损伤。其病理过程与实验性自身免疫性心肌炎发生机制和结局有较多的共性,与多种T细胞异常活化介导的自身免疫反应有关,其中促炎性Th17细胞与抑制性Treg细胞之间平衡状态的打破与多种疾病的发生密切相关[12-13],是自身免疫性疾病持续发展的关键因素之一。
本文发现,在EAM组心肌组织炎症初期,IL-17 mRNA表达量升高,21 d组达到高峰水平。同时外周血中IL-17含量与心肌组织RORγt mRNA呈现类似变化。RORγt是控制Th17细胞活化的关键转录因子[14],其在EAM炎症过程中的高表达,促进初始CD4+T细胞分化为Th17细胞,分泌IL-17。IL-17作为重要的炎症介质,通过强大的招募中性粒细胞及激活其他免疫细胞,促进多种细胞释放下游炎性因子[5,6],导致心肌炎症损伤甚至坏死。Alunno[15]认为,在系统性红斑狼疮中Th17细胞发挥了主要的致炎作用,而Treg细胞功能下降,导致自身免疫性疾病进入慢性阶段。说明Th17细胞功能亢进,促进炎症反应、自身免疫性疾病等的发生与发展。
Treg细胞是一群具有免疫调节功能的T细胞亚群,通过分泌TGF-β和IL-10两类抑制性细胞因子,发挥免疫调节作用,抑制自身反应性T细胞和部分效应性T细胞活化和增殖,减轻炎症反应。Foxp3为Treg细胞发育过程中的核心转录因子[7],可调控初始T细胞向Treg转化。Zhang等[8]发现注射Treg细胞明显减轻病毒性心肌炎急性期的炎症反应,起到保护心肌组织,改善心脏功能的作用。本文结果显示EAM 21 d组心肌组织TGF-β和Foxp3 mRNA表达水平明显高于对照组,血清TGF-β含量也显著升高。TGF-β具有多重功能,在不同情况下可表现抗炎与促炎的不同作用。在高浓度的TGF-β与IL-6共同诱导作用下,初始CD4+T细胞分化为Th17细胞,而TGF-β单独作用可诱导Treg细胞分化。因此推测EAM 21 d组TGF-β升高对Th17细胞分化产生促进作用,使得心肌炎症反应在同一时期达到高峰。EAM 56 d组Treg细胞表达降低,发挥免疫抑制作用的细胞数减少,不能有效控制自身反应性T细胞激活,导致自身免疫反应的持续存在。提示在心肌炎症阶段存在Th17细胞与Treg细胞及其相关因子失衡状态。抑制Th17分化或增强Treg功能,调节Th17/Treg细胞动态平衡将有助于减轻心肌组织炎症反应。
综上所述,本研究发现实验性自身免疫性心肌炎与Th17相关转录因子及细胞因子的高表达密切相关,研究Th17/Treg细胞分化在自身免疫性心肌炎发生发展的作用,有助于进一步阐明自身免疫性心肌炎的发病机制,为寻找有效的心肌炎免疫治疗方法提供新思路。
[1]Schultheiss HP,Kuhl U,Cooper LT.The management of myocarditis.Eur Heart J,2011,32(21):2616-2625
[2]Nindl V,Maier R,Ratering D,et al.Cooperation of Th1 and Th17 cells determines transition from autoimmune myocarditis to dilated cardiomyopathy.Eur J Immunol,2012,42(9):2311-2321
[3]陈敏,吴卉卉,沈晓丽等.基质金属蛋白酶及其抑制因子与扩张型心肌病的关系.中国组织化学与细胞化学杂志,2011,20(1):27-32
[4]Ueda H,Howson JM,Esposito L et al.Association of the T cell regulatory gene CTLA-4 with susceptibility to autoimmune disease.Nature,2003,423(9):506-511
[5]Huang G,Wang Y,Chi H.Regulation of TH17 cell differentiation by innate immune signals.Cell Mol Immunol,2012,9(4):287-295
[6]Song X,Qian y.IL-17 family cytokines mediated signaling in the pathogenesis of inflammatory diseases.Cell signal,2013,25(12):2335-2347
[7]Ohkura N,Kitagawa Y,Sakaguchi S.Development and maintenance of regulatory T cells.Immunity,2013,38(3):414-423
[8]Zhang Y,Jiang L,Zhang M,et al.Galectin-9 Induced Myeloid Suppressor Cells Expand Regulatory T Cells in an IL-10-Dependent Manner in CVB3-Induced Acute Myocarditis.Int J Mol Sci,2014,15(3):3356-3372
[9]Geremia A,Biancheri P,Allan P,et al.Innate and adaptive immunity in inflammatory bowel disease.Autoimmun Rev,2014,13(1):3-10
[10]Xiao J,Liu C,Li G,et al.PDCD5 negatively regulates autoimmunity by upregulating FOXP3+regulatory T cells and suppressing Th17 and Th1 responses.J Autoimmun,2013,47:34-44
[11]Toyozaki T,Saito T,Shiraishi H,et al.Macrophage inflammatory protein-1alpha relates to the recruitment of inflammatory cells in myosin-induced autoimmune myocarditis in rats.Laboratory investigation;a journal of technical methods and pathology,2001,81(7):929-936
[12]Yin H,Li X,Zhang B,et al.Sirolimus ameliorates inflammatory responses by switching the regulatory T/T helper type 17 profile in murine colitis.Immunology,2013,139(4):494-502
[13]Geremia A,Jewell DP.The IL-23/IL-17 pathway in inflammatory bowel disease.Expert Rev Gastroenterol Hepatol,2012,6(2):223-237
[14]Chen Z,Lin F,Gao Y,et al.FOXP3 and RORγt:transcriptional regulation of Treg and Th17.Int Immunopharmacol,2011,11(5):536-542
[15]Aluno A,Bartoloni E,Bistoni O,et al.Balance between regulatory T and Th17 cells in systemic lupus erythematosus:the old and the new.Clin Dev Immunol,2012:823085.
