二甲双胍激活AMPK对高糖诱发内皮细胞氧化应激的影响
2015-01-04刘艳敏宋旭红
梁 斌 袁 松 刘艳敏 宋旭红
(汕头大学医学院细胞生物学与遗传学教研室 广东515041)
随着生活方式的改变和老龄化进程的加快,糖尿病的患病率急剧增加,而糖尿病心脑血管并发症是糖尿病患者致死、致残的重要原因。目前已证实,高血糖引起的细胞内氧化应激是糖尿病慢性心血管并发症的主要发病机制之一。
氧化应激是指组织细胞在受各种有害因素刺激时,细胞内高活性分子如活性氧(ROS)和活性氮自由基(RNS)产生过多,超出细胞的清除能力导致氧化系统和抗氧化系统失衡,从而导致潜在性损伤的病理过程。其中,NADPH氧化酶是细胞内ROS生成的关键因素。研究发现,糖尿病患者组织中NADPH氧化酶的亚基表达水平增加,与糖化血红蛋白水平和糖尿病病程呈正相关[1,2]。Matsumoto等发现,噻唑烷二酮可以增加超氧化物歧化酶的活性,降低NADPH氧化酶的活性,缓解细胞内的氧化应激水平,进而改善血管内皮细胞功能[3]。
二甲双胍是目前使用最广的双胍类口服降糖药物,也是目前惟一有证据表明可以降低II型糖尿病患者心血管并发症的降糖药物,且心血管保护作用可能独立于其降糖作用之外,能抑制动脉粥样硬化、心衰、心肌梗死等心血管病的发生和发展[4]。但其确切的心血管保护机制以及对细胞内氧化应激的影响仍不十分明确。本研究以高糖诱导内皮细胞和STZ诱导的糖尿病小鼠作为模型并用二甲双胍进行干预,通过western blot、免疫组化和免疫荧光检测,观察二甲双胍对高糖诱导的血管内皮细胞氧化应激的影响,探讨其在糖尿病病程中可能的心血管保护机制,为糖尿病临床治疗及预防提供理论依据及可能的解决方案。
材料和方法
1.材料及试剂
抗体:AMPKα、phospho-AMPKα(T172)抗体购自Cell Signalling(Danvers,MA),p67phox抗体购自GeneTex Inc.(Irvine,CA),p47phox抗体,3-NT (3-nitrotyrosine)抗体,MDA(malondialdehyde)抗体购自Santa Cruz Biotechnology(Santa Cruz,CA),4-HNE(4-hydroxynonenal)抗体购自 Cell Biolabs,Inc.(San Diego,CA)。 二 甲 双 胍 (metformin)、链 脲 菌 素(Streptozotocin),MG132 购 自 Sigma-Aldrich (St.Louis,MO),AICAR(5-Aminoimidazole-4-carboxamide 1-β-D-ribofuranoside) 购 自 Toronto Research Chemicals Inc.(Toronto,Canada)。
2.方法
2.1 细胞培养
人主动脉内皮细胞株HAEC购自美国模式培养物集存库(ATCC),按细胞说明书中指示,用含10%胎牛血清的DMEM培养基添加营养生长因子,于37℃、5%CO2培养箱中培养。高糖诱导处理采用高糖DMEM培养基(25 mmol/L)添加10%胎牛血清和营养生长因子培养。
2.2 Western blot
收集对数生长期的细胞,分组诱导孵育后,提取总蛋白,BCA法测定蛋白浓度,SDS-PAGE电泳分离蛋白样品,电转移至NC膜,5% 脱脂奶粉室温封闭1 h,用TBST稀释一抗后,4℃孵育过夜。次日洗膜后二抗室温孵育1 h,洗膜后ECL发光显影,以β-actin作为实验内参,分析目标条带的表达变化。
2.3 免疫组化及免疫荧光检测
组织切片经二甲苯酒精脱腊、水化后,放入0.01 mol/L柠檬酸钠缓冲溶液(p H6.0)在微波炉轻微沸腾并保持15 min,以修复抗原。BSA室温封闭1 h后,一抗4℃孵育过夜。次日清洗后二抗室温孵育1 h,清洗后DAB染色再封片观察。免疫荧光检测为细胞爬片经4%甲醛固定及穿孔处理后,经以上步骤(无需脱腊、水化、抗原修复)至一抗过夜后,清洗后再以荧光二抗室温孵育1 h后清洗封片,上荧光显微镜观察。
3.统计学处理
采用SPSS15.0统计软件包进行统计学处理。计量资料用±s表示,组间两两比较采用Student Newman Keul S(SNK)检验,以P<0.05为差异有统计学意义。
结 果
1.高糖培养可诱导内皮细胞HAEC中NADPH氧化酶亚基p47phox和p67phox表达上调
首先,人主动脉血管内皮细胞HAEC经高糖培养基诱导后,Western blot检测可见NADPH氧化酶的亚基p47phox蛋白和p67phox蛋白表达上调,且存在时间依赖性。其中,p47phox在培养2 h、p67phox在培养4 h后表达有明显增加。
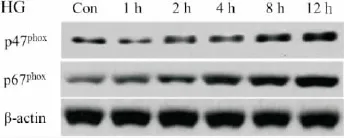
图1 高糖诱导人主动脉血管内皮细胞不同时间的NADPH氧化酶亚基p47phox和p67phox的表达。Fig.1 The time course of expression of NADPH oxidase subunit p47phox and p67phox induced by high glucose in human aortic endothelial cell(HAEC).
2.二甲双胍可激活AMPK并抑制内皮细胞中NADPH氧化酶p47phox和p67phox亚基的表达
随后,我们在高糖培养内皮细胞4 h后,分别加入AMPK激活剂AICAR(2 mmol/L)和二甲双胍(1 mmol/L)共同培养。Western blot检测发现,AICAR和二甲双胍均可在培养2 h后激活AMPK。同时,随着AMPK的激活,细胞内NADPH氧化酶亚基p47phox和p67phox的表达逐渐减少(图2A和图2B)。免疫荧光检测结果也显示二甲双胍可减少因高糖诱导的NADPH氧化酶亚基p47phox和p67phox的表达。本结果提示,二甲双胍可通过激活AMPK抑制p47phox和p67phox的表达。
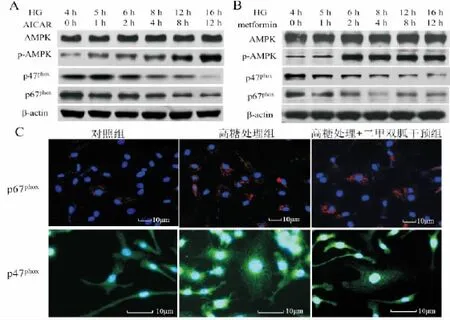
图2 二甲双胍对内皮细胞HAEC中 NADPH氧化酶p47phox和p67phox亚基的表达的影响。A.Western blot检测AMPK激活剂AICAR对内皮细胞HAEC中NADPH氧化酶p47phox和p67phox亚基的表达的影响。B.Western blot检测二甲双胍对内皮细胞HAEC中NADPH氧化酶p47phox和p67phox亚基的表达的影响。C.免疫荧光检测二甲双胍对内皮细胞HAEC中NADPH氧化酶p47phox和p67phox亚基的表达的影响。红色和绿色荧光分别指示相应目的蛋白表达。Fig.2 The effects of metformin on expression of NADPH oxidase subunit p47phox and p67phox in human aortic endothelial cell(HAEC).A.Western blot analysis shows the effects of AMPK activator AICAR on the expression of p47phox and p67phox in HAEC cell.B.Western blot analysis shows the effects of metformin on the expression of p47phox and p67phox in HAEC cell.C.Immunofluorescence analysis shows the effects of metformin on the expression of p47phox and p67phox in HAEC cell.The red and green fluorescent light indicate the expression of proteins respectively.
3.二甲双胍可降低糖尿病小鼠模型主动脉血管内皮细胞中的氧化应激水平
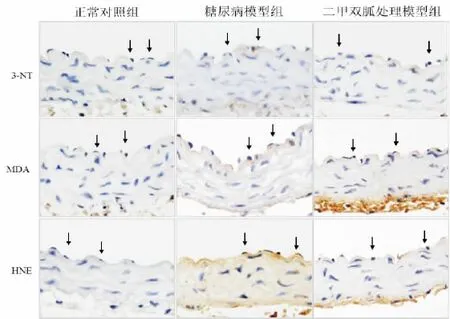
图3 免疫组化检测二甲双胍对糖尿病小鼠模型主动脉内皮细胞氧化应激的影响。3-NT(3-nitrotyrosine),MDA(malondialdehyde)和HNE(4-hydroxy-2-nonenal)为细胞氧化应激过程中的标志性氧化产物。图中黑色实心箭头示主动脉血管内皮细胞。Fig.3 Immunohistochemistry analysis shows the effect of metformin on the oxidative stress in aortic endothelial cell from diabetic mice models.
最后,本研究以二甲双胍干预的糖尿病模型小鼠来观察其对主动脉内皮细胞中氧化应激水平的影响。实验发现,糖尿病模型组小鼠消瘦,毛色杂乱无光泽,精神萎靡,行动迟缓,反应迟钝,出现不同程度的多饮、多食、多尿症状。二甲双胍干预的糖尿病模型组与未干预糖尿病模型组相比,小鼠多饮、多食、多尿、消瘦症状在治疗后明显减轻,血糖水平有明显降低,差异有统计学意义(P<0.05),体质量明显升高,差异有统计学意义(P<0.05)。
以往研究发现,自由基与DNA、蛋白质和脂类反应后生成的氧化产物,可以作为反映自由基水平或者氧化应激水平的标志物[5-8]。经以上的血糖和体重检测证明二甲双胍对模型高血糖的抑制作用后,我们通过免疫组化方法进一步检测了小鼠主动脉血管内皮细胞中氧化应激标志产物3-NT,MDA和4-HNE的表达。结果显示,经二甲双胍干预的糖尿病模型小鼠其血管内皮细胞中以上三种氧化应激标志物的水平均较未干预的模型小鼠内皮细胞中的水平明显降低,显示二甲双胍可缓解糖尿病小鼠血管内皮细胞中的氧化应激水平。
讨 论
在糖尿病和胰岛素抵抗的情况下,氧化应激(oxidative stress)水平明显增高,可能是糖尿病微血管病变和大血管病变的主要原因。随着对氧化应激机制的深入研究,发现NAD(P)H 氧化酶是Ros生成的关键因素。近年研究发现,NAD(P)H氧化酶不仅存在于吞噬细胞,也广泛存在于非吞噬细胞中,如血管内皮细胞、成纤维细胞等。虽然该酶参与血管病变的机制目前还不完全明确,但研究已证明NAD(P)H氧化酶参与氧化应激至少包括两个环节:一是NAD(P)H氧化酶在各种因素作用下表达增加或活性增强,产生过多的活性氧;二是过多的活性氧通过各种细胞内或细胞间的信号传导途径引起氧化还原相关基因表达,参与血管壁构成细胞的各种病理生理过程,如血管平滑肌增生,影响血管的舒缩功能,激活炎症反应等,从而引起各种心脑血管疾病的发生。因此,抗氧化治疗可以减轻氧化应激,从而阻止或延缓糖尿病及其并发症的发生、发展,这也是现代临床治疗糖尿病相关并发症尤其是心脑血管病变时,均以抑制氧化应激反应为主要措施的原因。但一些研究结果表明,现有的抗氧化剂对糖尿病并发症的预防和治疗仍缺乏有效性。维生素类药物如维生素C的抗氧化作用在体外实验中已得到证实,但临床应用的结果却未得到流行病学调查数据的支持[9]。因此,研究开发新的抗氧化药物是当前防治糖尿病的心血管并发症的当务之急。
近年来大量临床和基础研究均发现,二甲双胍具有降糖作用外的心血管保护作用。这种保护作用的具体机制仍不明确,可能通过降血脂,降血压,改善IR等作用,减少心血管疾病的危险因素,从而达到心血管保护作用[10,11]。体内外研究均证实,二甲双胍可增加内皮一氧化氮合酶(eNOS)的磷酸化及其表达,从而增加血浆NO水平及降低全身血管阻力,起到改善内皮功能的作用[12]。Gallo A等人研究发现,二甲双胍可通过增加抗氧化酶的产生抑制高糖诱导的脐静脉内皮细胞ROS生成[13]。本研究发现,二甲双胍可通过激活内皮细胞中AMPK激酶活性,抑制NADPH氧化酶的胞质内亚基p47phox和p67phox的表达,从而缓解细胞内氧化应激。动物实验结果也证明,与糖尿病模型组小鼠相比,小鼠主动脉血管内皮细胞的氧化应激标志性产物3-NT(3-nitrotyrosine),MDA(malondialdehyde)和 HNE(4-hydroxy-2-nonenal)的表达均明显降低,证明二甲双胍具有确切的心血管保护作用,这种作用可能由于AMPK的激活缓解了细胞内的氧化应激,从而减少血管内皮细胞的损伤。因此,本研究探讨了二甲双胍、氧化应激与糖尿病心血管并发症之间的相互关系,有助于进一步深入了解糖尿病及其并发症的发病机制,为糖尿病及其并发症的治疗及预防提供了一个新的方案。
[1]Kitada M,Koya D,Sugimoto T,et al.Translocation of glomerular p47phox and p67phox by protein kinase C-beta activation is required for oxidative stress in diabetic nephropathy.Diabetes,2003,52(10):2603-2614
[2]Adaikalakoteswari A,Balasubramanyam M,Rema M,et al.Differential gene expression of NADPH oxidase(p22phox)and hemoxygenase-1 in patients with Type 2 diabetes and microangiopathy,Diabetic medicine :a journal of the British Diabetic Association.2006,23(6):666-674
[3]Matsumoto T,Noguchi E,Kobayashi T,et al.Mechanisms underlying the chronic pioglitazone treatment-induced improvement in the impaired endothelium-dependent relaxation seen in aortas from diabetic rats.Free radical biology & medicine,2007,42(7):993-1007
[4]Ong CR,Molyneaux LM,Constantino MI,et al.Longterm efficacy of metformin therapy in nonobese individuals with type 2 diabetes.Diabetes Care,2006,29(11):2361-2364
[5]Wu LL,Chiou CC,Chang PY,et al.Urinary 8-OHd G:a marker of oxidative stress to DNA and a risk factor for cancer,atherosclerosis and diabetics.Clin Chim Acta,2004,339(1-2):1-9
[6]Hoeldtke RD,Bryner KD,Mc Neill DR,et al.Nitrosative stress,uric acid,and peripheral nerve function in early type 1 diabetes.Diabetes,2006,51(9):2817-2825
[7]Nishikawa T,Sasahara T,Kiritoshi S,et al.Evaluation of urinary 8-hydroxydeoxy-guanosine as a novel biomarker of macrovascular complications in type 2 diabetes.Diabetes Care,2003,26(5):1507-1512
[8]Moazamian R,Polhemus A,Connaughton H,et al.Oxidative stress and human spermatozoa:diagnostic and functional significance of aldehydes generated as a result of lipid peroxidation,Mol Hum Reprod,2015,21(6):502-515
[9]Asplund,K.Antioxidant vitamins in the prevention of cardiovascular disease:a systematic review.J Intern Med,2002,251(5):372-392
[10]Hattori Y,Suzuki K,Hattori Set al.Metformin inhibits cytokine-induced nuclear factor kappaB activation via AMP-activated protein kinase activation in vascular endothelial cells.Hypertension,2006,47(6):1183-1188
[11]DejagerJ,Kooy A,Lehert P,et al.Effects of short-term treatment with metformin on markers of endothelial function and inflammatory activity in type 2 diabetes mellitus:a randomized,placebo-controlled trial.J Intern Med,2005,257(1):100-109
[12]Mather KJ,Verma S,Anderson TJ.Improved endothelial function with metformin in type 2 diabetes mellitus.J Am Coll Cardiol,2001,37(5):1344-1350
[13]Gallo A,Ceolotto G,Pinton P,et al.Metformin prevents glucose-induced protein kinase C-beta2 activation in human umbilical vein endothelial cells through an antioxidant mechanism.Diabetes,2005,54(4):1123-1131
