大鼠局灶性脑缺血再灌注后免疫蛋白酶体的变化
2015-01-04陈兴泳汪银洲汪效松雷惠新唐荣华
陈兴泳 汪银洲 汪效松 雷惠新 唐荣华 张 旭*
(1福建医科大学省立临床医学院 福建省立医院神经内科 福州350001;2华中科技大学同济医学院附属同济医院神经内科 武汉430030)
神经炎症反应是脑缺血再灌注损伤的重要机制之一[1],最近研究表明免疫蛋白酶体与中枢神经炎症反应密切相关[2]。本研究利用SD大鼠局灶性脑缺血再灌注模型,探讨免疫蛋白酶体LMP2和LMP7与神经炎症反应的关联性,初步了解免疫蛋白酶体在局灶性脑缺血再灌注损伤中的作用。
材料和方法
1.主要仪器和试剂
MCAO线栓(北京沙东生物技术公司,中国),CM1900型冰冻切片机(Leica,德国),组织荧光显微镜(Olympus,日本),Soniprep 150超声波细胞破碎仪(Sanyo,日本),Millpore PVDF膜(Millpore,美国),Mini Trans-Blot型电转 设 备 (Bio-Rad,美国),PBS(武汉博士德生物有限公司,中国),10%封闭用山羊血清(KPL,美国),哺乳动物组织蛋白裂解液(Pierce,美国),ECL发光液(Millpore,美国),rabbit anti-LMP2,rabbit anti-LMP7 (均购买 Abcam,Cambridge,UK),mouse anti-Neu N,mouse anti-OX-42 (Millipore,美 国),goat anti-IL-1β,goat anti-TNF-α(R&D Systems,Inc.美 国),mouse anti-GFAP,NF-κB p65 mouse(Cell Signaling Technology,美国),mouse monoclonal anti-βactin (Proteintech Group Inc.,美 国),FITC-goat anti-rabbit IgG antibodies,Alexa Fluor®555 conjugated goat anti-mouse IgG (H+L),F(ab')2 Fragment,FITC-donkey anti-rabbit IgG,Cy3-donkey anti-goat IgG),horseradish peroxidase-conjugated goat anti-mouse IgG (EarthOx,美 国) ,horseradish peroxidase-conjugated goat anti-rabbit IgG antibodies(Cell Signaling Technology,美国),horseradish peroxidase-conjugated rabbit anti-goat IgG antibodies(Invitrogen,美国),DAPI(Sigma,美国)。
2.动物分组和大鼠大脑中动脉阻塞再灌注(middle cerebral artery occlusion,MCAO)模型构建
Sprague-Dawley(SD)大鼠,体重250 g左右,购自中山大学实验动物中心,分为:假手术组(shamoperated group)(简称sham 组)、脑梗死组(middle cerebral artery occlusion,MCAO)(简称mcao组),每组10只。参照Longa[3]方法建立脑缺血1 h再灌注时间72 h的MCAO模型,具体步骤简要阐述如下:10%水合氯醛腹腔注射麻醉(350 mg/kg),术中维持体温37℃左右。将大鼠仰卧位固定在手术板上,消毒皮肤,铺盖无菌洞巾,取颈部正中切口约2.5 cm;钝性分离筋膜、肌肉,小心分离出右侧颈总动脉、颈内动脉、颈外动脉,结扎颈外动脉在靠近颈总动脉分叉处,随后在颈总动脉远端靠近颈总动脉分叉处1.5 cm处结扎颈总动脉。用眼科剪将距离颈总动脉分叉处1 cm的颈总动脉剪一小口,插入线栓(直径约为0.204 mm的尼龙线,头端打磨呈球形且用多聚赖氨酸包被),放开颈内动脉微动脉夹。将线栓经颈内动脉轻柔插入长度自颈内动脉分叉处约18-20 mm,阻断大脑中动脉的血流。固定线栓,缝合肌肉、皮肤,注意保温。再灌注:缺血60 min后不完全拔出线栓,恢复血流。模型成功判断标准采用Longa[3]0-4级评分法,1分≤神经功能缺损评分≤3分的大鼠选入组。假手术组大鼠给予类似手术操作,插入线栓长度为10 mm,不阻塞大脑中动脉。
3.组织免疫荧光染色方法
将时间点实验大鼠用10%水合氯醛腹腔注射深度麻醉后,灌注4%多聚甲醛,充分暴露并剥离脑组织,取自额极起4-11 mm之间的脑组织,置于4%多聚甲醛于4℃冰箱固定24-48 h。将固定好的脑组织依次放入20%、30%蔗糖(含体积比4%丙三醇)脱水直至沉底。在Leica冰冻切片机内用OTC胶包埋脑组织,自前段大约视交叉水平开始,行10 μm厚连续冠状切片,使切片贴在玻片上。用0.01 mol/L PBS振荡清洗3次,每次5 min。含0.25%Trixton-100的0.01 mol/L PBS透膜。微波抗原修复,正常山羊血清或者1%BSA(依据抗体不同)室温下封闭 1 h。 分 别 滴 加 下 列 一 抗:rabbit anti-LMP7(1∶500),rabbit anti-LMP2(1∶500),mouse anti-NeuN(1∶400),mouse anti-GFAP(1∶1000),mouse anti-OX-42(1∶300),mouse NF-κB p65(1∶50),goat anti-TNF-α(1∶500),goat anti-IL-1β(1∶500),放在湿盒中4℃孵育过夜。次日取出切片放入0.01 mol/L PBS振荡清洗,滴加相匹配的下列荧光二抗:FITC-goat anti-rabbit IgG antibodies(1∶200),Alexa Fluor?倕555 conjugated goat anti-mouse IgG(H+L),F(ab')2 Fragment(1∶1000),FITC-donkey antirabbit IgG(1∶100),Cy3-donkey anti-goat IgG(1∶100),室温避光孵育1 h。滴加DAPI(1∶1000)复染。滴加抗荧光淬灭剂Pro Long®Gold,盖玻片封片,避光储存于湿盒。荧光显微镜下观察,激发/发射波长为488/525 nm的FITC呈绿色荧光,激发/发射波长为550/565 nm的Cy3、Alexa Fluor®555呈红色荧光。阴性对照以100μl PBS代替一抗,其余处理步骤同上。参照参考文献[4]方法统计400×视野下荧光阳性细胞,每张切片取3个互不重叠部位,每个标本取3张切片,用Image-Pro Plus软件分析,取平均值。
4.Western blot
将冻于液氮中的缺血周围组织和假手术组脑组织按照1∶3(wt/vol)加入哺乳动物组织细胞裂解液,同时加入体积比100∶1的蛋白酶抑制剂,于冰上用充分研磨和超声裂解,在4℃低温离心机15000 r/min离心30 min,取上清液置于另一1.5 ml离心管中,BCA法蛋白定量。每道30μg蛋白上样,在10%SDS-聚丙烯酰胺凝胶电泳,电转移至硝酸纤维膜上,依相对分子质量大小切取条带,室温下封闭1 h。然后分别加入TBST稀释的一抗,4℃孵育过夜(>12 h)。次日,洗膜后分别加入相对应的二抗,室温下孵育1-2 h。各指标一抗稀释倍数、二抗稀释倍数 如 下:rabbit anti-LMP7(1∶1000),rabbit anti-LMP2(1∶2500),mouse NF-κB p65(1∶500),goat anti-TNF-α(1∶5000),rabbit anti-IL-1β(1∶1000),mouse monoclonal anti-β-actin (1∶3500),horseradish peroxidase-conjugated goat anti-mouse IgG(1∶6000),horseradish peroxidase-conjugated goat anti-rabbit IgG antibodies(1∶3000),horseradish peroxidase-conjugated rabbit anti-goat IgG antibodies(1∶3000)。ECL显色。曝光,显影,定影,扫描图片。用Image J软件进行分析,每个蛋白条带都有一个光密度值。将各组的目的蛋白光密度值除以β-actin光密度值,即各组目的蛋白的相对表达量。
5.统计学方法
采用SPSS13.0统计软件进行数据分析。所得数据以均数±标准差(±s)表示,两样本均数比较选用两独立样本t检验,P<0.05表示有统计学意义。
结 果
1.局灶性脑缺血再灌注后免疫蛋白酶体LMP2表达变化
免疫荧光显示,MCAO组缺血侧皮层LMP2荧光阳性细胞数量和强度明显高于假手术组;LMP2表达弥散分布在胞浆、核周和核内(图1A);LMP2阳性细胞大部分与GFAP阳性的星形胶质细胞共定位,小部分与OX42阳性的小胶质细胞/巨噬细胞共定位,个别NEUN阳性的神经元似乎与LMP2荧光阳性细胞具有共定位(图1B-D)。Western blot结果表明:与假手术组比较,mcao组梗死侧皮层和基底节区LMP2蛋白水平升高,约为假手术组的7倍(图1E)(P<0.001)。
2.局灶性脑缺血再灌注后免疫蛋白酶体LMP7表达变化
免疫荧光显示,假手术组大鼠皮层只有极个别微弱的LMP7荧光阳性细胞,mcao组缺血侧皮层LMP7荧光阳性细胞数量和强度显著地高于假手术组,LMP7表达弥散分布在胞浆、核周和核内(图2A)。LMP7阳性的细胞大部分与OX42阳性的小胶质细胞/巨噬细胞共定位,少部分与GFAP阳性的星形胶质细胞,与NEUN阳性的神经元无明显共定位(图2B-D)。Western blot结果表明:与假手术组比较,mcao组梗死侧皮层和基底节区LMP7蛋白水平升高,约为假手术组的9倍(图2E)(P<0.001)。
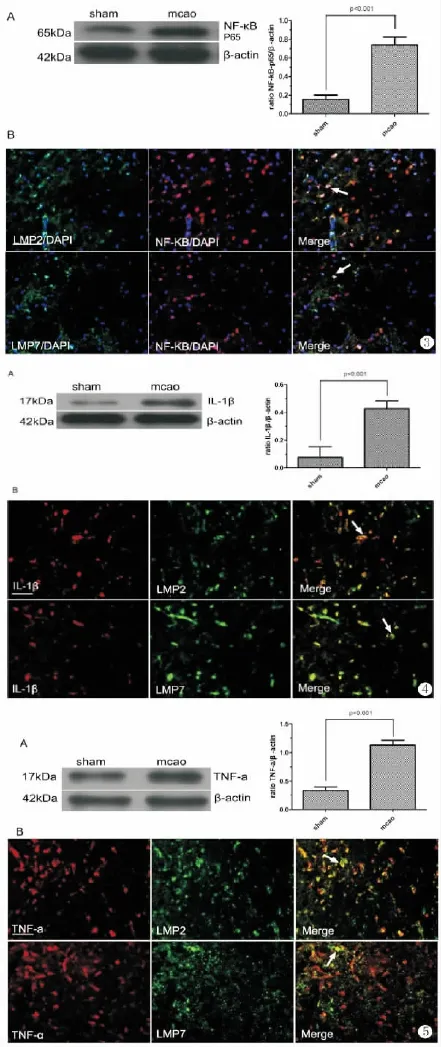
3.局灶性脑缺血再灌注后NF-κB的变化及与免疫蛋白酶体的关系
Mcao组梗死侧皮层和基底节区NF-κB蛋白表达升高,约为假手术组的5倍(图3A)(P<0.001)。免疫荧光双标显示NF-κB与LMP2、LMP7有部分的共定位(图3B)。
4.局灶性脑缺血再灌注后IL-1β的变化及与免疫蛋白酶体的关系
Mcao组梗死侧皮层和基底节区IL-1β蛋白表达升高,大约是假手术组的6倍(P<0.001,图4A)。免疫荧光双标显示IL-1β分别与 LMP2、LMP7具有一定程度的共定位(图4B)。
5.局灶性脑缺血再灌注后TNF-α的变化及与免疫蛋白酶体的关系
Mcao组梗死侧皮层和基底节区TNF-α蛋白表达升高,大约是假手术组的4倍(P<0.001,图5A)。免疫荧光双标显示TNF-α分别与LMP2、LMP7具有一定程度的共定位(图5B)。
讨 论
研究利用SD大鼠局灶性脑缺血再灌注模型,发现:①局灶性脑缺血再灌注后可诱导上调LMP2和LMP7表达,尤其在梗死灶周边的皮层和纹状体区;②脑内星形胶质细胞、活化的小胶质细胞/巨噬细胞分别是LMP2和LMP7最主要的细胞来源;③LMP2和LMP7与核转录因子NF-κB、炎症因子TNF-α、IL-1β具有一定程度上的细胞共定位;④脑缺血再灌注后LMP2和LMP7蛋白表达与NF-κB、TNF-α、IL-1β的蛋白表达趋势具有一致性。因此,推测免疫蛋白酶体可能参与缺血性脑卒中后神经炎症反应调节,在脑缺血再灌注损伤中起着重要的作用。
20S蛋白酶体组成性表达在哺乳动物细胞,又称组成性20S蛋白酶体或者标准蛋白酶体,其结构不是一成不变的,在IFN-γ[5]、缺血[6]、氧化应激[7]、炎症反应[8]等刺激诱导下,其β亚单位的β1、β2和β5可相应被 LMP2(β1i)、MECL-1(β2i)和 LMP7(β5i)取代,组装成新的20 S蛋白酶体,因为LMP2、MECL-1和LMP7能够增强蛋白酶体产生与主要组织相容性抗原(MHC-1)相结合多肽的能力,新形成的蛋白酶体又称免疫蛋白酶体。最近研究表明免疫蛋白酶体与中枢神经炎症反应密切相关,星形胶质细胞、小胶质细胞,甚至神经元在各种因素刺激后可表达免疫蛋白酶体,这与其功能相适应的。对急性淋巴细胞性脉络丛脑膜炎的小鼠研究发现,免疫蛋白酶体LMP2、LMP7和MECL1不仅在外周器官组织肝脏、脾脏表达增多,而且脑内表达也上调[2]。基因敲除LMP7不仅降低了脑LMP2和MECL1蛋白表达,而且明显缓解颅内感染症状,这提示LMP7是免疫蛋白酶体功能完整性重要部分,与炎症反应密切相关[2]。本研究观察到局灶性脑缺血再灌注后梗死灶周边脑组织存在炎症反应特征,炎症因子IL-1β、TNF-α上调表达。更进一步,本研究发现局灶性脑缺血再灌注后诱导免疫蛋白酶体上调表达,LMP2主要来源于GFAP阳性的星形胶质细胞,而LMP7大部分来源于OX42阳性的小胶质细胞/巨噬细胞,这些结果表明免疫炎症相关的细胞是免疫蛋白酶体LMP2和LMP7的最主要来源细胞。另有研究发现C57BL/6小鼠短暂性脑缺血再灌注后LMP2和LMP7表达定位于NEUN阳性的神经元。而在肌萎缩侧索硬化大鼠模型中,LMP7主要表达在GFAP阳性的星形胶质细胞和CD68阳性的小胶质细胞,少量与NEUN阳性的神经元共定位。可见,目前对于中枢神经系统免疫蛋白酶体表达的细胞来源还缺乏一致性,研究的差异可能与各自实验动物、模型设计和相关抗体不同有关。
卒中后神经炎症加重了脑缺血再灌注继发脑损害,这涉及许多复杂的病理生理机制,其中可能通过活化炎症相关的转录调节因子如NF-κB释放出一系列炎症物质如IL-1β和TNF-α、粘附分子、趋化因子、各种基质金属蛋白酶等介导“血管神经单元”损伤[9]。既往研究表明免疫蛋白酶体与炎症反应密切相关[10]。本研究发现脑缺血再灌注后脑免疫炎症相关细胞星形胶质细胞和活化小胶质细胞是免疫蛋白酶体LMP2和LMP7的最主要来源细胞,而且,LMP2和LMP7分别与 NF-κB、IL-1β和 TNF-α不仅具有一定程度上细胞来源共定位,而且在蛋白水平变化上也具有相似的时间相关性变化趋势。这些结果高度提示免疫蛋白酶体可能通过调控NF-κB的活化从而影响NF-κB通路介导的炎症反应。既往卒中动物模型研究表明[11],应用蛋白酶体抑制剂如PS519具有明显的神经保护作用,降低梗死体积,改善卒中预后,机制包括抑制炎症细胞的活化和浸润、下调炎症基因转录和炎症因子产生[12]。然而,广谱的蛋白酶抑制剂如 MLN519/PS519,在抑制炎症基因同时也抑制了一些保护性基因作用。例如,NF-κB在缺血性卒中具有双重作用,抑制NF-κB活性减少炎症因子产生同时也下调了某些抗凋亡基因表达[13],持续抑制蛋白酶体活性,可能导致免疫功能持续低下,也不利于卒中的康复[14]。研究推测如果有一种针对免疫蛋白酶体LMP7或者LMP2的高度特异选择性蛋白酶抑制剂能够运用于卒中治疗,取得确切的神经保护作用而无明显的副作用,这将为卒中患者带来福音。
[1]Tobin MK,Bonds JA,Minshall RD,et al.Neurogenesis and inflammation after ischemic stroke:what is known and where we go from here.J Cereb Blood Flow Metab,2014,34(10):1573-1584
[2]Kremer M,Henn A,Kolb C,et al.Reduced immunoproteasome formation and accumulation of immunoproteasomal precursors in the brains of lymphocytic choriomeningitis virus-infected mice.J Immunol,2010,185(9):5549-5560
[3]Longa E Z,Weinstein P R,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats.Stroke,1989,20(1):84-91
[4]Zhang J,Zhang Y,Li J,et al.Autophagosomes accumulation is associated with beta-amyloid deposits and secondary damage in the thalamus after focal cortical infarction in hypertensive rats.J Neurochem,2012,120(4):564-573
[5]Kloetzel P M.Antigen processing by the proteasome.Nat Rev Mol Cell Biol,2001,2(3):179-187
[6]Lu L,Wang H.Transient focal cerebral ischemia upregulates immunoproteasomal subunits.Cell Mol Neurobiol,2012,32(6):965-970
[7]Kotamraju S,Tampo Y,Keszler A,et al.Nitric oxide inhibits H2O2-induced transferrin receptor-dependent apoptosis in endothelial cells:Role of ubiquitin-protea-some pathway.Proc Natl Acad Sci U S A,2003,100(19):10653-10658
[8]Reis J,Guan X Q,Kisselev A F,et al.LPS-induced formation of immunoproteasomes:TNF-alpha and nitric oxide production are regulated by altered composition of proteasome-active sites.Cell Biochem Biophys,2011,60(1-2):77-88
[9]Del Z G.Inflammation and the neurovascular unit in the setting of focal cerebral ischemia.Neuroscience,2009,158(3):972-982
[10]Orre M,Kamphuis W,Dooves S,et al.Reactive glia show increased immunoproteasome activity in Alzheimer's disease.Brain,2013,136(Pt 5):1415-1431
[11]Zhang L,Zhang Z G,Zhang R L,et al.Postischemic(6-Hour)treatment with recombinant human tissue plasminogen activator and proteasome inhibitor PS-519 reduces infarction in a rat model of embolic focal cerebral ischemia.Stroke,2001,32(12):2926-2931
[12]Williams A J,Dave J R,Tortella F C.Neuroprotection with the proteasome inhibitor MLN519 in focal ischemic brain injury:relation to nuclear factor kappaB(NF-kappaB),inflammatory gene expression,and leukocyte infiltration.Neurochem Int,2006,49(2):106-112
[13]Ridder D A,Schwaninger M.NF-kappaB signaling in cerebral ischemia.Neuroscience,2009,158(3):995-1006
[14]Wojcik C,Di Napoli M.Ubiquitin-proteasome system and proteasome inhibition:new strategies in stroke therapy.Stroke,2004,35(6):1506-1518
图 版 说 明
图1 MCAO大鼠脑免疫蛋白酶体LMP2表达和细胞定位。标尺=50μm
图2 MCAO大鼠脑免疫蛋白酶体LMP7表达和细胞定位。
标尺=50μm
图3 MCAO大鼠脑NF-κB表达和细胞定位。标尺=50μm
图4 MCAO大鼠脑IL-1β表达和细胞定位。标尺=50μm
图5 MCAO大鼠脑TNF-α表达和细胞定位。标尺=50μm
EXPLANATION OF FIGURES
Fig.1 Expression and cellular localization of LMP2 in the brains of MCAO rats.Scale bar=50μm。
Fig.2 Expression and cellular localization of LMP7 in the brains of MCAO rats.Scale bar=50μm。
Fig.3 Expression and cellular localization of NF-κB in the brains of MCAO rats.Scale bar=50μm。
Fig.4 Expression and cellular localization of IL-1βin the brains of MCAO rats.Scale bar=50μm。
Fig.5 Expression and cellular localization of TNF-αin the brains of MCAO rats.Scale bar=50μm。