解淀粉芽孢杆菌抗菌物质发酵培养基的优化
2015-01-03杨胜远郑燮茹
杨胜远,韦 锦,郑燮茹
解淀粉芽孢杆菌抗菌物质发酵培养基的优化
杨胜远,韦 锦,郑燮茹
(韩山师范学院生物学系,广东 潮州 521041)
采用双向单因素试验法及正交试验法,以解淀粉芽孢杆菌K6为菌种,对发酵合成抗菌物质的改良兰迪培养基进行优化。结果表明:KCl对解淀粉芽孢杆菌K6抗菌活性物质的合成不利,FeSO4和CuSO4对抗菌活性物质的合成影响不大,而KH2PO4、MgSO4和MnSO4对抗菌活性物质的合成影响较显著。经优化获得适宜用于合成抗菌物质的兰迪培养基的配方为:L-谷氨酸钠5.0 g/L、葡萄糖15.0 g/L、KH2PO40.5 g/L、MgSO40.2 g/L、MnSO42.0 mg/L。优化兰迪培养基的组分较优化前的改良兰迪培养基显著减少,并更有利于抗菌活性物质的生物合成。
双向单因素法;兰迪培养基;抗菌物质;解淀粉芽孢杆菌
随着水产养殖业的集约化发展,病害问题也日趋凸显,已成为限制养殖业发展的瓶颈。动物病原菌也是食源性疾病的重要病原菌。目前水产养殖业主要通过抗生素对病原菌进行防治。抗生素的使用在一定程度上促进了养殖业的发展,然而由于药物的长期使用,造成细菌耐药菌株不断出现,使得抗生素使用量越来越大,药物效果越来越不明显,但是药害问题却越来越显著[1]。因此,挖掘新型天然抗菌活性物质,应用于水产动物病害防控,从食品原料的源头抓起,是食品安全的迫切需要。
芽孢杆菌属(Bacillus)的细菌能够产生脂肽类[2-5]、肽类[6]、细菌素[7-8]和抗菌蛋白[9-10]等多种抗菌物质,具有抗细菌[11-13]、真菌[10,12-15]、病毒[16-17]和支原体[18]等广谱抗菌活性,在水生生物、畜禽动物和植物病原菌的防控方面均具有很好的效果[19-22]。然而,由于发酵产量低,严重制约了芽孢杆菌抗菌物质的推广应用。
兰迪(Landy)1948年在枯草芽孢杆菌抗菌物质的研究中,首次采用了一种主要由谷氨酸、葡萄糖和多种盐组成的合成培养基[14],被称为兰迪培养基(Landymedium)。研究表明,兰迪培养基是芽孢杆菌产抗菌活性物质的良好培养基[15,19-20,23-24]。在兰迪培养基的基础上,方传记等[25]采用Plackett-Burman试验设计法和均匀设计法对淀粉液化芽孢杆菌抗菌脂肽发酵培养基进行了优化,孙力军等[24,26-27]也采用Plackett-Burman试验设计法和响应曲面法对发酵生产抗菌脂肽的主要影响因子进行了筛选和优化,经过改良后的兰迪培养基更有利于抗菌物质的合成,产量均获得了较大提高。然而,改良的兰迪培养基只是在各组分的量上进行了优化,在组分种类上并没有改变,无法克服兰迪培养基成分多、不同盐之间容易发生反应而形成沉淀、配制繁琐、成本高的缺点,有待进一步优化。
单因素试验法是一种因子筛选的有效方法,但目前单因素试验设计普遍是在基础条件上单向增加或减少某一因子,没有考虑因子的变化改变了原有交互作用,在因子的取舍方面容易产生误判。
本实验以具有较强抗菌物质合成能力的解淀粉芽孢杆菌(Bacillus amyloliquefaciens)K6为菌种,在文献[15,24]所述的改良兰迪培养基的基础上,采用双向单因素试验法及正交试验法对改良兰迪培养基作进一步优化,以期简化改良兰迪培养基的组成,降低成本,简化培养基配制方法。
1 材料与方法
1.1材料
1.1.1菌种
解淀粉芽孢杆菌(Bacillus amyloliquefaciens)K6为韩山师范学院食品微生物研究室保藏菌株,分离自菜园土壤[12];大肠埃希氏菌(Escherichia coli)ATCC 8739和金黄色葡萄球菌(Staphylococcus aureus)ATCC 6538为广东省微生物菌种保藏中心保藏菌株。
1.1.2培养基
牛肉膏蛋白胨液体培养基[28]:牛肉浸膏5.0 g/L、蛋白胨10.0 g/L、NaCl 5.0 g/L、葡萄糖10.0 g/L,pH 7.0±0.2。
牛肉膏蛋白胨固体培养基:在牛肉膏蛋白胨液体培养基配方中加入琼脂10.0 g/L。
马铃薯液体培养基[28]:取已去皮切块的马铃薯200 g,加水1 L,煮沸30 min,纱布过滤,加水补足1 L,调节pH 7.0±0.2。
改良兰迪培养基[15,24]:L-谷氨酸钠5.0 g/L、葡萄糖10.0 g/L、MgSO40.5 g/L、KCl 0.78 g/L、KH2PO41.0 g/L、FeSO40.05 mg/L、MnSO45.0 mg/L、CuSO40.16 mg/L,pH 7.0±0.2。
1.2仪器与设备
LRH-250恒温培养箱 上海一恒科学仪器有限公司;HZQ-X100恒温双层振荡培养箱 太仓市实验设备厂;Sigma 3-18K高速冷冻离心机 德国Sigma公司。
1.3方法
1.3.1指示菌种子液制备
从大肠埃希氏菌或金黄色葡萄球菌斜面挑取1环菌苔接入100 mL/250 mL三角瓶的牛肉膏蛋白胨液体培养基,于37℃、120 r/min摇床培养12 h,作为制备抗菌物质活性检测指示平板的种子液,细胞密度为108CFU/mL。
1.3.2解淀粉芽孢杆菌K6种子液制备
从解淀粉芽孢杆菌K6的斜面挑取1环菌苔接入100 mL/250 mL三角瓶的马铃薯液体培养基,于37℃、160 r/min摇床培养12 h作为种子液。
1.3.3解淀粉芽孢杆菌K6去细胞发酵液的制备
分别吸取2 mL解淀粉芽孢杆菌K6种子液接入100 mL/250 mL三角瓶的试验组和对照组兰迪培养基,于30℃、160 r/min摇床培养36 h,作为发酵液。将发酵液于4℃、10 000 r/min离心20 min,取上清液用孔径0.45 ☒m的细菌滤器过滤制备去细胞发酵液。
1.3.4抗菌活性的检测
采用杯碟法进行检测。在直径9 cm的无菌培养皿中加入8 mL冷却至约50℃的牛肉膏蛋白胨固体培养基,冷却凝固作为底层平板。在底层平板上加0.2 mL指示菌种子液,采用无菌涂布棒涂布均匀,再加入5 mL冷却至约50℃的牛肉膏蛋白胨固体培养基,快速混匀,静置冷却凝固,作为抗菌活性检测指示平板。将无菌的牛津杯(外径8 mm)间隔一定距离竖置于指示平板表面,然后在牛津杯中加入解淀粉芽孢杆菌K6去细胞发酵液100 ☒L,平置于37℃培养12 h,用游标卡尺测抑菌圈的直径,以抑菌圈的直径(mm)表示抗菌活性大小。
1.3.5双向单因素试验设计
正向单因素试验:以改良兰迪培养基中葡萄糖和L-谷氨酸钠作为基础培养基,在基础培养基中分别添加MgSO4、KCl、KH2PO4、FeSO4、MnSO4或CuSO4作为试验组培养基,添加量与原改良兰迪培养基相同。每组试验做3个平行。
反向单因素试验:以改良兰迪培养基为基础,分别减去配方中的MgSO4、KCl、KH2PO4、FeSO4、MnSO4或CuSO4作为试验组培养基,添加量与原改良兰迪培养基相同。每组试验做3个平行。
1.3.6正交试验设计
在单因素试验的基础上,以葡萄糖、L-谷氨酸钠、KH2PO4、MgSO4和MnSO4为主要影响因素,以抑菌圈直径为考察指标进行L25(56)试验设计,并设置1个空列。
1.3.7验证实验
选择对大肠埃希氏菌和金黄色葡萄球菌抑菌活性均较高的组合作为适宜培养基。以优化前的改良兰迪培养基[15,24]作为对照。
1.4数据分析
以IBM SPSS Statistics 19.0软件采用独立样本t检验进行统计分析。
2 结果与分析
2.1 KCl对解淀粉芽孢杆菌K6产抗菌物质的影响
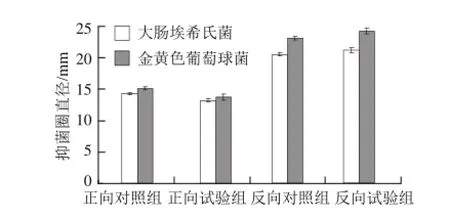
图1 KCl对解淀粉芽孢杆菌K6产抗菌物质的影响Fig.1 Effect of KCl on the production of antimicrobial substances byBacillus amyloliquefaciensK6
正向单因素试验结果(图1)显示,添加KCl的试验组对大肠埃希氏菌的抑菌圈直径为(13.33± 0.29)mm,低于对照组的抑菌圈直径(14.42± 0.14)mm,经t检验分析,试验组与对照组差异显著(P<0.05);添加KCl的试验组对金黄色葡萄球菌的抑菌圈直径为(13.88±0.48)mm,低于对照组的抑菌圈直径(15.25±0.25)mm,经t检验分析,试验组与对照组差异显著(P<0.05)。结果表明,KCl对抗菌活性物质的合成不利。
反向单因素试验结果(图1)显示,不添加K C l的试验组对大肠埃希氏菌的抑菌圈直径为(21.42±0.38)mm,高于对照组的抑菌圈直径(20.75±0.25)mm,经t检验分析,试验组与对照组差异显著(P<0.05);不添加KCl的试验组对金黄色葡萄球菌的抑菌圈直径为(24.46±0.43)mm,高于对照组的抑菌圈直径(23.33±0.29)mm,但经t检验分析,试验组与对照组差异不显著(P>0.05)。从大肠埃希氏菌作为指示菌的反向单因素试验结果可见,KCl对抗菌活性物质的合成不利。
综合正向和反向单因素试验结果,选择不添加KCl。
2.2 KH2PO4对解淀粉芽孢杆菌K6产抗菌物质的影响

图2 KH 2 KH2POPO4对解淀粉芽孢杆菌K6产抗菌物质的影响Fig.2 Effect of KH2PO4on the production of antimicrobial substances byBacillus amyloliquefaciensK6
正向单因素试验结果(图2)显示,添加KH2PO4的试验组对大肠埃希氏菌的抑菌圈直径为(16.75±0.66)mm,高于对照组的抑菌圈直径(14.67±0.29)mm,经t检验分析,试验组与对照组差异显著(P<0.05);添加KH2PO4的试验组对金黄色葡萄球菌的抑菌圈直径为(18.67±0.76)mm,高于对照组的抑菌圈直径(15.17±0.86)mm,经t检验分析,试验组与对照组差异显著(P<0.05)。结果表明,KH2PO4对抗菌活性物质的合成有利。
反向单因素试验结果(图2)显示,不添加KH2PO4的试验组对大肠埃希氏菌的抑菌圈直径为(13.50±0.50)mm,低于对照组的抑菌圈直径(21.10±0.17)mm,经t检验分析,试验组与对照组差异显著(P<0.05);不添加KH2PO4的试验组对金黄色葡萄球菌的抑菌圈直径为(15.67±0.29)mm,低于对照组的抑菌圈直径(24.08±0.38)mm,经t检验分析,试验组与对照组差异显著(P<0.05)。结果也表明,KH2PO4对抗菌活性物质的合成有利。
正向和反向单因素试验结果均表明需要添加KH2PO4。
2.3FeSO4对解淀粉芽孢杆菌K6产抗菌物质的影响
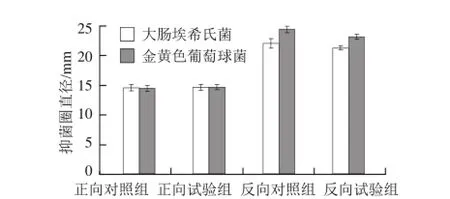
图3 FeSO4对解淀粉芽孢杆菌K6产抗菌物质的影响Fig.3 Effect of FeSO4on the production of antimicrobial substances byBacillus amyloliquefaciensK6
正向单因素试验结果(图3)显示,添加FeSO4的试验组对大肠埃希氏菌的抑菌圈直径为(14.50± 0.50)mm,与对照组的抑菌圈直径(14.42±0.52)mm相近,t检验分析表明差异不显著(P>0.05);添加FeSO4的试验组对金黄色葡萄球菌的抑菌圈直径为(14.52±0.48)mm,与对照组的抑菌圈直径(14.33±0.50)mm相近,t检验分析也表明差异不显著(P>0.05)。结果表明,FeSO4对抗菌活性物质的合成影响不大。
反向单因素试验结果(图3)显示,不添加FeSO4的试验组对大肠埃希氏菌的抑菌圈直径为(21.08±0.38)mm,与对照组的抑菌圈直径(21.83±0.76)mm相差不大,经t检验分析,试验组与对照组差异不显著(P>0.05);不添加FeSO4的试验组对金黄色葡萄球菌的抑菌圈直径为(22.92±0.38)mm,低于对照组的抑菌圈直径(24.17±0.52)mm,经t检验分析,试验组与对照组差异显著(P<0.05)。不同指示菌的试验结果存在差异。由上可见,正向单因素试验结果与以大肠埃希氏菌作为指示菌的反向单因素试验的结果一致,与以金黄色葡萄球菌作为指示菌的反向单因素试验的结果存在矛盾。考虑反向单因素试验的因子较多,因子之间的交互作用复杂,可能单一去除FeSO4成分改变了原各因子的交互作用,最终导致试验结果不一致,有望通过改变其他因子从而改变因子的交互作用而获得改善。因此,综合正向和反向单因素试验结果,选择不添加FeSO4。
2.4 CuSO4对解淀粉芽孢杆菌K6产抗菌物质的影响
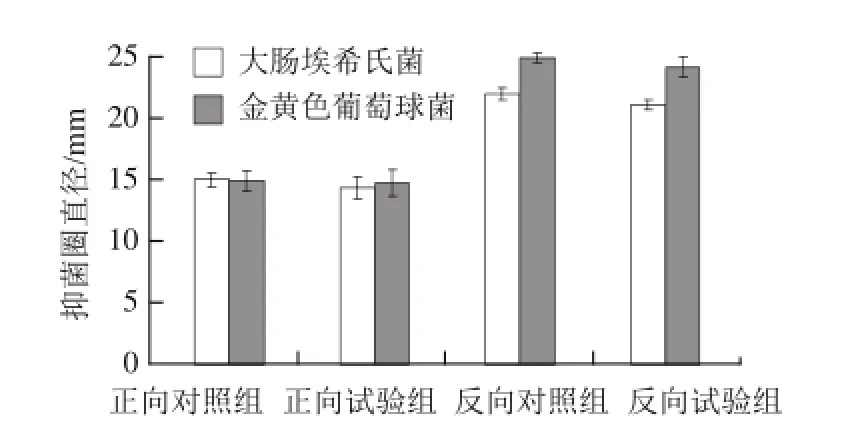
图4 CuuSSOO4对解淀粉芽孢杆菌K6产抗菌物质的影响Fig.4 Effect of CuSO4on the production of antimicrobial substances byBacillus amyloliquefaciensK6
正向单因素试验结果(图4)显示,添加CuSO4的试验组对大肠埃希氏菌的抑菌圈直径为(13.88±0.87)mm,略低于对照组的抑菌圈直径(14.50±0.50)mm,t检验分析表明差异不显著(P>0.05);添加CuSO4的试验组对金黄色葡萄球菌的抑菌圈直径为(14.35±1.01)mm,与对照组的抑菌圈直径(14.42±0.80)mm相近,t检验分析也表明差异不显著(P>0.05)。结果表明,CuSO4对抗菌活性物质的合成影响不大。
反向单因素试验结果(图4)显示,不添加CuSO4的试验组对大肠埃希氏菌的抑菌圈直径为(20.42±0.78)mm,略低于对照组的抑菌圈直径(21.21±0.47)mm,t检验分析表明试验组与对照组差异不显著(P>0.05);不添加CuSO4的试验组对金黄色葡萄球菌的抑菌圈直径为(23.33±0.80)mm,略低于对照组的抑菌圈直径(24.08±0.38)mm,经t检验分析,试验组与对照组差异显著(P<0.05)。不同指示菌的试验结果存在差异。
由上可见,正向单因素试验结果与以大肠埃希氏菌作为指示菌的反向单因素试验的结果一致,与以金黄色葡萄球菌作为指示菌的反向单因素试验的结果存在矛盾。考虑反向单因素试验的因子较多,因子之间的交互作用复杂,可能单一去除CuSO4成分改变了原各因子的交互作用,最终导致试验结果不一致,有望通过改变其他因子从而改变因子的交互作用而获得改善。因此,综合正向和反向单因素试验结果,选择不添加CuSO4。
2.5 MgSO4对解淀粉芽孢杆菌K6产抗菌物质的影响
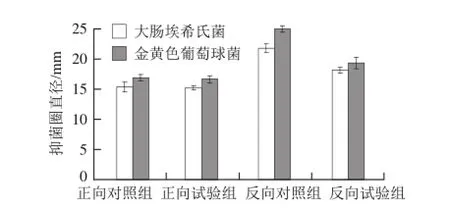
图5 MggSSOO4对解淀粉芽孢杆菌K6产抗菌物质的影响Fig.5 Effect of MgSO4on the production of antimicrobial substances byBacillus amyloliquefaciensK6
正向单因素试验结果(图5)显示,添加MgSO4的试验组对大肠埃希氏菌的抑菌圈直径为(14.33±0.29)mm,与对照组的抑菌圈直径(14.50±0.75)mm相差不大,经t检验分析,试验组与对照组差异不显著(P>0.05);添加MgSO4的试验组对金黄色葡萄球菌的抑菌圈直径为(15.67±0.58)mm,与对照组的抑菌圈直径(15.92±0.52)mm相差不大,经t检验分析,试验组与对照组差异不显著(P>0.05)。结果表明,MgSO4对抗菌活性物质的合成影响不大。
反向单因素试验结果(图5)显示,不添加MgSO4的试验组对大肠埃希氏菌的抑菌圈直径为(17.08±0.44)mm,低于对照组的抑菌圈直径(20.50±0.66)mm,经t检验分析,试验组与对照组差异显著(P<0.05);不添加MgSO4的试验组对金黄色葡萄球菌的抑菌圈直径为(18.25±0.90)mm,低于对照组的抑菌圈直径(23.50±0.50)mm,经t检验分析,试验组与对照组差异显著(P<0.05)。结果表明,MgSO4对抗菌活性物质的合成有利。
由上可见,虽然正向和反向单因素试验结果不一致,但是正向单因素试验结果表明MgSO4对抗菌活性物质的合成并无不利的影响,而反向单因素试验结果表明MgSO4对抗菌活性物质的合成是有利的,因此依据反向单因素试验结果选择添加MgSO4。
2.6 MnSO4对解淀粉芽孢杆菌K6产抗菌物质的影响

图6 MnnSSOO4对解淀粉芽孢杆菌K6产抗菌物质的影响Fig.6 Effect of MnSO4on the production of antimicrobial substances byBacillus amyloliquefaciensK6
正向单因素试验结果(图6)显示,添加MnSO4的试验组对大肠埃希氏菌的抑菌圈直径为(15.91±0.52)mm,高于对照组的抑菌圈直径(14.08±0.34)mm,t检验分析表明试验组与对照组差异显著(P<0.05);添加MnSO4的试验组对金黄色葡萄球菌的抑菌圈直径为(17.17±0.56)mm,高于对照组的抑菌圈直径(16.33±0.29)mm,经t检验分析,试验组与对照组差异显著(P<0.05)。结果表明,MnSO4对抗菌活性物质的合成有利。
反向单因素试验结果(图6)显示,不添加MnSO4的试验组对大肠埃希氏菌的抑菌圈直径为(13.75±0.43)mm,低于对照组的抑菌圈直径(21.08±0.48)mm,经t检验分析,试验组与对照组差异显著(P<0.05);不添加MnSO4的试验组对金黄色葡萄球菌的抑菌圈直径为(14.63±0.38)mm,低于对照组的抑菌圈直径(21.88±0.88)mm,经t检验分析,试验组与对照组差异显著(P<0.05)。结果也表明,MnSO4对抗菌活性物质的合成有利。
正向和反向单因素试验结果均表明需要添加MnSO4。
2.7正交试验优化结果
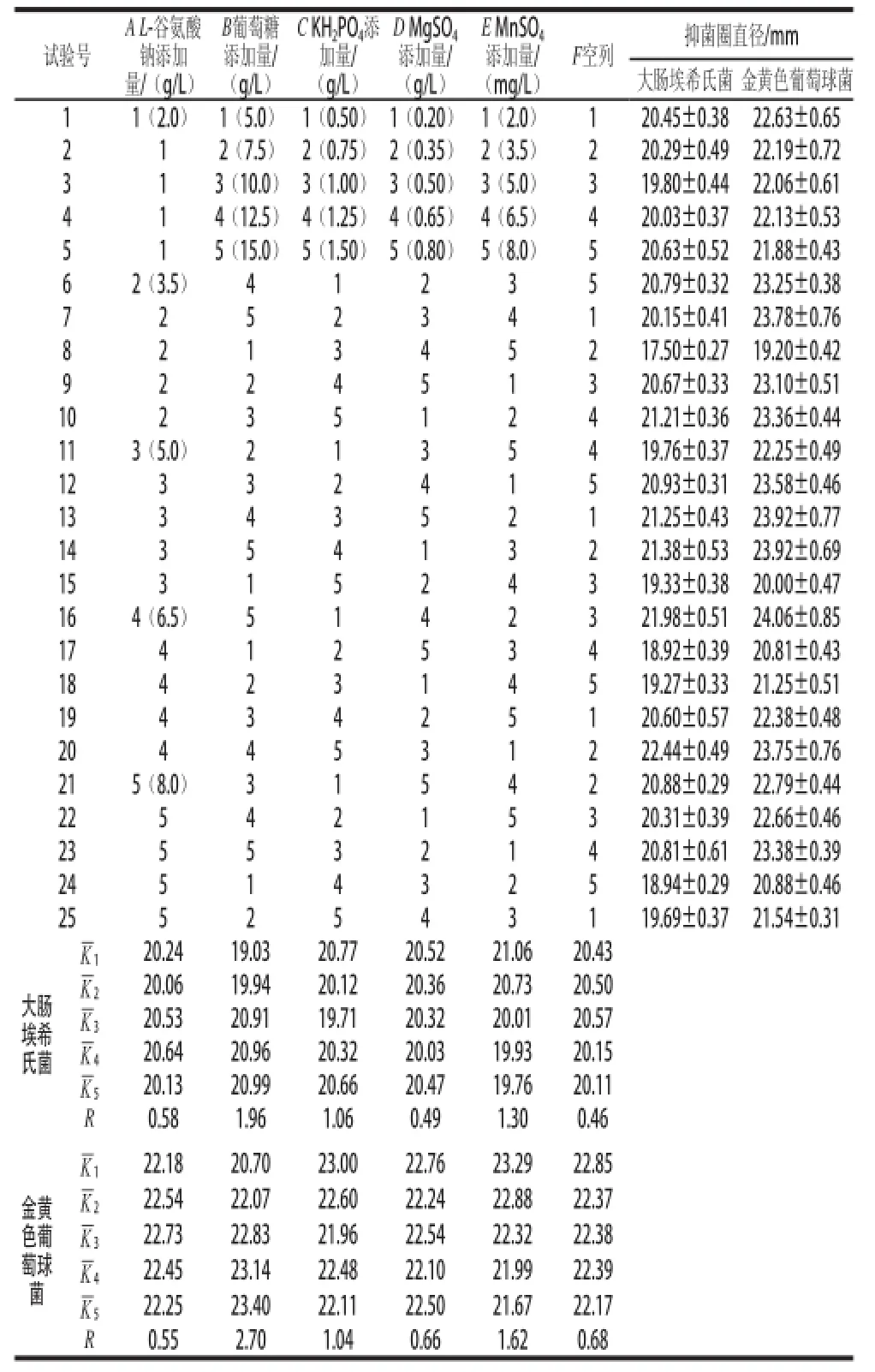
表1 L 1 L2525(556)正交试验设计及结果Table 1 Le 1 L2525(5(56) orthogonal array design and results
由表1可知,当以大肠埃希氏菌为检测指示菌时,兰迪培养基的最优组合为B>E>C>A>D,最优水平为A4B5C1D1E1,即L-谷氨酸钠6.5 g/L、葡萄糖15.0 g/L、KH2PO40.5 g/L、MgSO40.2 g/L、MnSO42.0 mg/L;当以金黄色葡萄球菌为检测指示菌时,兰迪培养基的最优组合为B>E>C>D>A,最优水平为A3B5C1D1E1,即L-谷氨酸钠5.0 g/L、葡萄糖15.0 g/L、KH2PO40.5 g/L、MgSO40.2 g/L、MnSO42.0 mg/L。比较以大肠埃希氏菌和金黄色葡萄球菌为检测指示菌所获得的培养基最优水平,只有A(L-谷氨酸钠)因子在量上存在差异,极差分析表明,A与F(空列)的极差相差不大,说明该因素水平差异是由试验误差或因子间的一些交互作用引起的,极差较小,为不重要因素。因此,L-谷氨酸钠的量选择5.0~6.5 g/L均可。
根据正交试验结果及分析,选择兰迪培养基的最优组合为:L-谷氨酸钠5.0~6.5 g/L、葡萄糖15.0 g/L、KH2PO40.5 g/L、MgSO40.2 g/L、MnSO42.0 mg/L。
2.8 验证实验

表2 验证实验结果Table 2 Results of verification experiments
分别以大肠埃希氏菌为指示菌的正交试验最优水平(培养基1,A4B5C1D1E1)、金黄色葡萄球菌为指示菌的正交试验最优水平(培养基2,A3B5C1D1E1)以及由A3与A4的平均值与B5C1D1E1的组合(培养基3)作为培养基进行验证实验。由表2可知,培养基1、培养基2和培养基3发酵产生的抗菌物质对大肠埃希氏菌和金黄色葡萄球菌的抑菌活性均大于对照组改良兰迪培养基。t检验分析表明验证实验组与对照组差异显著(P<0.05),试验组培养基1、培养基2和培养基3发酵产生的抗菌物质对大肠埃希氏菌和金黄色葡萄球菌的抑菌活性相互间差异不显著(P>0.05)。因此,从原料成本考虑,选择培养基2较为适宜,即优化兰迪培养基的配方为:L-谷氨酸钠5.0 g/L、葡萄糖15.0 g/L、KH2PO40.5 g/L、MgSO40.2 g/L、MnSO42.0 mg/L。
3 讨 论
芽孢杆菌属的细菌能产生多种抗菌物质,抗菌活性及抗菌谱是多种抗菌物质共同作用的结果。培养基不同可能导致发酵产生抗菌物质的组成及比例存在差异,从而导致对特定微生物的抗菌活性或抗菌谱发生变化。同时采用大肠埃希氏菌(革兰氏阴性)和金黄色葡萄球菌(革兰氏阳性)作为检测指示菌,可克服采用单一检测指示菌可能造成优化的培养基只有利于某抗菌组分合成的偏向问题。
Plackett-Burman设计法是一种两水平试验设计方法,该法的主因素为正交设计,两因素间的交互作用仅部分与主因素产生混淆[29],可以利用较少的试验次数从多种考察因素中快速筛选出主要影响因子,广泛用于因子主次效应的预测[30]。然而,在考察某一因子的作用和必要性方面,单因素试验却更为直接和有效。
传统单因素试验设计是在基础条件上单向增加或减少某一因子,对于成分较为复杂的培养基,单向增加或减少某一因子,可能由于因子间的交互作用的发生改变,致使与试验因子交互的另一因子的作用凸显,造成试验系统误差增大,最终导致对因子的选择出现失误。
本实验采用双向单因素试验法进行因子的筛选,虽然会增加试验组数,增大工作量,但是实验结果能够起到相互验证的作用,更有利于对因子的作用作出正确判断。研究表明,经双向单因素试验法和正交试验优化,优化后的兰迪培养基的成分较原兰迪培养基和改良兰迪培养基显著减少(表3),而产抗菌物质的能力优于优化前的改良兰迪培养基(表2),可降低培养基的成本和简化培养基的配制工序。

表3 优化前后兰迪培养基的配方Table 3 Landy medium components before and after optimization
4 结 论
双向单因素试验法是对多组分配方因子筛选的有效方法,能够起到相互验证的作用,可降低由于因子间交互作用的改变而造成的系统误差,有利于实现对因子的正确选择。双向单因素试验法筛选结果表明,KCl对解淀粉芽孢杆菌K6抗菌活性物质的合成不利,FeSO4和CuSO4对抗菌活性物质的合成影响不大,而KH2PO4、MgSO4和MnSO4对抗菌活性物质的合成影响较显著,为培养基的必需成分。
优化兰迪培养基的配方为:L-谷氨酸钠5.0 g/L、葡萄糖15.0 g/L、KH2PO40.5 g/L、MgSO40.2 g/L、MnSO42.0 mg/L。优化兰迪培养基的配方较优化前的改良兰迪培养基组分显著减少,而且更有利于抗菌活性物质的生物合成,是解淀粉芽孢杆菌K6合成抗菌物质的适宜培养基。
[1]储卫华,朱卫,康春涛.海洋蛭弧菌的分离鉴定及其对副溶血弧菌的作用[J].微生物学通报, 2009, 36(1): 20-24.
[2] SINGH P, CAMEOTRA S S. Potential applications of microbial surfactants in biomedical sciences[J]. Trends in Biotechnology, 2004, 22(3): 142-146.
[3] MORAN S, ROBERTSON K, PARADISI F. Production of lipopeptides inBacillussp. CS93 isolated from Pozol[J]. FEMS Microbiology Letters, 2010, 304(1): 69-73.
[4] SUN Lijun, LU Zhaoxin, BIE Xiaomei, et al. Isolation and characterization of a co-producer of fengycins and surfactins, endophyticBacillus amyloliquefaciensES-2, fromScutellaria baicalensisGeorgi[J]. World Journal of Microbiology and Biotechnology, 2006, 22(12): 1259-1266.
[5] DELEU M, PAQUOT M, NYLANDER T. Effect of fengycin, a lipopeptide produced byBacillus subtilis, on model biomembranes[J]. Biophysical Journal, 2008, 94(7): 2667-2679.
[6] XU Defeng, WANG Yaling, SUN Lijun, et al. Inhibitory activity of a novel antibacterial peptide AMPNT-6 fromBacillus subtilisagainstVibrio parahaemolyticusin shrimp[J]. Food Control, 2013, 30(1): 58-61.
[7] DORENBOS R, STEIN T, KABEL J, et al. Thiol-disulfide oxidoreductases are essential for the production of the lantibiotic sublancin 168[J]. The Journal of Biological Chemistry, 2002, 277(19): 16682-16688.
[8] CORVEY C, STEIN T, D☒STERHUS S, et al. Activation of subtilin precursors byBacillus subtilisextracellular serine proteases subtilisin (AprE), WprA, and Vpr[J]. Biochemical and Biophysical Research Communications, 2003, 304(1): 48-54.
[9]童有仁,马志超,陈卫良,等.枯草芽孢杆菌B034拮抗蛋白的分离纯化及特性分析[J].微生物学报, 1999, 39(4): 339-343.
[10]陈夕军,李娟,孙启,等.水稻内生枯草芽孢杆菌G87抗菌蛋白的分离纯化及理化特性[J].微生物学报, 2010, 50(10): 1353-1357.
[11] AHIMOU F, JACQUES P, DELEU M. Surfactin and iturin a effects onBacillus subtilissurface hydrophobicity[J]. Enzyme and Microbial Technology, 2000, 27(10): 749-754.
[12]杨胜远,韦锦,李云,等.一株产抗菌活性物质解淀粉芽孢杆菌的筛选及鉴定[J].食品科学, 2010, 31(21): 208-212.
[13]李云,杨胜远,林晓东,等.产细菌素苏云金芽孢杆菌的鉴定及其所产抗菌物质性质[J].食品科学, 2010, 31(11): 147-152.
[14] LANDY M, WARREN G H, ROSENMAN S B, et al. Bacillomycin: an antibiotic fromBacillus subtilisactive against pathogenic fungi[J]. Proceedings of the Society for Experimental Biology and Medicine, 1948, 67(4): 539-541.
[15]刘唤明,王雅玲,孙力军,等.纳豆菌脂肽对分离于对虾养殖环境中产T-2毒素镰孢菌抑制效应的研究[J].水产学报, 2013, 37(5): 784-789.
[16]任鹏举,谢永丽,张岩,等.枯草芽孢杆菌OKB105产生的surfactin防治烟草花叶病毒病及其机理研究[J].中国生物防治学报, 2014, 30(2): 216-221.
[17]VOLLENBROICHD, OZEL M, VATER J, et al. Mechanism of inactivation of enveloped viruses by the biosurfactant surfactin fromBacillus subtilis[J]. Biologicals, 1997, 25(3): 289-297.
[18]VOLLENBROICHD, PAULI G, OZEL M, et al. Antimycoplasma properties and application in cell cultures of surfactin, a lipopeptide antibiotic fromBacillus subtilis[J]. Applied Environmental Microbiology, 1997, 63(1): 44-49.
[19]杨丽莉,吕凤霞,别小妹,等.枯草芽孢杆菌抗菌脂肽对嗜水气单胞菌抑菌效果[J].食品科学, 2011, 32(1): 193-198.
[20]王东.纳豆菌抗菌脂肽固态发酵工艺优化及其在对虾保鲜上的应用[D].湛江:广东海洋大学, 2012.
[21]都海明,戚广州,王建军,等.抗菌脂肽对断奶仔猪生长性能、肠道微生物及血液指标的影响研究[J].中国粮油学报, 2011, 26(5): 76-82.
[22]杨琦瑶.枯草芽孢杆菌B006脂肽类抗生素对黄瓜枯萎病菌抑制作用的研究[D].哈尔滨:东北农业大学, 2012.
[23] KOWALL M, VATER J, KLUGE B, et al. Separation andcharacterization of surfactin isoforms produced byBacillus subtilisOKB 105[J]. Journal of Colloid and Interface Science, 1998, 204(1): 1-8.
[24]孙力军,陆兆新,别小妹,等.培养基对解淀粉芽孢杆菌ES-2菌株产抗菌脂肽的影响[J].中国农业科学, 2008, 41(10): 3389-3398.
[25]方传记,陆兆新,孙力军,等.淀粉液化芽孢杆菌抗菌脂肽发酵培养基及发酵条件的优化[J].中国农业科学, 2008, 41(2): 533-539.
[26]孙力军,陆兆新,孙德坤.Bacillus amyloliquefaciensES-2液体发酵抗菌脂肽培养基及其主要影响因子筛选[J].食品工业科技, 2008, 29(5): 60-63.
[27]孙力军,陆兆新,陈磊,等.金银花内生菌EJH-1抗菌作用发酵培养基响应面法优化[J].南京农业大学学报, 2006, 29(3): 108-113.
[28]沈萍,范秀容,李广武.微生物学实验[M]. 3版.北京:高等教育出版社, 1999: 214-215.
[29] PLECKETT R L, BURMAN J P. The design of optimum multifactorial experiments[J]. Biometrika, 1946, 33(4): 305-325.
[30] KALIL S J, MAUGERI F, RODRIGUES M I. Response surface analysis and simulation as a tool for bioprocess design and optimization[J]. Process Biochemistry, 2000, 35(6): 539-550.
Optimization of Fermentation Medium for the Production of Antimicrobial Substances by Bacillus amyloliquefaciens
YANG Shengyuan, WEI Jin, ZHENG Xieru
(Department of Biological Sciences, Hanshan Normal University, Chaozhou 521041, China)
The modified Landy medium used for the production of antimicrobial substances byBacillus amyloliquefaciensK6 was optimized by using a combination of bidirectional single factor method and orthogonal array design. The results indicated that KCl was unfavourable for the biosynthesis of antimicrobial substances, which was little affected by FeSO4and CuSO4but significantly affected by KH2PO4, MgSO4and MnSO4. The optimum medium for the yield of antimicrobial substances consisted of 5.0 g/LL-monosodium glutamate, 15.0 g/L glucose, 0.5 g/L KH2PO4, 0.2 g/L MgSO4, and 2.0 mg/L MnSO4. Compared with the initial Landy medium, the optimized Landy medium contained much fewer constituents but was more suitable for the biosynthesis of antimicrobial substances.
bidirectional single factor method; Landy medium; antimicrobial substance;Bacillus amyloliquefaciens
Q815
1002-6630(2015)11-0150-07
10.7506/spkx1002-6630-201511029
2014-07-13
2011年度国家星火计划项目(2011GA780022);潮州市科技引导计划项目(2011N01);
广东普通高校“粤东食品加工与安全控制工程技术开发中心”项目(GCZX-A1415)
杨胜远(1972—),男,教授,博士,研究方向为食品微生物及生物技术。E-mail:yshengyuan2004@aliyun.com
