pH值对大豆11S球蛋白结构和表面疏水性的影响
2015-01-03魏冬旭江连洲王中江
魏冬旭,江连洲*,王 辰,王中江
pH值对大豆11S球蛋白结构和表面疏水性的影响
魏冬旭1,2,江连洲1,*,王 辰3,王中江1
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.黑龙江出入境检验检疫局,黑龙江 哈尔滨 150001;3.大理学院工程学院,云南 大理 671003)
采用Lowry法、8-苯氨基萘-1-磺酸铵盐(8-anilinonaphthalene-1-sulfonic acid ammonium salt,ANS)荧光探针法研究pH值对大豆11S球蛋白的溶解性和表面疏水性的影响,并利用圆二色光谱和荧光光谱对不同pH值条件下11S球蛋白二级结构和三级结构进行分析,为研究大豆蛋白结构与表面疏水性之间的构效关系提供理论基础。结果表明:除等电点外,大豆11S球蛋白溶解性和表面疏水性呈负相关,并且随着pH值的升高,大豆球蛋白二级结构中发生β-折叠和无规卷曲向α-螺旋的转变,三级结构中色氨酸(Trp)残基微环境极性降低。大豆球蛋白的表面疏水性与α-螺旋结构含量呈负相关。
大豆11S球蛋白;pH值;结构;表面疏水性
随着食品工业的发展,对蛋白质的需求量日益增加。大豆蛋白由于其具有较高的营养价值、良好的功能特性等优点,已作为一种功能性成分被广泛应用于不同食品和化工领域中[1-4]。其中,溶解性由于可限制蛋白质其他功能特性的发挥而成为大豆蛋白非常重要的一个功能特性[5-9]。蛋白质的溶解性取决于蛋白质分子间亲水性/疏水性的平衡,由于蛋白质是空间结构复杂的大分子,表面疏水性影响分子间的相互作用,比整体疏水性对蛋白质功能具有更大的影响[10]。研究表明蛋白质表面疏水性也显著影响着蛋白质的其他功能特性[11-12],由此可知,蛋白质的表面疏水性是衡量蛋白质功能特性的关键指标之一。
大豆蛋白的表面疏水性和大豆蛋白的结构特征密切相关[13-14]。蛋白质的分子结构和功能性质与它所处环境的pH值紧密相关[15]。圆二色光谱和荧光光谱是测定溶液中蛋白分子结构的两种常用方法。在研究蛋白质的圆二色光谱特征时,由于蛋白质分子质量大小不一,一般使用平均氨基酸残基分子质量为标准。由于氨基酸残基没有圆二色光谱特性,因此蛋白质的圆二色光谱特性仅和结构有关。圆二色光谱分为远紫外区和近紫外区,利用远紫外圆二色光谱可以推算蛋白质分子中α-螺旋等二级结构的含量。荧光光谱法主要是研究蛋白质三级结构的差异,分析蛋白空间微环境的变化。
本实验通过圆二色光谱、荧光光谱等方法系统研究pH值对大豆11S球蛋白的空间结构和表面疏水性的影响,探讨pH值改变条件下大豆11S球蛋白空间结构与表面疏水性之间的构效关系,为进一步改善大豆蛋白的功能性质、提高大豆蛋白实际应用提供理论参考。
1 材料与方法
1.1材料与试剂
大豆(东农46号)购于东北农业大学大豆研究所。大豆经破皮、粉粹后过60目筛,再经石油醚脱脂后获得脱脂大豆粉。
Lowry法蛋白质含量测定试剂盒上海荔达生物科技有限公司;8-苯胺基-1-萘磺酸(8-anilinonaphthalene-1-sulfonic acid ammonium salt,ANS)美国Sigma公司;其他试剂最低纯度为国产分析纯。
1.2仪器与设备
J-815圆二色光谱日本Jasco公司;F-4500型荧光分光光度计日本Hitachi公司;PHSJ-4A型实验室pH计上海雷磁公司;低温高速离心机美国Beckman公司。
1.3方法
1.3.1大豆11S球蛋白的制备
参考Nagano等[16]的方法,按照1∶15(m/V)料液比将脱脂大豆粉与去离子水混合,用2 mol/L氢氧化钠溶液调pH值至7.5,低速搅拌1 h后20℃、10 000×g离心15 min。所得上清液中按0.98 g/L比例加入亚硫酸钠,搅拌1 h后用2 mol/L盐酸溶液调节溶液pH值至5.5,然后在4℃条件下放置过夜,12 000×g离心20 min,所得沉淀即为大豆11S球蛋白。获得的大豆11S球蛋白组分进一步用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析组成。通过光密度扫描分析,大豆11S球蛋白纯度约为92%。
1.3.2缓冲液的配制
配制0.01 mol/L的pH 2~6的柠檬酸-磷酸二氢钠缓冲液、pH 7~9的Tris-盐酸缓冲液、pH 10的甘氨酸-盐酸缓冲液、pH 11和pH 12的氢氧化钠-磷酸二氢钠缓冲液。
1.3.3溶解度的测定
准确称取100 mg 11S球蛋白样品溶于10 mL不同pH值的缓冲液中,磁力搅拌30 min后20℃、12 000×g离心20 min。上清液经适量稀释,采用Lowry法测定蛋白质含量[17],以牛血清白蛋白为标准物绘制标准曲线。蛋白质的溶解度表示为上清液蛋白质量浓度占总蛋白质量浓度的百分比。
1.3.4表面疏水性的测定
参考Kato等[18]的ANS荧光探针法。准确称取一定量的11S球蛋白样品溶于0.01 mol/L不同pH值缓冲液中,配制成10 mg/mL的溶液,室温条件下磁力搅拌1 h后4℃条件下10 000×g离心20 min,用Lowry法测定上清液蛋白浓度,并用不同pH值缓冲液依次稀释(浓度在0.005~0.5 mol/mL之间)后,取不同浓度的样品溶液4 mL加入50μL8 mmol/L的ANS溶液,充分振荡混匀后静置10 min,测定样品的荧光强度(fluorescence intensity,FI)。实验中激发波长λex=330 nm,发射波长λem=490 nm,夹缝5 nm。以荧光强度对蛋白质含量作图,外推至蛋白质含量为0,曲线初始阶段的斜率代表蛋白质分子的表面疏水性指数(H0)[19]。
1.3.5圆二色光谱分析
准确称取一定量的11S球蛋白样品溶于不同pH值缓冲液中,质量浓度为0.4 mg/mL,室温下放置4 h。采用pH计对样液监控。采用J-815圆二色光谱仪扫描190~250 nm波长范围内的远紫外圆二色光谱,样品池光程为1 mm,灵敏度为100 mdeg/cm,扫描速率为100 nm/min,分辨率0.1 nm,实验温度为20℃。图谱经过仪器本底消除和溶液空白差减,扫描5次结果的平均值为最后得到的圆二色光谱。蛋白二级结构组成采用CDPro曲线拟合软件包,最后以平均残基摩尔椭圆度[θ](deg·cm2/dmol)表示。
1.3.6荧光光谱分析
准确称取大豆11S球蛋白分散于不同pH值缓冲液中,球蛋白质量浓度为0.3 mg/mL。采用F-4500型荧光分光光度计测定11S球蛋白的内源性荧光光谱。荧光光谱分析以蛋白质分子内部色氨酸荧光基团为探针,为了降低酪氨酸荧光特性的贡献,荧光光谱激发波长设为295 nm,发射光谱波长扫描范围为300~400 nm,狭缝为5 nm,每个样品溶液扫描5次。
1.4统计分析
每个实验重复3次,以±s表示最终实验结果。采用SPSS软件对数值进行ANOVA差异显著性分析。采用Origin 8.0软件作图。
2 结果与分析
2.1不同pH值缓冲液处理对11S球蛋白溶解度的影响

图1 不同pH值缓冲液处理对11S球蛋白溶解度的影响Fig.1 Influence of pH on the solubility of glycinin
大豆11S球蛋白的理论等电点是6.4[16],但是大豆品种不同,提取出的球蛋白会存在差异,导致等电点有所不同。本实验选取的大豆11S球蛋白的等电点在pH 5~6,由图1可知,11S球蛋白的溶解度在pH 5左右出现最小值,因为等电点附近11S球蛋白的表面带电量接近于0 mV,蛋白质分子失去静电排斥力后会发生聚集,形成沉淀,因此溶解度最小。远离等电点时分子间静电斥力增加,球蛋白空间结构展开,使得蛋白质分子分散在溶液中[20],因此在pH 5两侧11S球蛋白溶解性均显著升高(P<0.05)。这可能是在强酸或强碱条件下,大豆11S球蛋白空间结构在很大程度上展开,同时伴随其亚基之间二硫键的断裂。
由于食品加工过程中不涉及极端酸碱的处理,因此选取pH 4~10范围进行研究。如图1所示,大豆11S球蛋白在pH 5~6时,溶解度低于10%,溶解性较差,并有沉淀和聚集体的形成。较低溶解性时无法进行光谱分析,因此在光谱分析中未选取此段pH值。本实验中圆二色光谱和荧光光谱针对pH 7~10范围进行谱图分析。
2.2不同pH值缓冲液处理对11S球蛋白表面疏水性的影响
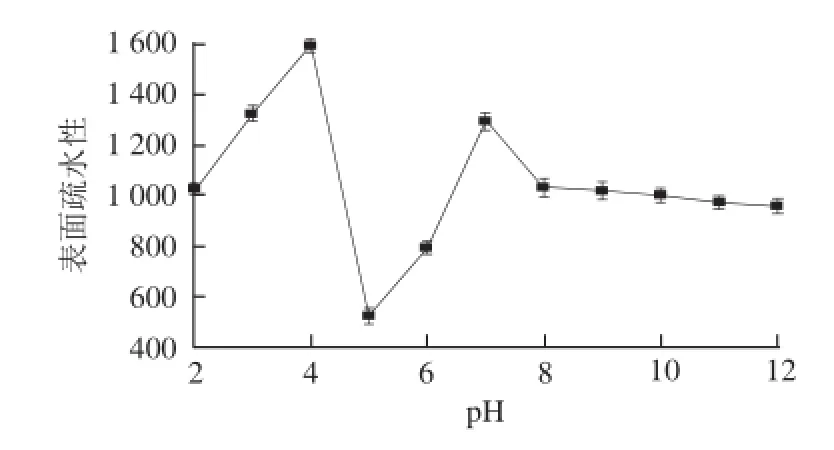
图2 不同pH值缓冲液处理对11S球 蛋白表面疏水性的影响Fig. 2 Influence of pH on surface hydrophobicity of glycinin
由图2可知,11S球蛋白的表面疏水性在pH 5附近出现最小值,与11S球蛋白溶解度曲线比较发现,除等电点外,在其他pH值条件下11S球蛋白的表面疏水性和溶解度呈负相关。这主要是由于蛋白质的溶解性取决于分子亲水性和疏水性之间的平衡,这种平衡取决于蛋白分子的氨基酸组成,尤其取决于分子表面的氨基酸组成[21]。在氨基酸侧链残基中,疏水性残基通过疏水键相互作用在蛋白质分子中心形成疏水性区域;亲水性氨基酸残基分布在蛋白质分子外侧形成亲水性区域[22]。在天然蛋白质中,许多非极性基团(疏水基团)被包埋在分子内部,导致蛋白质疏水性较低;但发生pH值偏移处理后,原先包裹在11S球蛋白内部的疏水侧链会暴露在分子表面的极性环境中,蛋白质的疏水性就会发生改变。但由于蛋白质并非上述一种结构模式,疏水性氨基酸残基如果暴露在分子表面,则表现为一定的疏水性,亲水溶解性降低,而具有较高溶解性的蛋白质分子表面也存在少量的疏水性残基。由于疏水、亲水程度不同,造成蛋白质不同的溶解分散性[23]。
2.3不同pH值缓冲液处理对11S球蛋白二级结构的影响

图3 不同pH值缓冲液处理后11S球蛋白圆二色光谱Fig.3 Circular dichroism spectra of glycinin at different pH levels
采用远紫外区圆二色光谱研究不同pH值缓冲液处理对11S球蛋白二级结构的影响。如图3所示,蛋白质的圆二色光谱分为远紫外区域和近紫外区域,远紫外区域是肽键的吸收峰范围,反映了肽链构象。在远紫外区域,天然大豆蛋白质在194 nm波长附近显示一个正峰,218 nm波长处显示一个负峰,表明存在β-折叠结构;208 nm和222 nm波长处显示两个负凹槽,表示存在α-螺旋结构;204 nm和224 nm波长附近产生双正峰代表存在β-转角结构;在220~230 nm波长之间存在一个微弱的正峰,是无规卷曲结构的特征峰。由以上结果可知,11S球蛋白包含4类二级结构:α-螺旋,β-转角,β-折叠和无规卷曲,其中α-螺旋含量较低,β-折叠及无规卷曲含量较高[24]。
表1为根据图3经计算机拟合得到的11S球蛋白二级结构变化情况。11S球蛋白中α-螺旋结构的含量随pH值的升高而增大,β-折叠结构和无规卷曲结构含量随pH值的升高而降低,β-转角结构含量无明显变化,这表明随着pH值的升高,11S球蛋白发生由β-折叠和无规卷曲结构向α-螺旋结构的转变。

表1 不同pH值缓冲液处理后11S球蛋白二级结构含量Table 1 Secondary structure contents of glycinin at different pH levels%
不同pH值缓冲液处理后11S球蛋白在208 nm及222 nm波长处的平均残基摩尔椭圆度[θ]见图4。由于208、222 nm是α-螺旋结构的特征峰,可以用于直观分析α-螺旋的变化趋势。由图4可知,11S球蛋白α-螺旋结构的含量会随208 nm和222 nm两处负凹槽强度增加而增大,通过[θ]208nm及[θ]222nm两处绝对值增加可以看出,随着pH值的升高,11S球蛋白二级结构中α-螺旋的含量逐渐增大,与表1中程序分析结论一致。

图4 不同pH值缓冲液处理后11S球蛋白平均残基摩尔椭圆度Fig.4 Mean residue ellipticity of glycinin at different pH levels
Hou等[25]报道,蛋白表面疏水性和α-螺旋含量呈负相关。分析原因可能是蛋白质分子内α-螺旋结构含量增加时,蛋白质分子发生了轻微的聚集,部分非极性基团和疏水基团被包裹在分子内部,导致表面疏水性下降。因此,在pH 7~10的范围内,11S球蛋白[θ]222nm的绝对值随pH值的升高增大(图4),表明分子内α-螺旋结构含量逐渐升高,这与11S球蛋白表面疏水性呈负相关。
2.4不同pH值缓冲液处理对11S球蛋白三级结构的影响
侧链的变化可以反映大豆蛋白三级结构的改变。pH值改变后,处于大豆11S球蛋白内部的疏水侧链会暴露在分子外部的极性环境中,或处于蛋白外部的疏水性侧链内卷于分子内部非极性环境中,这种微环境的变化导致色氨酸内源荧光光谱的改变。在295 nm波长处激发产生的光谱主要是由色氨酸残基发射[20],11S球蛋白的荧光峰实际上是色氨酸残基的荧光峰,峰位一般在325~350 nm波长范围波动[26]。
蛋白质是由氨基酸通过肽键按一定顺序连接起来的、具有一定空间结构的大分子,由于分子内含有大量可解离的基团,蛋白质在不同环境中会呈现不同的状态。蛋白质分子可解离的基团除氨基和羧基外,还有大量凸出的侧链基团,如组氨酸的咪唑基、酪氨酸的羟基等[27]。外部环境酸碱度的改变能够引起蛋白质可解离基团的电离情况变化,从而导致蛋白质结构发生改变。因此通过研究溶液中pH值的变化对11S球蛋白荧光性质的影响,可以得出蛋白三级结构变化的信息。由图5可知,在pH 7~10的范围内,不同pH值缓冲液处理对11S球蛋白的荧光光谱峰形几乎没有影响,但荧光强度和λmax发生了改变,其变化情况见表2。
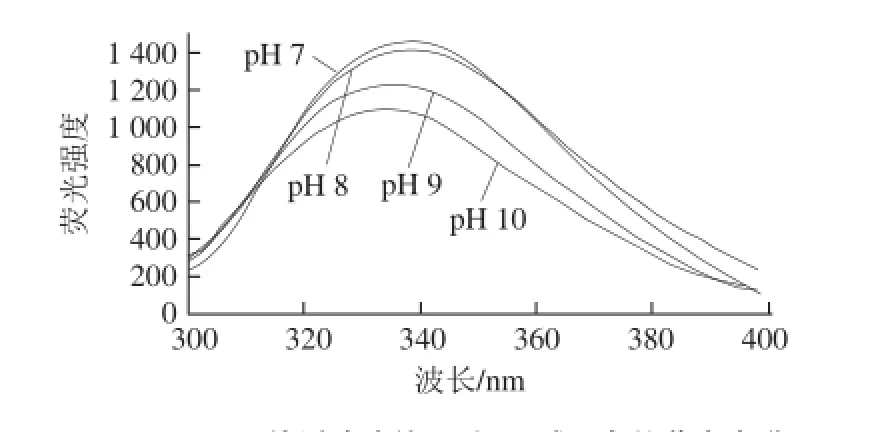
图5 不同pH值缓冲液处理后11S球蛋白的荧光光谱Fig.5 Fluorescence spectra of glycinin at different pH levels

表2 不同pH值缓冲液处理后11S球蛋白的荧光强度及Table 2 Fluorescence intensity andλmmaaxxof glycinin at different pH levels
表2为经过不同pH值缓冲液处理后样品的荧光强度和λmax,二者的改变反映了色氨酸残基变化的程度和所处微环境的变化。在pH 7~10的范围内,随着pH值的增大,11S球蛋白的荧光强度逐渐降低。分析荧光强度的变化原因,可能由于蛋白分子受到酸碱度的影响,分子内色氨酸残基发生荧光淬灭作用[27],导致色氨酸残基荧光强度降低。
λmax与色氨酸残基所处的微环境有关,λmax小于330 nm表明色氨酸残基位于分子内部非极性环境中,λmax大于330 nm表明色氨酸残基位于外部极性环境中[28]。由表2可知,不同pH值条件下11S球蛋白的λmax均大于330 nm,说明有色氨酸残基分布在蛋白质分子外部极性环境中。但随着pH值的升高,11S球蛋白的λmax向短波方向移动(发生蓝移),表明蛋白发生了聚集,部分色氨酸残基包埋于分子内部的非极性环境中,其所处的微环境极性降低。
3 结 论
采用圆二色光谱和荧光光谱研究pH值对11S球蛋白结构和表面疏水性的影响,得到如下结论:除等电点外,11S球蛋白的表面疏水性与溶解性呈负相关(r=-0.716,P<0.05);圆二色光谱结果分析表明,在pH 7~10范围内,随着pH值的升高,11S球蛋白二级结构中α-螺旋含量逐渐增加,β-折叠和无规卷曲含量逐渐降低,表明11S球蛋白的表面疏水性与α-螺旋呈负相关;荧光光谱分析结构表明,在pH 7~10范围内,随着pH值的升高,11S球蛋白的荧光强度和λmax均逐渐降低,表明11S球蛋白中色氨酸残基逐渐“包埋”于分子内部,其所处的微环境极性降低,与11S球蛋白溶解性增加、表面疏水性降低结论相符。
[1] 赵琼,王祥河,赵健,等.功能性大豆浓缩蛋白生产现状及前景展望[J].食品研究与开发, 2009, 30(4): 174-177.
[2] 励慧敏,韩锦华.大豆蛋白和大豆低聚糖在食品加工中的应用[J].食品研究与开发, 2008, 29(7): 159-161.
[3] 熊拯,郭兴凤,石晶.大豆分离蛋白的提取及其在面制品中的应用[J].粮油食品科技, 2006, 14(6): 59-61.
[4]MOURE A, SINEIRO J, DOMINGUEZ H, et al. Functionality of oilseed protein products: a review[J]. Food Research International, 2006, 39(9): 945-963.
[5] 田琨,管娟,邵正中,等.大豆分离蛋白结构与性能[J].化学进展, 2008, 20(4): 565-573.
[6]GUAN Xiao, YAO Huiyuan, CHEN Zhengxing, et al. Some functional properties of oat bran protein concentrate modified by trypsin[J]. Food Chemistry, 2007, 101(1): 163-170.
[7] 孙欣,王璋,王莉,等.轻度酶解对大豆蛋白胶凝性和疏水性的影响[J].食品科学, 2005, 26(12): 37-40.
[8] 刘粼.酶法有限水解对大豆分离蛋白乳化性能的影响[J].中国粮油学报, 2002, 15(1): 26-29.
[9]TORREZAN R, THAM W P, BELL A E, et al. Effects of high pressure on functional properties of soy protein[J]. Food Chemistry, 2007, 104(1): 140-147.
[10] 周筠梅,周军贤.蛋白质表面疏水性的研究[J].生物物理学报, 1996, 12(4): 559-564.
[11]SEMISOTNOV G V, RODIONACA N A, RAZGULYZEV O I, et al. Study of the“molten globule”intermediate state in protein folding by a hydrophobic fluorescent probe[J]. Biopolymers, 1991, 31(1): 119-128.
[12] 王辰,江连洲,魏冬旭,等.不同品种大豆分离蛋白结构与表面疏水性的关系[J].食品科学, 2012, 33(9): 54-57.
[13]HUANG Weining, SUN Xiuzhi. Adhesive properties of soy protein modified by sodium dodecyl sulfate and sodium dodecylbenzenz sulfonate[J].Journal of the American Oil Chemists’Society, 2000, 77(7): 705-708.
[14]FUKUSHIMA D. Recent progress of soybean protein isolate foods: chemistry, technology and nutrition[J]. Food Reviews International, 1991, 7(3): 323-351.
[15]RICKERT D A, JOHNSON L A, MURPHY P A. Functional properties of improved glycinin andβ-conglycinin fractions[J]. Food and Chemical Toxicology, 2004, 69(4): 304-311.
[16]NAGANO T, HIROTSUKA M, MORI H, et al. Dynamic viscoelastic study on the gelation of 7S globulin from soybeans[J]. Journal of Agricultural and Food Chemistry, 1992, 40(6): 941-944.
[17]LOWRY O H, ROSEMBROUG H J, LEWIS A, et al. Proteinmeasurement with the folin phenol reagent[J]. Journal of Biological Chemistry, 1951, 193(1): 265-275.
[18]KATO A, NAKAI S. Hydrophobicity determined by a fluorescence probe method and its correlation with surface properties of proteins[J]. Biochimica et Biophysia Acta(BBA)-Protein Structur e, 1980, 624(1): 13-20.
[19]HUANG Weining, SUN Xiuzhi. Adhesive properties of soy proteins modified by urea and guanidine hydrochloride[J]. Journal of the American Oil Chemists’Society, 2000, 77(1): 101-104.
[20]YUAN Y J, VELEV O D, CHEN C. Effect of pH and Ca2+induced association of soybean proteins[J]. Journal of Agricultural and Food Chemisty, 2002, 50(17): 4953-4958.
[21]ANDR☒SM, SINEIRO J, HERMINIA D, et al. Functionality of oilseed protein products: a review[J]. Food Research International, 2006, 39(9): 945-963.
[22]SHURYO N. Structure-function relationships of food proteins: with an emphasis on the importance of protein hydrophobicity[J]. Journal of Agricultural and Food Chemistry, 1983, 31(4): 676-683.
[23]CHERRY J P. Protein functionality in foods[M]. Washington DC: ACS Symposium, 1980: 147.
[24] SREERAMA N, VENYAMINOV S Y U, WOODY R W. Estimation of the number ofα-helical andβ-strand segments in proteins using circular dichroism spectroscopy[J]. Protein Science, 1999, 8(2): 370-380.
[25] HOU H J, CHANG K C. Structural characteristics of purifiedβ-conglycinin from soybeans stored under four conditions[J]. Journal of Agricultural and Food Chemisty, 2004, 52(26): 7931-7937.
[26] KALAPATHY U, HETTIARACHCHY N S, RHEE K C. Effect of drying methods on molecular properties and functionalities of disulfide bond-cleaved soy proteins[J]. Journal of the American Oil Chemists’Society, 1997, 74(3): 195-199.
[27] 王中江, 江连洲, 魏冬旭, 等. pH值对大豆分离蛋白构象及表面疏水性的影响[J]. 食品科学, 2012, 33(11): 47-51.
[28] TRAVERSO N, MENINI S, MAINERI E P, et al. Malondialdehyde, a lipoperoxidation-derived aldehyde, can bring about secondary oxidative damage to proteins[J]. Journals of Gerontology Series A: Biological Sciences and Medical Sciences, 2004, 59(9): 890-895.
Influence of pH on Structure and Surface Hydrophobicity of Glycinin
WEI Dongxu1,2, JIANG Lianzhou1,*, WANG Chen3, WANG Zhongjiang1
(1. College of Food Science, Northeast Agricultural University, Harbin 150030, China; 2. Heilongjiang Entry-Exit Inspection and Quarantine Bureau, Harbin 150001, China; 3. College of Engineering, Dali University, Dali 671003, China)
Lowry method, 8-anilinonaphthalene-1-sulfonic acid ammonium salt (ANS) fluorescence probe, circulardichroism and fluorescence spectroscopy were applied to explore the solubility, surface hydrophobicity, secondary structureand tertiary structure of glycinin at different pH conditions with the aim to provide the theoretical basis for the research onrelationship between soybean protein structure and surface hydrophobicity. The results showed that the transformation fromβ-sheet structure and random coil toα-helix structure occurred, and the microenvironment polarity of Trp residues revealedan obvious decrease with increasing pH. A negatively linear correlation between the surface hydrophobicity and solubilityof glycinin was observed, and the surface hydrophobicity of glycinin was also negatively correlated with the content ofα-helix structure.
glycinin; pH; structure; surface hydrophobicity
TS201.2
1002-6630(2015)11-0001-05
10.7506/spkx1002-6630-201511001
2014-12-23
国家自然科学基金面上项目(31071493)
魏冬旭(1983—),女,工程师,硕士研究生,研究方向为粮食、油脂及植物蛋白工程。E-mail:w22547800@hotmail.com
*通信作者:江连洲(1960—),男,教授,博士,研究方向为粮食、油脂及植物蛋白工程。E-mail:jlzname@163.com
