氧化型甘露聚糖修饰的肿瘤细胞疫苗诱导CTL的抗肿瘤免疫效果评价
2015-01-02
(中国医科大学附属第一医院肿瘤研究所生物治疗研究室,沈阳 110001)
氧化型甘露聚糖修饰的肿瘤细胞疫苗诱导CTL的抗肿瘤免疫效果评价
宿佳,王雨桐,祁馨卉,李妍,吴迪,刘云鹏,姜又红
(中国医科大学附属第一医院肿瘤研究所生物治疗研究室,沈阳 110001)
目的研究将氧化型甘露聚糖修饰的肾透明细胞癌细胞786-0作为肿瘤细胞抗原致敏树突状细胞(DC),观察其诱导产生的CTL对肾透明细胞癌的杀伤作用。方法分离健康志愿者外周血单个核细胞,体外经GM-CSF和IL-4刺激DC成熟。以肾癌786-0整个细胞作为肿瘤抗原,并制备成氧化型甘露聚糖肿瘤细胞疫苗。实验分组:空白组(DC-PBS组),对照组(Control-DC-786-0融合瘤苗组)、实验组(DC-Ox-Mannose-786-0融合瘤苗组)。流式细胞术检测各组DC表型的变化情况,ELISA法检测各组DC上清IL-12的分泌水平,CCK-8法检测各组DC诱导的细胞毒性T淋巴细胞(CTLs)对肾癌细胞786-0的杀伤效果。结果经流式细胞仪分析检测:DC-Ox-M-786-0组DC表面成熟标志CD80、CD83、CD86、HLA-DR的表达水平明显高于Control-DC-786-0组及DC-PBS组,ELISA法测得实验组IL-12的分泌水平也明显高于Control-DC-786-0组和DC-PBS组,与此同时DC-Ox-M-786-0组诱导的各组细胞毒性T淋巴细胞(CTLs)杀瘤活性较Control-DC-786-0组、DC-PBS组均明显增强。结论氧化型甘露聚糖化抗原能更为有效的致敏DC,并刺激其成熟,增强其抗原递呈功能,与此同时对于肿瘤细胞的杀伤作用也有明显的提高。
肾透明细胞癌;树突状细胞;甘露糖受体
肾癌(renal cell carcinoma,RCC)是泌尿系统中最常见的恶性肿瘤,其发病率仅次于膀胱癌,占成人恶性肿瘤的3%左右[1],由于其早期临床症状不明显,导致患者就诊时多已发生转移[2]。目前肾癌的治疗仍以手术切除为主,但是对于晚期转移性肾癌,根治性手术并不能达到完全治愈的目的,与此同时传统的放化疗对其有效治愈率仅在2%~6%,免疫生物治疗是继手术,放化疗之后第4种肿瘤的治疗模式。其中,树突状细胞(dentritic cell,DC)疗法作为免疫治疗方法之一在启动免疫反应中发挥关键作用,DC是机体内最重要、功能最强的专职抗原递呈细胞[3]。近年来大量研究表明,将不同形式肿瘤抗原负载的DC制成疫苗,可以在体内外诱导出细胞毒性T细胞(cytotoxic T lymphocyte,CTL)的生成,以及激发人体有效的抗肿瘤免疫功能。树突状细胞通过其细胞表面受体对各种外来抗原进行识别并且摄取,其中甘露糖受体(mannose receptor,MR)是DC膜表面常见的受体之一,其具有多个胞外结构域[4],能识别和结合广泛的内源性和外源性配体,内化外来抗原、在维持内环境稳态、抵御病原体感染和呈递抗原等方面中发挥重要作用。利用DC表面的甘露糖受体介导抗原内化这一功能,本实验拟采用肾癌786-0全细胞作为抗原,并对其进行糖基化修饰,原理是基于氧化型甘露聚糖表面的醛基可以和肿瘤细胞膜蛋白胞外段赖氨酸残基上的ε氨基结合形成Schiff键,直接修饰肾癌786-0肿瘤细胞,将氧化型甘露聚糖化抗原与DC通过PEG诱导融合,制备成DC疫苗,与此同时致敏T淋巴细胞,诱导产生细胞毒T淋巴细胞(CTLs),并观察DC免疫表型的变化及其对抗肿瘤细胞的杀伤作用。
1 材料与方法
1.1 材料与主要试剂
甘露聚糖、高碘酸钠、Sephadex-G25葡聚糖凝胶、聚乙二醇(PEG)购自Sigma公司;人外周血单个核细胞来源于健康志愿者;重组人粒单核细胞集落刺激因子(GM-CSF)、重组人白细胞介素4(IL-4)、重组人肿瘤坏死因子α(TNF-α)均购自厦门特宝公司;淋巴细胞分离液购自天津灏洋生物技术有限公司;PE标记的鼠抗人CD80、APC标记的鼠抗人CD83、FITC标记的鼠抗人CD86抗体及PE标记的鼠抗人HLA-DR均购自美国BD公司;IL-12ELISA检测试剂盒购自博尔美生物科技有限公司;CCK-8试剂盒购自江苏碧云天生物技术研究所;RPMl640、胎牛血清购自GIBCO公司。
1.2 方法
1.2.1 外周血DC的分离和培养:取健康志愿者外周血20 mL,利用淋巴细胞分离液,根据密度梯度离心法获得外周血单个核细胞(peripheral blood mononuclear cell,PBMCs)。加入不全培养基1640(含10%胎牛血清)进行培养,2 h后将未贴壁细胞吸至另一培养瓶中用于效应T细胞进行培养,贴壁细胞用不全培养基继续培养,并加入细胞因子GM-CSF(1 000 IU/mL)、IL-4(500 IU/mL);每3 d半量换液并补加细胞因子;培养到第6天加入TNF-α(1 000 IU/mL)诱导DC成熟,第7~8天可收获成熟DC。
1.2.2 T细胞的诱导培养:将1.2.1中未贴壁的细胞置于另外一个培养瓶中,加入IL-2(500 IU/mL)诱导出T淋巴细胞用作效应细胞,于-80℃冻存备用。
1.2.3 氧化型甘露聚糖的制备:将14 mg/mL甘露聚糖磷酸钠(0.1 mol/L,pH6.0)溶液加入已配制的高碘酸钠溶液中,使其终浓度达0.01 mol/L,4℃下静置1 h,然后加入10 mL乙二醇,再于4℃下静置30 min,即为氧化型甘露聚糖。将氧化型甘露聚糖通过碳酸氢钠缓冲液平衡的Sephadex-G25凝胶柱脱盐收集,置于无菌EP管,保存于-20℃。
1.2.4 氧化型甘露聚糖修饰肿瘤细胞抗原的制备及体外致敏DC:收集对数生长期的肾癌786-0细胞用做全细胞抗原,经胰酶消化,在倒置显微镜下观察细胞处于半悬浮状态时,用不全培养基1640(含10%的胎牛血清)终止消化,低速离心,弃上清,后把细胞重悬于氧化型甘露聚糖溶液中,20℃振荡过夜,离心收集,于PBS中重悬,即可作为Ox-M-786-0糖基化抗原。将制备好的糖基化抗原与预先培养好的DC(1×106/mL)以10∶1的比例进行混合培养,PEG诱导细胞融合,3 d后收集负载糖基化肿瘤全细胞抗原的DC疫苗。
1.2.5 肾癌786-0全细胞与DC融合瘤苗的制备:收集对数生长期的肾癌786-0细胞,用胰酶进行消化,后用不完全培养基(含10%的胎牛血清)终止消化,低速离心,弃上清,将细胞悬浮于不含胎牛血清的1640培养基中,加入到培养6 d后的DC(1×106/mL)中,以10∶1的比例均匀混合,PEG诱导融合,3 d后收集负载肿瘤全细胞抗原的DC疫苗。
1.2.6 流式细胞术检测各组DC的表型:DC负载抗原3 d后,收集待检测的各组DC,用4℃预冷的PBS洗涤2次,调整细胞密度约1×106/mL,每个EP管中加入约5×105个细胞,分别加入PE标记的CD80、APC标记的CD83、FITC标记的CD86、PE标记的HLA-DR荧光抗体,4℃避光孵育30 min,随后PBS洗2次,最后用0.5 mL PBS重悬细胞,于流式细胞仪上进行表型分析。
1.2.7 ELISA法检测各组DC上清中IL-12的分泌情况:DC负载抗原3 d后,收集各组DC的上清,细胞碎片用离心法去除,每个样本一式三份,向用IL-12抗体预包被的96孔平底板中分别加入40 μL待测样本,10 μL IL-12抗体,50 μL生物素标记的辣根过氧化物酶,37℃孵育,60 min后,洗涤5次,各孔中加入50 μL的显色液A和B,37℃避光孵育10 min,最后加入50 μL终止液后立即在酶标仪上监测各组的OD值,再根据标准曲线换算出各组DC上清中IL-12的浓度。
1.2.8 CCK-8法测定致敏DC激活的T淋巴细胞对肿瘤细胞杀伤效果:DC负载抗原3 d后,将3组DC分别与自体T淋巴细胞按1∶10的比例混合,用含IL-2(500 U/mL)的RPMI 1640培养基培养,收集共培养7 d的3组淋巴细胞为效应细胞。以肾癌细胞786-0为靶细胞(1×107/孔),组内设定不同的效靶比(1∶10、1∶20、1∶40)观察孔,每种效靶比均设3个复孔,37℃、5%CO2饱和湿度的培养箱中孵育24 h,然后加入CCK-8溶液20 μL,37℃下继续孵育3 h,在酶标仪450 nm上观察OD值。杀伤率=[1-(实验组OD值-单独效应细胞OD值)/单独靶细胞OD值]×100%,其中OD为吸光度。
1.3 统计学分析
采用SPSS 16.0统计软件进行统计学分析,所有数据用x±s表示,多组间比较采用单因素方差分析,检验水准α=0.05。
2 结果
2.1 倒置显微镜下肾癌786-0细胞的形态
镜下见肾癌细胞大多是以贴壁生长,呈梭行,大小差异不大,高倍镜下可见多核巨细胞,核大而圆,有多个核仁,见图1。
图1 肾癌786-0×100Fig.1 Renal cell carcinoma 786-0×100
2.2 氧化型甘露聚糖细胞抗原负载对DC表型的影响
用流式细胞仪分析DC在培养过程中各组免疫表型的变化情况。结果如图2,3所示,DC-Ox-Mannose-786-0组DC的表型分子CD80、CD83、CD86、HLA-DR的表达均显著高于DC-786-0组和DC-PBS组[(49.70±6.48)%vs(25.13±3.28)%、(11.50± 1.93)%,P<0.05;(56.17±5.10)%vs(29.60± 2.80)%、(15.53±2.41)%,P<0.05;(54.63±2.93)%vs(30.43±3.05)%、(15.27±3.09)%,P<0.05;(64.70± 5.48)%vs(40.63±5.32)%、(22.73±2.76)%,P<0.05];DC-Ox-Mannose-786-0组与DC-786-0组及DC -PBS组各组数据均有统计学意义(P<0.05),说明糖基化抗原有助于促进DC的成熟。
2.3 氧化型甘露聚糖细胞抗原负载对DC IL-12表达的影响
ELISA法分析负载抗原3 d后的各组DC细胞上清中IL-12的分泌情况。结果如图4所示,DC-Ox-Mannose-786-0组上清中IL-12的分泌量明显高于DC-786-0和DC-PBS组[(17.90±1.57)vs(11.62± 0.57)、(7.78±0.53),P<0.05],结果显示,DC-Ox-Mannose-786-0组DC上清中IL-12的分泌量最高,DC-786-0组DC上清中IL-12分泌量次之,DC-PBS组DC上清中IL-12的分泌量最少,数据显示糖基化抗原有效的促进了IL-12的分泌。
2.4 效应细胞与肿瘤靶细胞最佳杀伤比例的确定
各组效应细胞(CTL)与肾癌786-0细胞混合培养后,用CCK-8测定各组效应细胞CTL的杀伤活性。如图5所示,各组杀伤率由低到高依次为1∶10、1∶20、1∶40,其中在1∶20处可见杀伤率显著升高,而1∶40处杀伤率仅轻微增高,由此可以说明最佳杀伤比例是效应细胞(CTL)与肾癌786-0细胞比例为1∶20。
2.5 各组细胞毒性T淋巴细胞对肾癌(786-0)的细胞毒作用
利用CCK-8法检测各组效应细胞(CTLs)的杀伤率,结果如表1所示,各组效应细胞(CTLs)对肾癌786-0细胞的杀伤率随着效靶比的升高而逐渐增加,杀伤率由低到高依次为1∶10、1∶20,1∶40,各组间比较均有统计学意义(P<0.05),其中于最适效靶比(1∶20)处表现为:糖基化抗原组CTL的杀伤活性均高于细胞全抗原组和对照组[(37.28±2.03)vs(41.03±1.09)、(48.04±1.92)],组间比较差异有统计学意义(P<0.05)。
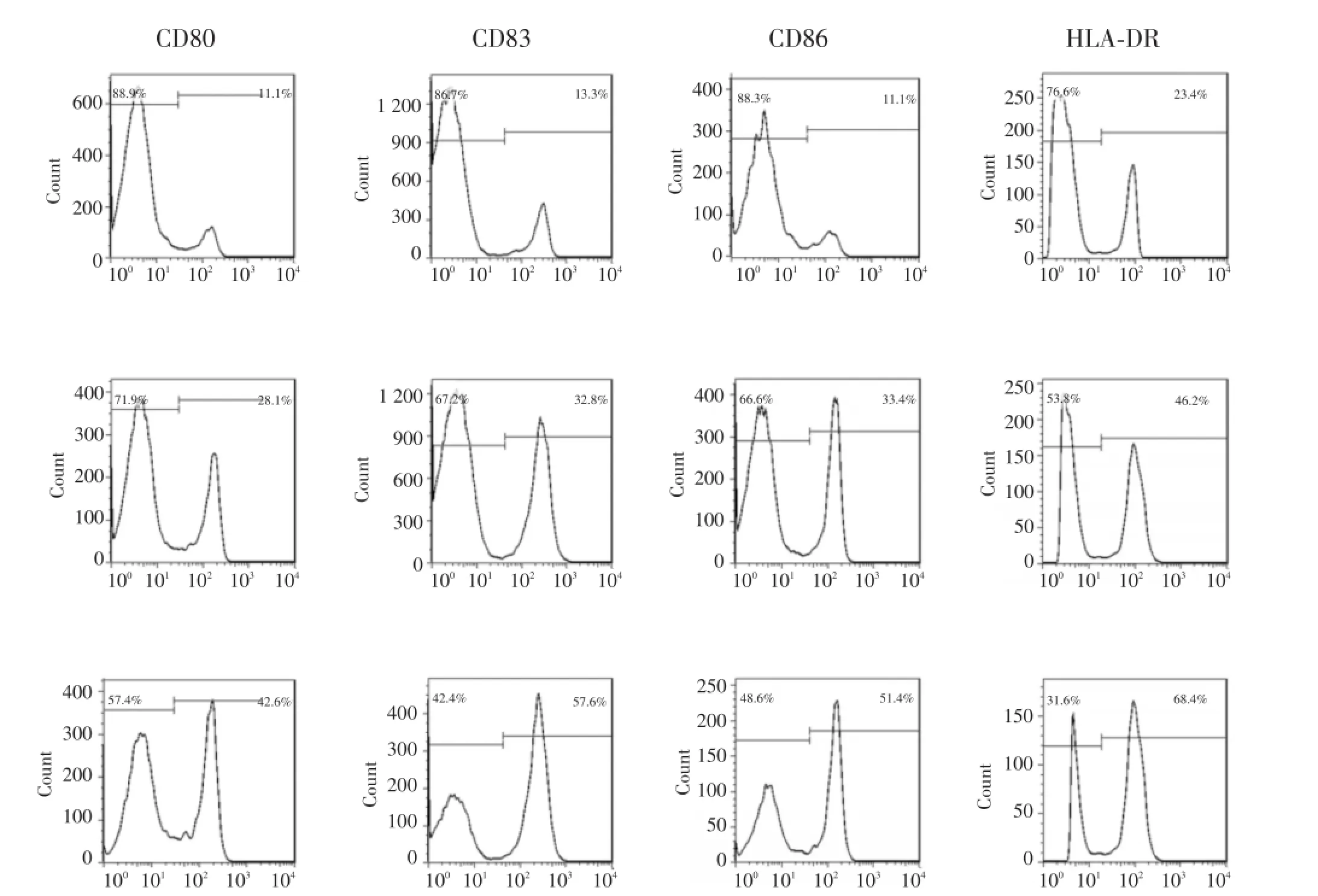
图2 抗原负载对DC表型的影响Fig.2 The influence of DC phenotype after being sensitived by antigens
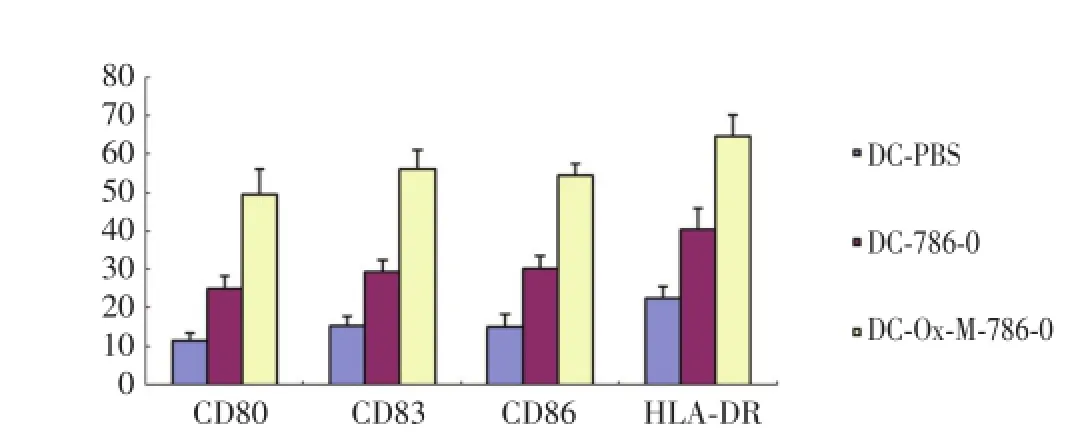
图3 抗原的负载对DC表型的影响Fig.3 The influence of DC phenotype after being sensitived by antigens
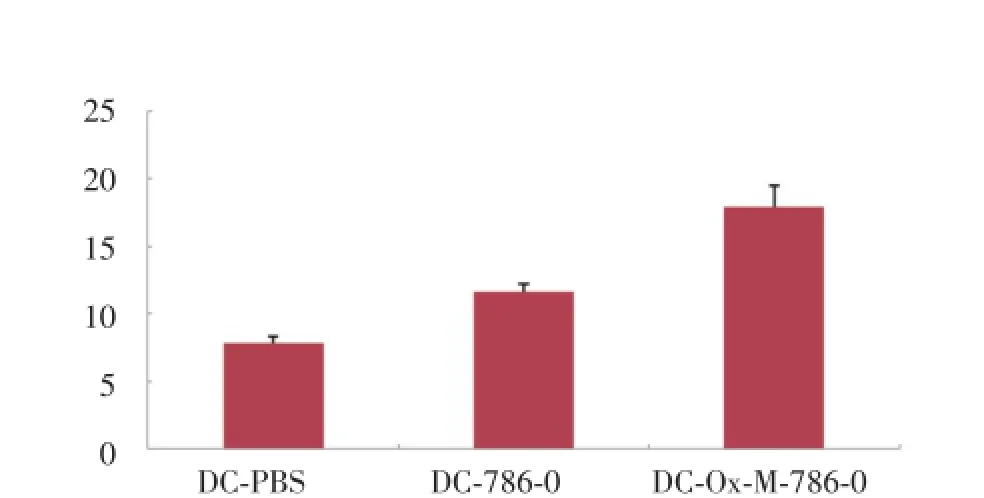
图4 各组DC培养上清IL-12的分泌水平Fig.4 The concentration of IL-12 of DC of each group
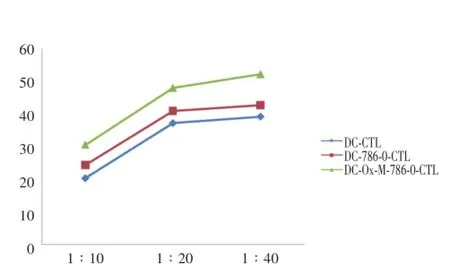
图5 效应细胞与肾癌786-0细胞最佳杀伤比例分析Fig.5 The analysis of the best killing ratio between effector cells(CTLs)cells and renal carcinoma cell line 786-0
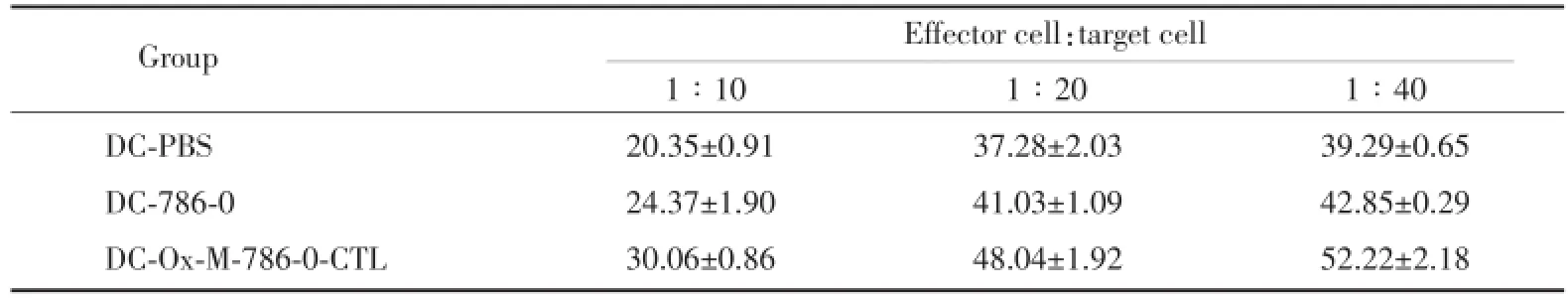
表1 DC诱导的CTL对靶细胞杀伤效率的影响Tab.1 The efficiency of killing effects of the CTLs induced by DC on the target cell
3 讨论
肾透明细胞癌(clear cell renal cell carcinoma,CRCC)是临床上常见的恶性肿瘤,发病率出呈逐年上升的趋势[5]。由于肾癌本身是一种治疗抵抗性癌,因此其对化疗和放疗均不敏感[6],与此同时,免疫生物治疗正逐步成为转移性肾癌的又一有效治疗手段。目前肾癌免疫治疗主要包括细胞因子、肾癌疫苗、免疫靶向治疗等,尤其是以树突状细胞(dendritic cell,DC)介导的肿瘤疫苗免疫生物治疗成为目前研究的热点。DC能有效刺激T淋巴细胞的免疫应答,诱导细胞毒性T淋巴细胞生成[7],同时DC还参与T细胞免疫记忆的维持以及激发免疫记忆的保护,当宿主再次受到肿瘤细胞攻击时发挥保护作用,在诱导免疫应答中具有独特的地位。
MR是20世纪70年代在兔巨噬细胞中被发现的,是DC和巨噬细胞上特有的。许多病原微生物表面富有甘露糖成分,因此MR对病原微生物的清除、激发免疫效应具有重要意义[8]。目前肾癌患者的治疗方案以手术为主,免疫治疗为辅。随着对DC的不断深入研究,如何掌握更成熟的DC体外培养技术,对DC功能的进一步研究,争取提出更有效的“包装处理”DC的方法,以此来增强DC的抗原提呈功能进而诱导出更为有效的特异性细胞毒T淋巴细胞,将成为目前以DC为主的生物治疗研究的重点[9]。
本实验设计将肿瘤全细胞抗原负载DC制备出肿瘤疫苗,较之与体外致敏或抗原基因导入等,肿瘤全细胞作为抗原可以负载肿瘤的全部抗原,包括特异性和非特异性抗原,从而诱导出大量的细胞毒T淋巴细胞CTLs,以此来增强抗肿瘤免疫效应,与此同时对机体的体液免疫也有较为有效的促进作用。因此我们在这里利用氧化型甘露聚糖修饰肾癌786-0肿瘤细胞,制备糖基化肿瘤细胞抗原,与此同时经体外刺激DC细胞制备成融合瘤苗以此来诱导细胞毒特异性T淋巴细胞(CTLs)。实验结果均提示糖基化抗原能够有效的诱导抗肿瘤免疫反应。由此可以认为负载氧化型甘露聚糖修饰的肿瘤细胞疫苗具有很强的免疫原性作用,采用负载糖基化抗原对DC进行“包装”,用以治疗已发生转移的肾细胞癌患者将具有显著的临床应用前景,为应用DC瘤苗治疗晚期或已发生转移的肾细胞癌提供理论依据。
[1]Li Z,Zhang Y,Kim WJ,et al.PGE2 promotes renal carcinoma cell invasion through activated RalA[J].Oncogene,2013,32(11):1408-1415.
[2]Alexiev BA,Tavora F.Histology and immunohistochemistry of clear cell adenocarcinoma of the urethra:histogenesis and diagnostic problems[J].Virchows Arch,2013,462(2):193-201.
[3]Roscnblatt J,McDermott DF.Immunotherapy for renal cell carcinoma[J].Hematol Oncol Clin North Am,2011,25(4):793-812.
[4]Gazi U,Martinez-Pomares L.Influence of mannose receptor in host immune response[J].Immunobiology,2009,214(7):554-561.
[5]湛海伦,高新,邱剑光,等.抗原致敏DC与CIK共培养个体外抗肾癌效应的研究[J].中国病理生理杂志,2006,22(10):1993-1996.
[6]Thumher M,Rieser C,Höltl L,et al.Dendritic cell-based immunotherapy of renal cell carcinoma[J].Urol Int,1998,61(2):67-71.
[7]Park HY,Jin JO,Song MG,et al.Expression of dendritic cell markers on cultured neutrophils and its modulation by anti-apoptotic and proapoptotic compounds[J].Exp Mol Med,2007,39(4):439-449.
[8]Fraser IP,Koziel H,Ezekowitz RA.The serum mannose-binding protein and the macrophage mannose receptor are pattern recognition molecules that link innate and adaptive immunity[J].Semin Immunol,1998,10(5):363-372.
[9]Rosenberg SA,Yang JC,Restifo NP.Cancer immunotherapy:moving beyond current vaccines[J].Nat Med,2004,10(9):909-915.
(编辑裘孝琦)
The Evaluation of Anti-tumor Effect of CTL Induced by Oxidized Mannan-modified Tumor Cells Vaccine
SUJia,WANGYu-tong,QIXin-hui,LIYan,WUDi,LIUYun-peng,JIANGYou-hong
(Cancer Research Institute,The First Hospital,China Medical University,Shenyang 110001,China)
ObjectiveTo study to take the oxidized Mannan-modified 786-0 in renal clear cell carcinom as tumorcells antigen to sensitize Dendritic cells(DC)and to observe the its killing effect on renal clear cell carcinoma of CTLs induced.MethodsGetting the peripheral blood mononuclear cells from the volunteers,and then to be stimulated to turn to be maturation by GM-CSF and IL-4 in vitro.Taking the clear renal carcinoma cell as the tumor antigen,and then making it to be modified by oxidized Mannan to acquire the tumor cell vaccine.Experimental groups include:blank group:DC-PBS group,control group:control-DC-786-0,experimental group:DC-Ox-Mannose-786-0 group.Taking the flow cytometry to detect the changesofDC phenotype,then taking the ELISA to detect the sencretion levels of supernatant ofIL-12 ofDC,then taking the CCKto detecte the cytotoxicity of lymphocytes(CTL)induced by DC of these experiment groups.ResultsResults by flow cytometry:the mature phenotype of DCs sensitized by Ox-Mannose-786-0 group included CD80,CD83,CD86 and HLA-DR expressed significantly higher than the other groups.As well as the secretion levels ofIL-12.Meanwhile the cytotoxicity activity of lymphocytes(CTLs)induced by DCs which are sensitized by Ox-Mannose-786-0 increased more significantly than the other groups.ConclusionGlycosylated Antigens can be more effective in sensitizing antigen-presenting cells DC,and stimulating them to be maturation,while the killing effect to tumor cells also have noticeably improved.
renal clear cell carcinoma;dendritic cells;mannose receptor
R737
A
0258-4646(2015)05-0420-05
沈阳市科学技术计划(F12-278-6-09)
宿佳(1987-),女,硕士研究生.
姜又红,E-mail:jiangyouhong2000@aliyun.com
2014-12-24
网络出版时间:
