玉米秸秆酶解液发酵产γ-聚谷氨酸*
2014-12-25李翠平梁金钟赵红宇
李翠平,梁金钟,赵红宇
1(黑龙江省高等学校食品科学与工程重点实验室,哈尔滨商业大学食品工程学院,黑龙江哈尔滨,150076)
2(黑龙江康普生物科技有限公司,黑龙江哈尔滨,150025)
γ-聚谷氨酸(γ-poly glutamic acid,γ-PGA)是一种微生物在胞内合成并分泌到胞外的水溶性可生物降解型多功能的生物高分子,为水溶性的酰胺化合物,可以通过芽孢杆菌的变种来生产,由 D-谷氨酸和L-谷氨酸单体以γ-羧基与α-氨基以酰胺键的形式缩合而成,分子质量一般在 105~ 106u[1-2]。γ-PGA 具有极佳的成膜性、成纤维性、阻氧性、可塑性、黏结性、保湿性和可生物降解等独特的理化和生物学特性[3]。在食品领域,可作为食品及饮料类的增稠剂,还可以改善饮料的味道;作稳定剂添加在冰淇淋中;纹理强化剂[4-5];粘合剂;动物饲料的添加剂;抗冻剂或保护剂;减轻苦味剂;作为添加剂使用在淀粉食品(面包或面条)可避免老化、改善食品质地和保持食物的形状。在保健方面,它有利于骨质疏松症者对钙的吸收[6,8]。γ-PGA 作为一种生态友好型的生物制品,愈来愈显现出广阔的研究价值和应用前景。
传统枯草芽孢杆菌发酵生产γ-PGA主要采用蔗糖、葡萄糖和玉米糖化液等为碳源。以葡萄糖为碳源,发酵液中 γ-PGA 产量较高(约 19.0 g/L)[9-10]。以柠檬酸钠和豆粕浸提液为碳源,γ-PGA的产量达到40.0 g/L。而以玉米糖化液为碳源的基础,可高产γ-PGA,达68.4 g/L[11]。但利用玉米秸秆酶解液作为碳源进行微生物发酵生产γ-PGA的还未见报道。以可再生的、价格低廉的秸秆为原料,通过特定微生物发酵所得的产物具有极大的潜力,如2,3-丁二醇、燃料乙醇、糠醛和丁醇等[12]。我国年产秸秆7.4亿 t[13],其中玉米秸秆年产量高达 2亿 t以上,但目前开发利用率仍很低[14]。而玉米秸秆一般不能直接被微生物发酵,所以在发酵前要将其转化成可溶性糖。酶法水解玉米秸秆[15]条件温和,副产物少,成本低廉,环境友好,被广泛采纳。
1 材料与方法
1.1 材料与试剂
玉米秸秆,取自哈尔滨郊区;纤维素酶(Celluclast®1.5L,β-葡糖苷酶 Novozymes188),购于诺维信公司;菌种,枯草芽孢杆菌(Bacillus subtilis HCUL-B-115),由哈尔滨商业大学发酵工程实验室筛选、诱变、分离并保藏,中国科学院菌种保藏中心鉴定,中国微生物菌种保藏管理委员会普通微生物中心的菌种保藏号:CGMCCNo.2283。
1.2 仪器与设备
SBA-40D生物传感分析仪(配有 β-D-葡萄糖检测膜及L-谷氨酸检测膜),山东省科学院生物研究所;723可见分光光度计,上海精科有限公司;HNY恒温培养振荡器,天津市欧诺仪器有限公司;DHG-9203A电热恒温鼓风干燥箱,上海一恒科技有限公司;SW-CJ-FD型单人单面净化工作台,苏州净化有限公司;BS 224S电子天平,赛多利斯科学仪器(北京)有限公司;S-3400扫描电子显微镜,HITACHI公司;ES-2030型冷冻干燥,HITACHI公司;E-1010型离子溅射镀膜仪,HITACHI公司。
1.3 培养基
斜面培养基:牛肉膏3.00 g/L、蛋白胨10.00 g/L、NaCl 5.00 g/L、琼脂20.00 g/L,pH 7.2 ~7.4。
种子培养基:牛肉膏3.00 g/L、葡萄糖20.00 g/L、蛋白胨10.00 g/L、NaCl 5.00 g/L,pH 7.2 ~7.4。
发酵培养基:玉米秸秆酶解液、玉米糖化液,CaCl20.42 g/L、蛋白胨5.00 g/L、谷氨酸钠60.00 g/L、NaCl 12.00 g/L、MgSO4·7H2O 1.25 g/L、KH2PO44.00 g/L、MnSO40.08 g/L。
1.4 实验方法
1.4.1 玉米秸秆的预处理
将玉米秸秆自然风干,切成2~5 cm的小段,然后利用粉碎机将玉米秸秆小段粉碎成40目左右的粉末,备用。
蒸煮预处理:称取15 g玉米秸秆粉末置于500 mL耐压试剂瓶中,并以1 g秸秆粉末加入10 mL溶液的比例,向瓶中分别加入 1.0%H2SO4、10.0%NH3OH、水,混匀。将瓶口密封,置于高压锅内121℃,蒸煮 2 h。蒸煮完成后,高压锅温度降至90℃,迅速降压,取出后冷却至室温,用自来水冲洗处理至pH=6.5~7.0(约洗5~6次),然后于 80℃烘干至恒重。
1.4.2 玉米糖化液的制备
取300 g市售玉米粉,加水1 000 mL,加入无水CaCl2(添加量为100 mg/kg)煮沸,调节pH至6.7~7.0,再加入 α-耐高温淀粉酶(添加量为 10 U/g原料),迅速降温至 80~85℃,保温 15~20 min,继续降温至58~60℃,调节pH 4.5,加糖化酶(添加量为120 U/g原料),60℃保温 4 h后,再加热煮沸 10 min,过滤除渣,测定糖化液糖度为17%,生物传感仪测得葡萄糖含量为190 g/L。低温保存备用。
1.4.3 玉米秸秆酶解
取适量经过预处理的玉米秸秆置于250 mL三角瓶中,加入纤维素酶和β-葡糖苷酶,用柠檬酸-柠檬酸钠缓冲液(pH 4.8,0.05 mol/L)调节固液比。放置在恒温培养箱(50℃)中酶解,酶解结束后迅速灭酶(沸水浴10 min),于4 000 r/min下离心10 min,上清液即为纤维素酶水解液,将酶解液适当稀释,测定其中糖的含量。
1.4.4 培养方法
将斜面上的菌种转接到种子培养基中,37℃,150 r/min摇床培养18 h,将活化后的种子培养液按2%的接种量接种至发酵培养基中,37℃,150 r/min摇床培养72 h。
1.4.5 γ-PGA的测定
发酵液在6 000 r/min的转速下离心15 min。取上清液10 mL,加入25 mL的无水乙醇,剧烈摇晃得到团状凝聚物,将其转入恒重的称量瓶中,置于电热恒温鼓风干燥箱中100℃下烘至恒重,得到块状样品,并称重。
1.5 分析方法
1.5.1 葡萄糖含量测定
待测酶解液稀释100倍后用SBA-40D生物传感分析仪测定葡萄糖含量(g/L)。
1.5.2 还原糖含量测定
用 3,5-二硝基水杨酸法(DNS 法)[16]测定。
用间苯三酚-冰醋酸法测定[17]。
1.5.4 电镜扫描分析
分别将处理前后的秸秆以及酶解后的秸秆进行烘干、粉碎,用扫描电镜进行分析(扫描电压为 5 kV,放大1 000倍),观察玉米秸秆内部纤维素束的微观结构变化。
2 结果与分析
2.1 玉米秸秆处理前后电镜扫描分析
不同条件预处理的玉米秸秆电子扫描电镜图像见图1-a。粉碎与未粉碎的玉米秸秆结构差别明显,未粉碎的玉米秸秆呈纤维素状,表面光滑,细胞排列整齐,结构完整。细胞壁(其主要成分为纤维素)包裹着细胞内容物,纤维素结构之间连接紧密,其致密的表面结构是阻碍纤维素酶作用于纤维素,进而阻碍水解的主要原因。而粉碎后的秸秆呈现出明显的断层,纤维组织被破坏;由图1-b、c、d可见,不同预处理条件的玉米秸秆其复杂的纤维素结构均发生了变化。原有的纤维平行排列结构被破坏,细胞壁撕裂变为絮状纤维,细胞间距拉大,轮廓模糊,细胞内容物游离出来。虽然呈束状结构,但是结构表面有许多不规则的沟壑和坑洞,整个束状结构变得松散,不完整,这些结构变化增加了纤维素酶与纤维素的接触面积,有利于酶解反应的进行;由图左右两图对比可见:秸秆预处理后束状结构表面都有许多的孔洞,但是整体束状结构仍然很完整,没有较大的破坏,这说明纤维结构破坏不充分,而经酶解处理后的玉米秸秆,秸秆表面出现许多大的坑洞,变得十分疏松,几乎看不到原来的束状结构,这是因为经过酶解处理后玉米秸秆复杂致密的结构被破坏,内部变得疏松多孔,很明显酶解的都较充分。

图1 不同处理条件下秸秆电子扫描电镜图像Fig.1 Electron microscope images of corn straw under different treatment conditions
水、酸、碱3种预处理方法对比,酸碱预处理明显提高了酶对玉米秸秆的接触面积,使得酶解反应进行的很充分,秸秆束状结构大部分被破坏,说明经过预处理的玉米秸秆更适于能源的生物转化。
2.2 玉米秸秆酶解单因素实验
2.2.1 酶用量对糖浓度的影响
玉米秸秆在 pH 5.0、反应时间 72 h、温度为50 ℃、底物比例为 1∶15、酶用量分别为 20、25、30、35、40 FPIU/g条件下酶解,然后离心,稀释酶解液,测定出糖浓度。结果见图2。
四十多岁,就疾病缠身,这种遭遇,大抵是悲催的。以至于我长时间处在一种忧虑与焦躁的状态当中。戒酒是必须的。有几次,在泸州和毕节,都是产好酒的地方,却不敢再喝一口。因此,我特别怀念自己还可以喝酒时候的某种癫狂状态。其实,酒解决和带入的是人生的混沌境界,这种混沌是激越和亢奋的,也是欢乐与丰富的,就像去掉了肉身,进入到了纯粹的灵魂仙境一般。
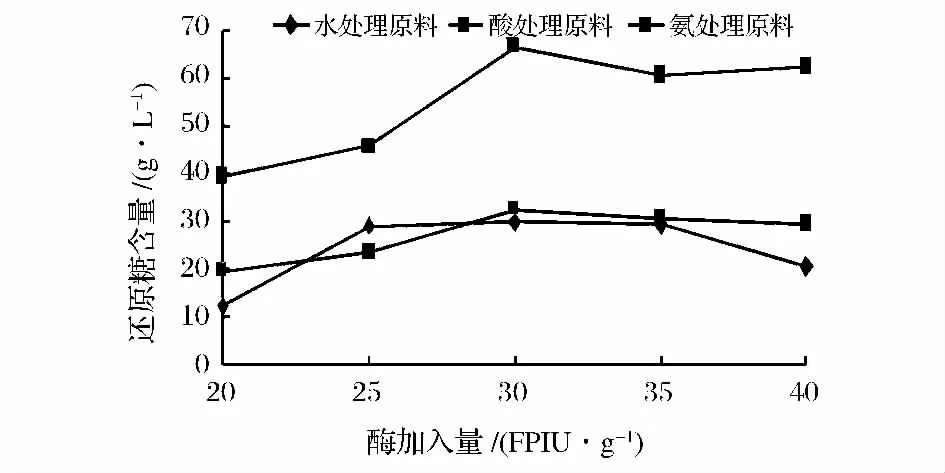
图2 酶加入量对还原糖浓度的影响Fig.2 Effect of the amount of enzyme on reducing sugar yield
由图2可以看出,当酶加入量为30 FPIU/g时,玉米秸秆酶解后含糖量最高;当酶加入量低于30 FPIU/g时,随着酶加入量的不断升高,还原糖含量随之升高;当高于30 FPIU/g时,随着酶加入量的升高,还原糖含量呈现下降趋势。这说明,酶与底物配比最佳量,在最适反应底物量时,酶活力最大,还原糖含量达到最高。
2.2.2 底物比例对糖浓度的影响
玉米秸秆在 pH 5.0、反应时间 72 h、温度为50℃、酶用量分别为25 FPIU/g、底物比例分别为1∶15、1∶20、1∶25、1∶30、1∶35 条件下进行酶解反应,然后进行离心,稀释酶解液,测定出糖浓度。结果见图3。
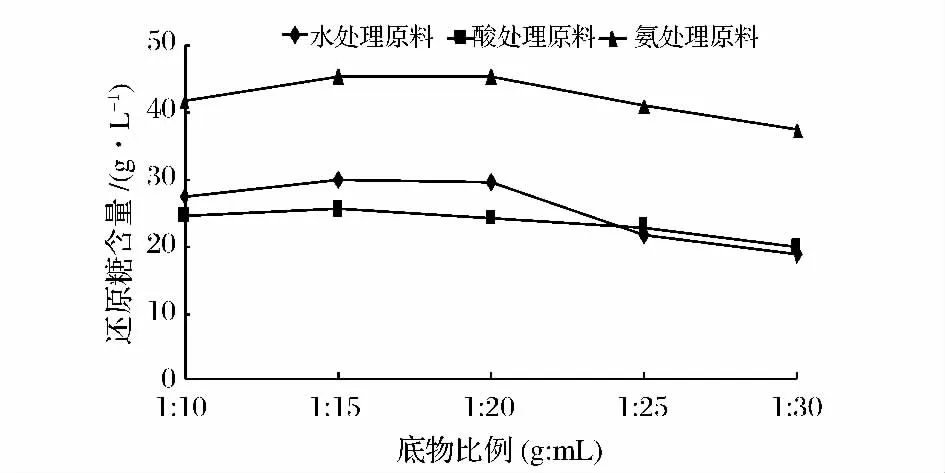
图3 底物比例对还原糖浓度的影响Fig.3 Effect of the substrate concentration on reducing sugar yield
从图3可以看出,当底物比例为1∶15时,还原糖含量较高,随着底物比例的增加,还原糖含量也增加,这是由于在酶用量一定的情况下,与底物接触的越充分,酶解越彻底,从而使更多的糖能够释放出来。底物比例对酶解反应非常重要,如果加缓冲液较少,酶则不能够充分与底物接触,从而降低酶解液含糖量;若加酶量太多,则增加了生产成本,综合考虑,底物比例选择1∶15。
2.2.3 酶解时间对糖浓度的影响
玉米秸秆在温度50℃、酶用量25 FPIU/g、酶解pH 5.0、反应时间 60、72、84、96、108 h 的条件下酶解,然后离心,得到酶解液,结果见图4。
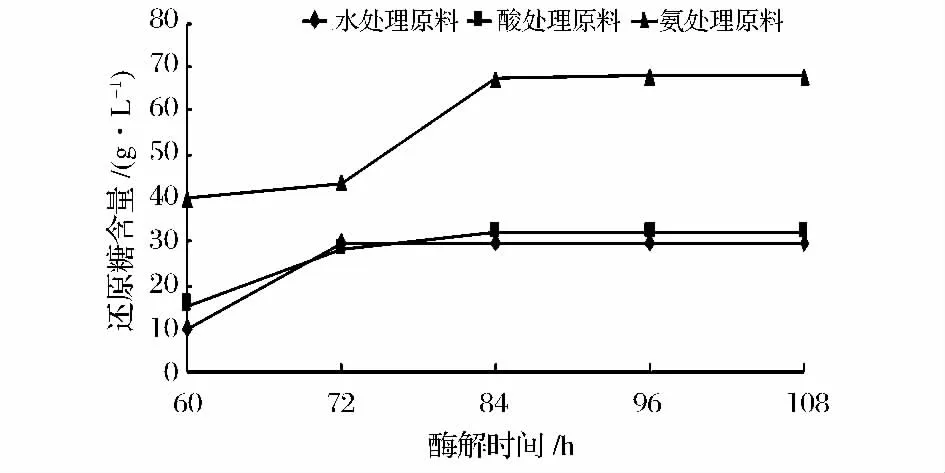
图4 酶解时间对还原糖浓度的影响Fig.4 Effect of the time on reducing sugar yield
从图4可以看出,随着酶解时间的延长,玉米秸秆酶解液中还原糖含量升高。在最初的酶解阶段,还原糖含量提高得较为明显,随后作用效果就减弱,酶解时间是使纤维素降解的关键,适合的时间应该根据还原糖含量来确定。酶解时间长有利于糖量升高,但酶解时间超过84 h后出糖量增加缓慢,从工作效率、设备利用以及能耗等经济角度来衡量,最适的酶解时间为84 h。
2.3 玉米秸秆酶解正交试验结果
玉米秸秆经不同的预处理方法处理后进行酶解,酸、碱、水预处理,相对碱效果要好。以氨处理原料进行酶解条件优化,选择酶浓度(A)、底物比例(B)、酶解时间(C)3个因素,每个因素3个水平,采用L9(34)进行正交试验,以还原糖含量为评价指标,对玉米秸秆酶解条件进行优化。确定正交试验的因素和水平见表1-表3。

表1 玉米秸秆酶解糖化正交试验的因素水平表Table 1 Maize straw enzyme saccharification factors and levels for orthogonal array design
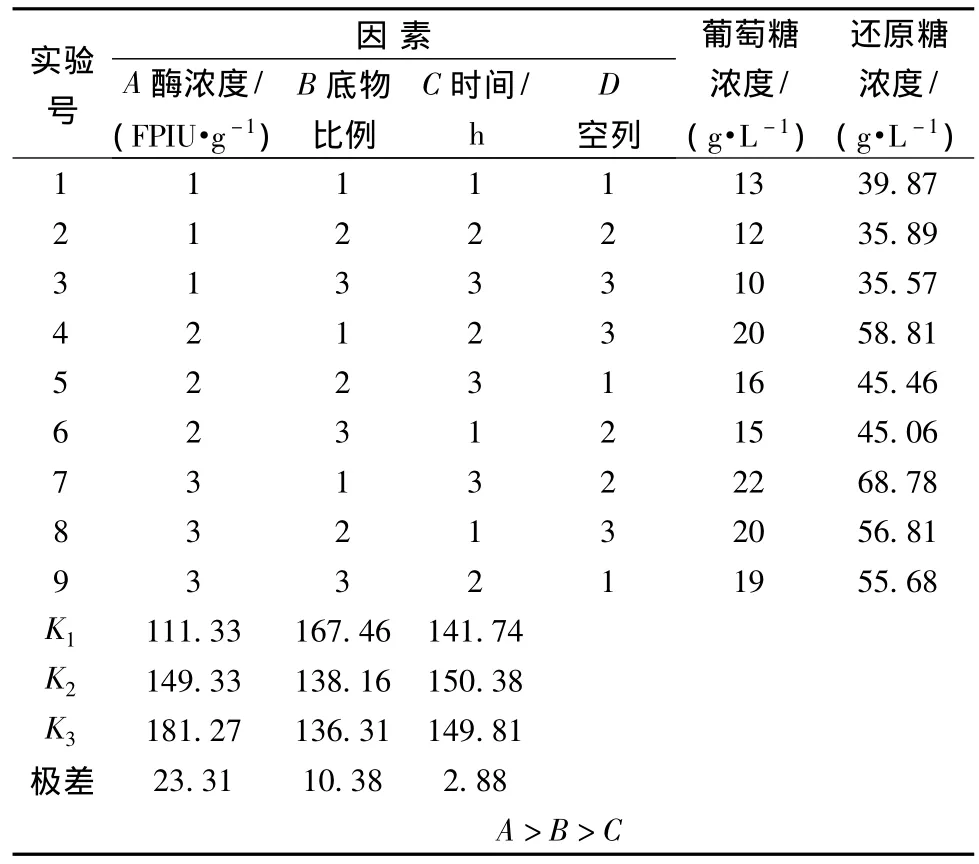
表2 10.0%NH3OH处理原料正交试验设计及结果Table 2 10.0%NH3OH treatment orthogonal array design and results
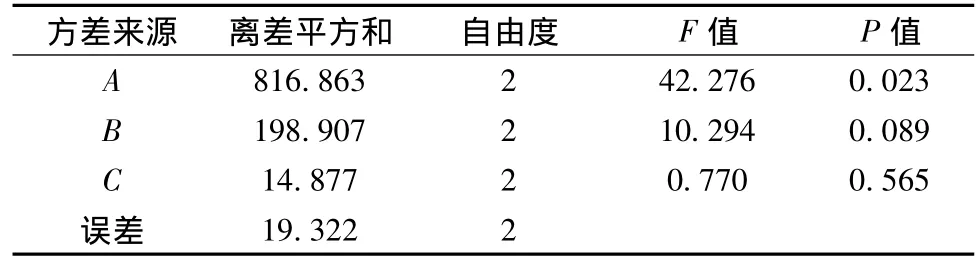
表3 10.0%NH3OH处理原料正交试验方差分析结果Table 3 Analysis of variance for the experimental results of orthogonal array design
表2表明,影响10.0%NH3OH预处理玉米秸秆酶解的各因素主次顺序为A>B>C;表3表明,A因素(即酶量)对玉米秸秆酶解有显著影响(P<0.05),而B、C因素影响较小(P>0.05),因此优选出最佳工艺条件为A3B1C2,即加酶量为35 FPIU/g,底物比为1∶15,酶解时间为84 h。与水,1.0%H2SO4预处理方法相比,酶解液含糖量提高较大,可以作为发酵γ-PGA原料处理的最优处理方法,氨还可以通过回收循环利用,整个过程能耗较低,是一种较有发展前途和应用前景的预处理技术。
2.4 预处理与未处理原料对酶解效果的影响
玉米秸秆处理前和处理后的酶解效果差别较大,见图5。酸氨处理打破了玉米秸秆3种组分的致密结构,解除了木质素对半纤维素和纤维素的包裹,尽可能地降低了纤维素的结晶度[18,20],增加了微生物与酶的可及性,提高利用率。蒸汽爆破法与酸碱连用,在高压状态下,保持一定时间内蒸发掉纤维细胞内的水分,使半纤维素水解,然后瞬间释压,使物料爆破。稀酸处理则可以有效溶解木质素和半纤维素,同时破坏纤维素的结晶结构,使原料疏松。氨处理可以脱除原料中大部分木质素,条件温和,而且可以除去纤维素原料中对发酵不利的乙酰基,但是会损失半纤维素。
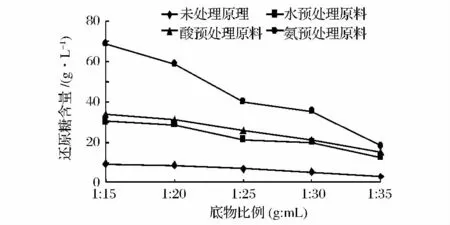
图5 玉米秸秆酶解随底物比例还原糖产量变化Fig 5 Maize straw enzyme reducing reducing sugar yield changes over substrate ratio
由图5可知,经过酸处理的玉米秸秆还原糖产量为33.99 g/L,经氨处理的为68.78 g/L,而未经处理的为9.26 g/L。处理后比处理前的还原糖含量有明显的提高。
2.5 不同预处理方法所得玉米秸秆酶解液对γ-PGA的影响
以玉米秸秆酶解液为碳源,调节pH为5左右,接种量2%,于37℃发酵。原料预处理方式有4种,分别为水预处理、1.0%H2SO4、10.0%NH3OH预处理、未经预处理。发酵效果以γ-PGA含量、残糖量、残谷氨酸量为指标,结果如图6所示。
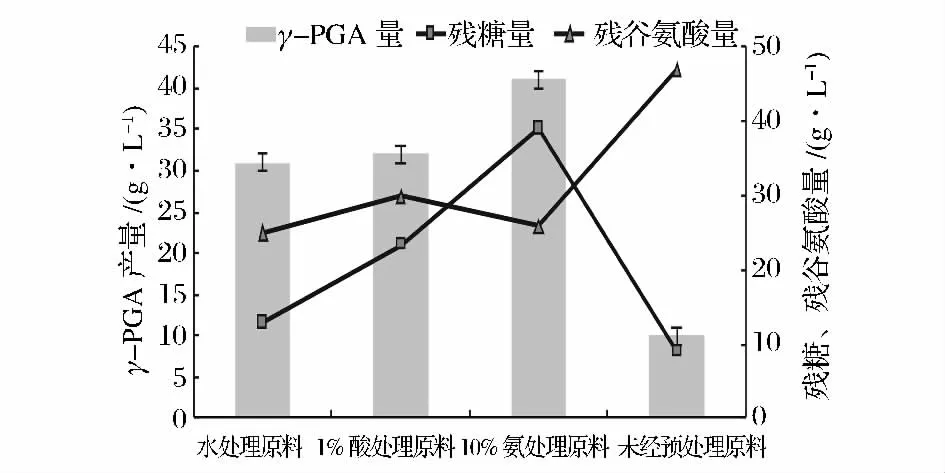
图6 玉米秸秆酶解液发酵产γ-PGAFig.6 Maize straw enzymolysis liquid fermentation to produce γ-PGA
未经预处理的原料直接酶解,其酶解液(还原糖量为23.60 g/L)发酵效果不好,提取物未成团,呈絮状物,发黏,黏壁,产物颜色较深。而经过预处理的酶解液(还原糖量分别为28.78 g/L、34.63 g/L、67.5 g/L)发酵效果较好,提取物均成团。3种原料(水处理原料、10.0%NH3OH处理原料、1.0%H2SO4处理原料)单独对比,10.0%NH3OH处理原料酶解液发酵效果最好,γ-PGA产量为41.00 g/L。
2.6 玉米糖化液与玉米秸秆酶解液混合发酵
2.6.1 混合发酵对γ-PGA的影响
玉米糖化液以10%、20%、30%、40%、50%比例与10.0%NH3OH处理原料玉米秸秆酶解液混合发酵产γ-PGA。玉米秸秆酶解液经过浓缩,脱色处理配制发酵培养基。混合发酵培养基起始还原糖含量为70.08 g/L。发酵后以残糖量、γ-PGA含量为指标分析了对发酵效果的影响(图7)。
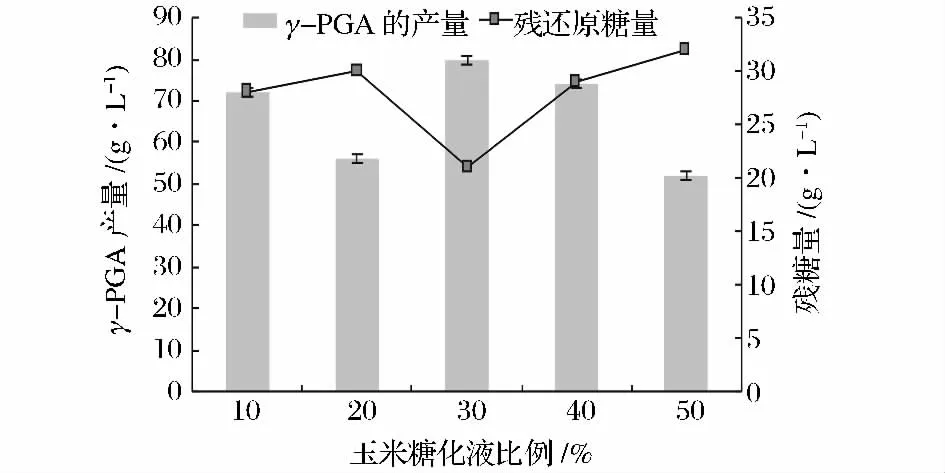
图7 玉米糖化液与玉米秸秆酶解液混合发酵γ-PGAFig.7 Corn saccharification liquid mixed with corn straw enzymolysis liquid fermentation γ-PGA
结果表明,枯草芽胞杆菌利用混合培养基发酵效果较好,产量较高。在玉米糖化液比例为30%时,发酵效果最好,γ-PGA产量为 80.00 g/L,残糖量为21.00 g/L。随着玉米糖化液含量的增加,γ-PGA的产量不是直线上升,反而有所下降。玉米秸秆酶解液与玉米糖化液混合比例为30%作为枯草芽孢杆菌发酵产γ-PGA的最优碳源。混合发酵γ-PGA产量为80.00 g/L,而单独以玉米秸秆酶解液发酵γ-PGA产量最高为41.00 g/L,相比,混合发酵产γ-PGA产量提高了95.12%。为合成γ-PGA提供了适宜的糖量,既保证了γ-PGA合成所需的糖量又不会因糖量过高而抑制γ-PGA的合成。
2.6.2 混合发酵产γ-PGA前后葡萄糖、还原糖、木糖含量的变化
一般来说,碳源对于枯草芽孢杆菌合成γ-PGA的产量有很大的影响,是细胞生长最重要的能量和营养来源。本研究采用的玉米秸秆酶解液与玉米糖化液混合作为培养基中的碳源,其中除了葡萄糖,还有木糖、甘露糖、半乳糖、阿拉伯糖、乙酸及少量糠醛等物质,优于其他单一的碳源,因为它除了含有菌种生长所必需的碳源外还有其他微量元素和生长因子,从而有利于菌种生长或对聚谷氨酸合成酶的活性有所提高,以葡萄糖、木糖、还原糖为指标衡量发酵前后对糖的利用情况(见图8)。其中葡萄糖含量22.00 g/L、还原糖含量66.46 g/L、木糖含量9.10 g/L。
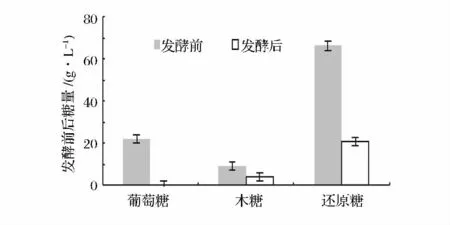
图8 发酵前后葡萄糖、木糖、还原糖含量变化Fig.8 Glucose,xylose,reducing sugar content changes before and after fermentation
由图8可见,通过对发酵前后糖含量的分析,糖量的变化都较为明显,葡萄糖利用率可达到100%,还原糖利用率为68.58%,木糖利用率为53.84%。可以确定部分木糖被利用,实现了戊糖与己糖同时被微生物利用。木糖一般不能为微生物发酵所利用,只能被部分细菌利用,多存在于废弃物中。以价廉易得的木质玉米秸秆纤维为原料来生产γ-PGA,其中主要的糖都可以被充分利用,可以大大的拓展了其生产原料的来源,还明显增加其利用的经济效益和社会效益。
4 结论
玉米秸秆预处理可改变木质素微结构及超分子结构,使纤维素结晶区破坏,提高反应灵活性,降低酶量,得到含糖量较高的酶解液。实验结果表明,玉米秸秆的最佳预处理条件为10.0%NH3OH汽爆处理,固液比1∶10,121℃ 高压水解2 h。NH3OH处理优点较多,NH3OH易挥发,可以进行回收,对环境不易造成污染还可以节省生产成本。酶解最佳条件为当pH为5,酶用量为35 FPIU/g,底物比例为1∶15,时间96 h。通过比较分析玉米秸秆酶解液单独发酵和与玉米糖化液混合发酵对产γ-PGA的影响,结果表明,混合发酵优于玉米酶解液单独发酵,确定了最佳比例为3∶7时,发酵效果最好,γ-PGA 产量可达80.00 g/L,与玉米秸秆酶解液单独发酵相比,混合发酵产γ-PGA产量提高了95.12%。葡萄糖利用率100%,还原糖利用率68.58%,木糖利用率53.84%。
[1] 刘晓鸥,李睿颖,徐勇虎,等.聚谷氨酸的生物合成及应用前景[J].食品工程,2009,9(1):24~27.
[2] 董健,吕颖,方丽等.γ-聚谷氨酸的发酵制备及快速鉴定分析方法研究[J].中国酿造,2012,5(31):140-150
[3] Shih IL,Van YT.The production of poly(γ-glutamic acid)from microorganisms and its various applications[J].Bioresour Techno,2001,79:207-225
[4] 施庆珊.γ-聚谷氨酸的微生物合成与应用[J].精细与专用化学品,2004,12(11):20 ~23.
[5] 鞠蕾,马霞,张佳.γ-聚谷氨酸的发酵及保水性能[J].中国酿造,2011(7):57-61
[6] 杨树峰,楼鹏,李振海,等.据谷氨酸发酵液菌体去除工艺研究[J].食品与发酵科技,2013,49(1):13-16.
[7] 梁金丰,徐虹,姚俊,等.γ-聚谷氨酸提取的发酵液预处理及分离纯化工艺[J].食品与发酵工业,2009,35(3):6-11.
[8] 任尚美,马霞,王海波,等.γ-聚谷氨酸的发酵条件及其初步表征分析[J].中国酿造,2008(19):45~46.
[9] 贺杨扬,梁智群.γ-聚谷氨酸发酵液预处理及提取纯化工艺[D].南宁:广西大学,2013.
[10] 王浩,刘建军.γ-聚谷氨酸高产菌株的选育[D].青岛:山东轻工业学院,2012.
[11] 梁金钟,王风青.微生物发酵法合成高分子聚合物 γ-PGA的研究[J].北京工商大学学报(自然科学版),2011,29(1):1 671-1 513.
[12] 谢光辉,王晓玉,任兰天.中国作物秸秆资源评估研究现状[J].生物工程学报,2010,26(7):855-863
[13] 张美云,张 云,徐永建,等.秸秆高值化利用技术的发展现状与趋势[J].中国造纸,2010,29(11):73-76.
[14] Mizsey P,Racz L.Cleaner production alternatives:biomass utilization options[J].Journal of Cleaner Production,2010,18(7):767-770.
[15] 张霞,李红伟,马晓建.汽爆玉米秸秆悬浮液及酶解液的流变特性[J].可再生能源,2013,10(1):3-6.
[16] 伦晓中,寇巍,赵勇,等.膨化预处理玉米秸秆的还原糖酶解工艺[J].环境工程学报,2013,7(1):317-322.
[17] 王君福,吴丁丁,刘倩倩,等.间苯三酚法测定玉米芯水解液中木糖含量[J].安徽农业科学,2011,39(22):13 542-13 544.
[18] 刘泽君,张金禄.圆红冬孢酵母发酵玉米秸秆水解液产油脂的研究[J].中国油脂,2013,52(2):1 003-7 969.
[19] 武崇辉,寇巍.酸碱处理纯化玉米秸秆纤维素及还原糖酶解实验研究[J].中国生物工程杂志,2013,33(11):86-91.
[20] 田亚红,常丽新.玉米秸秆、玉米芯发酵生产乙醇的研究[J].食品研究与开发,2014,35(3):1 005-6 521.
