明胶-海藻酸钠固定化菊糖果糖转移酶*
2014-12-25杨玎玲杭华黄敏许飞跃付传香江波
杨玎玲,杭华,黄敏,许飞跃,付传香,江波
1(安徽师范大学环境科学与工程学院,安徽芜湖,241003)
2(江南大学食品科学与技术国家重点实验室,江苏无锡,214122)
菊糖果糖转移酶(EC4.2.2.18,Inulin fructotransferase,IFTase)可催化水解菊糖转化为双果糖酐III,(DFA III)。DFA III具有清凉的甜味,甜度为蔗糖的52%,其热值(0.263 kcal/g)为蔗糖的1/15,是近年来发现的一种新型天然功能性甜味剂,具有增进骨骼生长、改善便泌、利于排尿、促进矿物元素和黄酮类物质的吸收、预防结肠癌及抑制蛀牙等生理功能,因而在食品和医药领域中具有广泛的应用前景[1]。DFA III主要采用生物转化法生产。Uchiyama首次从产脲节杆菌中发现菊糖果糖转移酶IFTase(inulin fructotransferase,EC 4.2.2.18);迄今为止,已发现10余种微生物可以产生此酶,有节杆菌属(Arthrobacter sp.)、黄杆菌属(Flavobacterium sp.)、芽孢杆菌属(Bacillus sp.)、赖氏菌属(Leifsonia sp.)等[2]。日本甜菜制糖株式会社采用Arthrobacter sp.H65-7发酵产生IFTase,已工业化生产DFA III。本研究采用金黄节杆菌(Arthrobacter aurescens SK 8.001)产IFTase酶[3],进行固定化的研究。目前,采用海藻酸钠进行的研究有固定化 β-葡萄糖苷酶[4-5]、β-葡萄糖醛酸苷酶[6]等。本研究采用明胶-海藻酸钠进行菊糖果糖转移酶的固定化研究,探究了固定化的最佳工艺条件、固定化酶的酶学性质、操作稳定性及贮存稳定性。
1 材料与方法
1.1 材料与仪器
金黄节杆菌(Arthrobacter aurescens SK 8.001);海藻酸钠、明胶、无水 CaCl2、NaNO3、酵母膏、MgSO4、KH2PO4、FeSO4·7H2O(分析纯),中国国药集团化学试剂有限公司;菊糖,上海谱振生物科技有限公司;双果糖酐III,日本大阪光纯化学工业公司。
恒温培养摇床,上海一恒科学仪器有限公司;紫外可见分光光度计、冷冻离心机、电子天平,上海精密仪器有限公司;pH计,上海三本环保科技有限公司;高效液相色谱,日本岛津公司。
1.2 试验方法
1.2.1 菊糖果糖转移酶的制备
将金黄节杆菌接入200 mL培养基(25 g/L菊糖、3 g/L NaNO3、1 g/L 酵母膏、0.1 g/L MgSO4、0.4 g/L KH2PO4、0.01 g/L FeSO4·7H2O)中,培养 24 h(30 ℃,200 r/min);将培养液离心(8 000 r/min,20 min,4℃),去除菌体,上清液即为粗酶液。上清液超滤除去小分子杂质,浓缩液即为粗酶,0~4℃保藏。
1.2.2 酶的固定化
将海藻酸钠和明胶分别在60℃预先保温溶解,5 mL IFTase酶液(酶活约为300 U/mL)与10 mL海藻酸钠溶液充分混合搅拌,再加入5 mL明胶溶液,混合乳化30~40 min。用注射器混合液滴入CaCl2液中,形成均一光滑的颗粒,0~4℃静置硬化一定时间。将获得颗粒用生理盐水和去离子水洗涤,抽滤干燥即得固定化酶,保存于0~4℃下待用。
1.2.3 酶固定化的条件处理
探究对酶固定化效果影响较大的4个因素,即海藻酸钠浓度、明胶浓度、CaCl2浓度、硬化时间等。采用4因素的组合进行包埋法固定化酶实验,将其与游离酶混匀静置30~40 min,用注射器吸取混合液逐滴滴入在20 g/L的CaCl2溶液中,室温条件下静置固定2 h,抽滤干燥,讨论固定化酶的最适条件及其酶学性质。
1.2.4 酶活力测定方法[7]
菊糖果糖转移酶酶活测定方法[6]。
反应体系(1 mL):0.5 mL 10%的菊糖溶液,0.45 mL 0.1 mol/L柠檬酸钠缓冲液(pH 5.5),0.05 mL酶液;充分混合后,60℃ 反应10 min,100℃ 5 min灭酶活,10 000 r/min 10 min,取上清液检测。
HPLC检测条件:糖柱(Waters Sugur-PakTM1,6.5 mm×300 mm);流动相,超纯水;示差折光检测器(Shodex RI101);柱温,80℃;流速,0.4 mL/min;进样量,10 μL。
酶活力单位定义:在上述检测条件下,每分钟生成1 μmol DFAIII所需要的酶量定义为1个酶活单位(即1U)。
酶活回收率:固定化酶活力与游离酶总活力的百分比。
1.2.5 酶蛋白质包埋率的测定[8]
分别检测包埋固定化中加入的游离酶总活性与固定化后上清液的酶活,计算酶蛋白包埋率:

1.2.6 实验数据处理
本研究中,实验重复数均为3次,计算平均值,实验数值以平均值表示。实验重复数值的误差以误差棒表示。采用Origin 7.5软件(美国OriginLab中国分公司,中国广州)进行统计分析。
2 结果与分析
2.1 菊糖水解产物-DFA III
依据1.2.4的方法,IFTase催化水解菊糖,主要产物为DFA III以及少量的低聚果糖,见图1。图1(A)为菊糖液相图,本研究采用菊糖为进口品,纯度高于90%且其聚合度较高;菊糖多为混合品,然而其HPLC(糖柱)图为单峰图。由图1(B)可以看出,未反应菊糖出峰时间为6.394 min,低聚果糖(蔗果四糖、蔗果三糖、蔗果二塘)分别对应出峰时间为7.197 min、7.643 min及8.372 min,DFA III出峰时间为9.748 min。菊糖转化率(生成DFA III)能达到80%。

图1 菊糖及其水解产物的HPLC图谱Fig.1 HPLC scheme of inulin and its hydrolysis products
2.2 固定化最适条件的优化确定
2.1.1 明胶、海藻酸钠浓度的确定
采用不同浓度的海藻酸钠溶液和明胶溶液组合,按照1.2.3进行实验,检测并计算酶蛋白的包埋率,实验结果如表1所示。当明胶浓度为20 g/L与海藻酸钠浓度为20 g/L时,酶蛋白包埋率最高且达到96.4%,颗粒均匀且强度适中。产生此现象的原因可能是包埋载体浓度偏低时凝胶颗粒结构松散,结构不稳定且机械强度较低,酶蛋白易流失;包埋载体浓度偏高时,溶液黏度过高且混匀不充分,造成酶蛋白包埋率偏低,不易操作,推压注射器困难,固定化酶颗粒形状不规则,影响固定化酶结构,导致催化效率偏低。
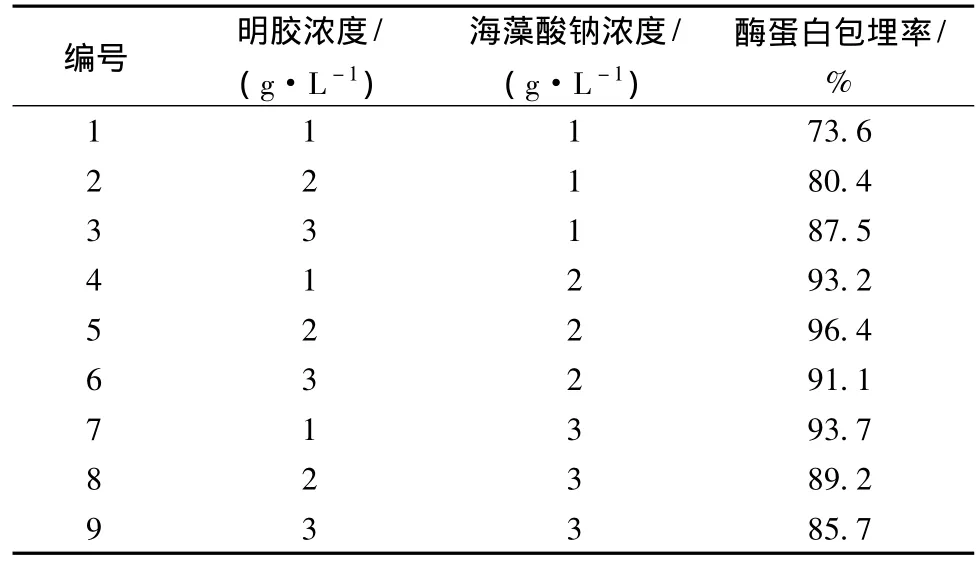
表1 明胶与海藻酸钠浓度和酶蛋白包埋率的关系Table 1 Relationships of enzyme protein encapsulation rate and gelatin and sodium alginate concentrations
2.1.2 CaCl2浓度的确定
保持海藻酸钠溶液与明胶溶液浓度分别为20 g/L,分别选取浓度为 1、20、30、40、50、60 g/L 的 CaCl2溶液进行酶固定化处理,在0~4℃下固定2 h,抽滤干燥,测定固定化酶活回收率,结果如图2所示。固定化酶活回收率随着CaCl2浓度的增加而快速增加,当CaCl2浓度达到40 g/L时,固定化酶活回收率最高;当CaCl2浓度超过40 g/L时,固定化酶活回收率呈下降趋势。原因可能是CaCl2浓度偏低,凝胶交联度不够,酶易流失;CaCl2浓度过高,促使颗粒空间网状结构过于紧密,影响酶的空间结构,抑制酶与底物的结合以及产物的释放。因此,确定CaCl2的最佳浓度为40 g/L。

图2 CaCl2浓度与固定化酶活回收率的关系Fig.2 Relationships of CaCl2concentration and the recovery rate of immobilized enzyme
2.1.3 固定化酶量的确定
分别取简易浓缩酶液(酶活约为300 U/mL)3、4、5、6 mL,均匀混合于明胶浓度2%与海藻酸钠浓度2%的混合液,用注射器吸取混合液逐滴滴入40 g/L的CaCl2溶液,进行固定化酶处理,在0~4℃下固定2 h,抽滤干燥,收集固定化酶颗粒,测定固定化酶活回收率,结果如图3所示。固定化酶量为5 mL时测定的相对酶活最高,因此,选择5 mL固定化酶量进行后续的研究。
2.1.4 固定化时间的确定
依据上述实验方法获得固定化酶颗粒后,将其置于0~4℃下静置硬化不同时间,将所得固定化颗粒洗涤、干燥后测定酶活,并以最大酶活为100% 计算相对酶活,结果如图4所示。固定化颗粒的相对酶活随着硬化时间的增加而增加,固定化6 h相对酶活达到最大值;随着固化时间增加,固定化颗粒的相对酶活下降。原因可能是固化时间短,Ca2+未能将固定化颗粒中的Na+完全置换出来,交联度不够,机械强度弱,导致酶蛋白流失;固化时间长,包埋酶越牢固,抑制酶与底物结合及产物释放。

图3 固定化酶量与固定化酶活的关系Fig.3 Relationships of immobilized enzyme activities and protein weights of immobilized enzyme

图4 固化时间与相对酶活的关系Fig.4 Relationships of relative enzyme activities and the fixed times
2.2 正交试验
在上述实验的基础上,设计4因素3水平的正交实验,A因素依据表1设定,主要考察指标为相对酶活,结果如表2所示。

表2 固定化条件的正交实验Table 2 The orthogonal experiment of immobilized conditions
影响酶活的因素依次为C>B>A>D;相对酶活最高的组合为A2B2C3D1,根据2.1.4的结果,固定化时间5~7 h相对酶活变化不大,因此,正交实验结果选用A2B2C3D1。最佳固定化条件为:海藻酸钠浓度为2%,明胶浓度为2%,CaCl2浓度为4%,包埋酶量为5 mL,固定化时间为5 h。
2.3 固定化酶的酶学性质
2.3.1 固定化酶的最适温度
在上述最适固定化酶操作条件下,海藻酸钠溶液与明胶溶液的浓度均为20 g/L、CaCl2浓度为40 g/L、静置硬化6 h,取适量游离酶和固定化酶,分别在40~80℃下反应,测定并计算固定化酶和游离酶的相对酶活,结果如图5所示。游离酶的最适反应温度为60℃,而固定化酶的最适反应温度为65~70℃,固定化酶的耐热性高于游离酶,这也体现了固定化酶的优势所在,更适合工业化应用。
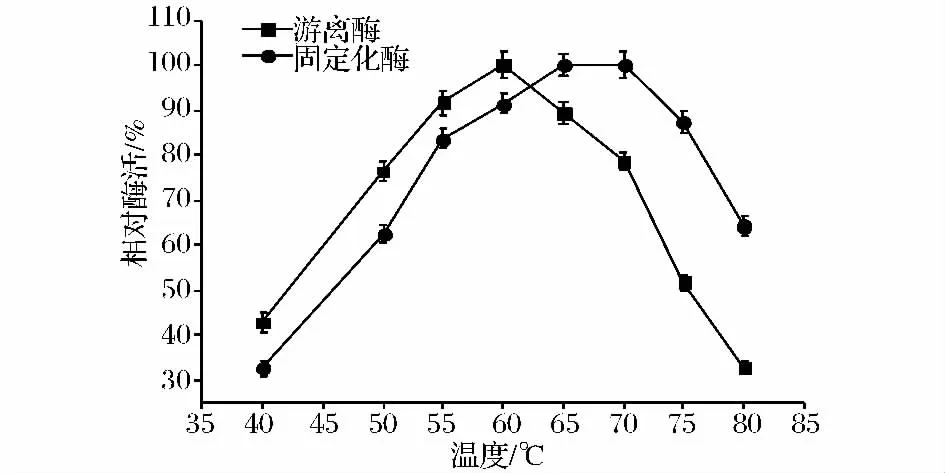
图5 温度对游离酶和固定化酶相对酶活的影响Fig.5 Effects of temperature on the relative enzyme activities of free enzyme and immobilized enzyme
2.3.2 固定化酶的最适pH值
取适量的游离酶和固定化酶,分别在pH 4.0~8.0的范围内,进行酶促反应,分别测定游离酶与固定化酶的相对酶活,结果如图6所示。游离酶的最适pH值为5.5,而固定化酶的最适pH值为5.5~6.0,固定化酶的曲线较游离酶曲线平缓,固定化酶具有较好的耐碱性,因而其比游离酶具有较好的适应性。
2.3.3 固定化酶和游离酶的热稳定性比较
采用上述的最佳反应条件,取适量的游离酶和固定化酶,在20~80℃,每增加10℃并处理2 h后测定其残余酶活力,结果如图7所示。与图5随温度变化趋势不同,原因是前者为随着温度逐渐升高,检测温度对酶催化反应的酶活力影响,确定酶与固定化酶的最适反应温度及酶失活温度;而后者是酶与固定化酶经不同温度处理后,检测相对酶活力的变化,确定酶与固定化酶的稳定性的差异。由图7可知,在20~50℃热处理2 h后,固定化酶活力与游离酶的酶活力都有所下降,但变化幅度不大,当温度高于65℃后,固定化酶的酶活损失较游离酶酶活损失较小,可见酶蛋白被固定化后耐热性有所提高,分析可能是固定化后形成的凝胶结构对酶起到保护作用。
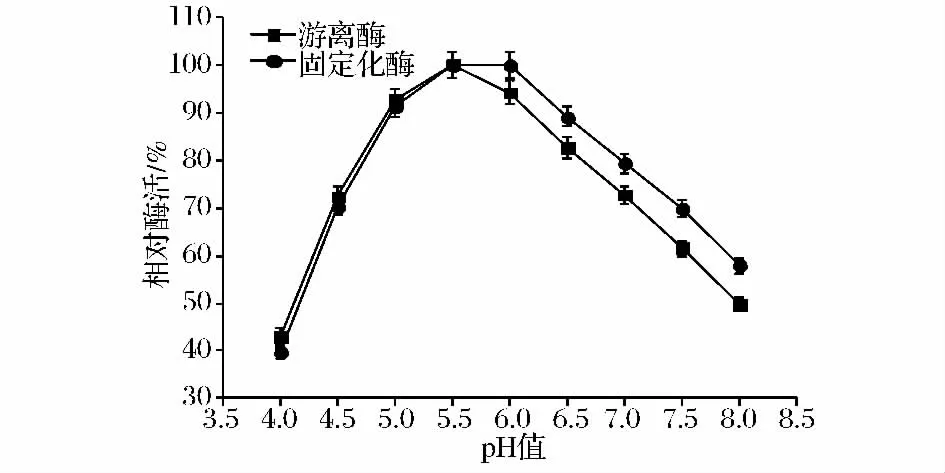
图6 pH值对游离酶和固定化酶相对活力的影响Fig.6 Effects of pH on the relative enzyme activities of free enzyme and immobilized enzyme

图7 固定化酶和游离酶的热稳定性比较Fig.7 Comparisons of thermal stabilities of free enzyme and immobilized enzyme
2.3.4 固定化酶的操作稳定性
取适量的固定化酶,在相同反应条件下连续进行8批次操作,并测定其相对酶活,并以第1批次相对酶活为100%,计算其他批次操作的相对酶活,结果如图8所示。连续操作8次后,残余酶活仍在50%以上,说明固定化酶有较好的操作稳定性。
2.3.5 固定化酶的贮藏稳定性
在4℃冰箱中,游离酶贮藏60天后,其相对酶活几乎为0。由图9可知,固定化酶贮存60天后,固定化酶保存50%以上的相对酶活,说明固定化酶有较好的贮存稳定性。
3 结论

图8 固定化酶的操作稳定性Fig.8 Operational stability of immobilized enzyme

图9 固定化酶的贮藏稳定性Fig.9 Storage stability of immobilized enzyme
以海藻酸钠和明胶为载体,对菊糖果糖转移酶进行固定化,研究得出制备固定化酶的最优条件:20 g/L海藻酸钠、20 g/L明胶、40 g/L CaCl2、固定化时间5 h,在该条件下具有较好的操作稳定性,重复操作8次后相对酶活保留50%以上。与游离酶相比,固定化酶的最适反应pH值增加了0.5,反应温度分别提高了5~10℃,具有良好的操作稳定性。该方法成本较低,操作简单,操作稳定性好,适用性广,具有良好的应用前景。目前,固定化菊糖果糖转移酶进行初步研究,将其应用于工业化生产,还需进一步进行研究,如对固定化酶动力学研究及固定化酶反应器的研究等。
[1] Katsuichi S,Fusao T.Difructos anhydrides:their massproduction and physiological functions[J].Bioscience Biotechnology and Biochemisty,2000,64(7):1 321-1 327.
[2] HANG H,MU W,JIANG B,et al.Recent advances on biological difructose anhydride III production using inulase II from inulin[J].Applied Microbiology and Biotechnology,2011,92(3):457-465.
[3] 卢峥嵘,赵萌,沐万孟,等.发酵产菊糖果糖转移酶的培养基设计及菌体生长动力学研究[J].食品与发酵工业,2009,35(9):19-24.
[4] 王瑾,李默馨,李红玲,等.壳聚糖-海藻酸钠固定化β-葡萄糖苷酶的研究[J].食品工业科技,2009,30(3):164-167.
[5] 赵亚南,张卫明,钱骅,等.海藻酸钠-壳聚糖-海藻酸钠微胶囊二步法固定化β-葡萄糖苷酶的制备[J].食品工业科技,2012,33(6):253-257.
[6] 张斌,孙倩,任延鹏,等.海藻酸钠固定化β-葡萄糖醛酸苷酶的研究[J].中国食品添加剂,2011(1):110-115.
[7] Park Jeong-Bok,Choi Yong-Jin.Purification and characterization of Inulin Fructotransferase(Depolymerizing)from Arthrobacter sp.A-6[J].Journal of Microbiology and Biotechnology,1996,6(6):402-406.
[8] 丁丽俐,翁屹,张阳荣,等.氨基末端磁性载体固定化中性蛋白酶的研究[J].生物化学与生物物理进展,2001,28(5):691-694.
