CD80/CD86在Graves病动物模型中的表达及意义*
2014-12-25华中科技大学同济医学院附属同济医院儿科武汉
华中科技大学同济医学院附属同济医院儿科(武汉)
叶 枫 马晓丹△ 高 雷△ 徐 利△ 侯 鹏△ 吴晓燕△ 伍丽萍△ 施秉银△
GD是B细胞介导、T细胞依赖的自身免疫性疾病,其发病机制主要是针对TSHR的自身抗体TSAbs模拟TSH作用,与TSH受体结合,引起甲状腺肿大、甲状腺激素释放增加,最终引发临床甲亢。而甲状腺细胞合成的各种免疫相关因子维持甲状腺内的自身免疫过程[1]。CD80/CD86主要表达于活化的APC细胞、巨噬细胞和B细胞,与配体CD28/CTLA-4结合,为T细胞活化提供第2信号;诱导T细胞向Th1/Th2分化;参与B细胞增殖活化的调节,在自身免疫性疾病的发生发展中起着重要作用[2]。本研究主要是通过Graves病动物模型探讨CD80/CD86在各组织的表达及可能的意义。
材料与方法
1 重组腺病毒的构建 经连接、转化、筛选得到的重组质粒pDC316-TSHR289,与重组腺病毒骨架质粒pBHGloxdel E13cre共转染293细胞,出现噬斑后冻溶细胞3次,收集上清,经鉴定正确后接种293细胞进行大量扩增。
2 动物实验 将23只6~8周龄SPF级雌性BALB/c小鼠随机分为两组:对照组(7只),甲亢组(16只)。饲养于西安交通大学医学院动物实验中心SPF级动物房,两组小鼠分别于第1、21天经股四头肌注射50μl包含有1×109颗粒的 Ad-Lacz(对照组)、Ad-TSHR289(甲亢组)的PBS诱导甲亢。所有小鼠于第2次免疫后两周摘除眼球采血,脱臼处死。然后固定,剪毛,常规消毒颈部、腹部皮肤,显微镜下逐层剪开皮肤、肌肉组织,取一侧甲状腺置于2ml的无菌、无RNA酶的冻存管,放入液氮罐中保存,另一侧甲状腺置于4%多聚甲醛中固定,用于组织学观察。打开胸腔、腹腔,取心脏、胸腺、脾脏、肝脏置于2ml的无菌、无RNA酶的冻存管,放入液氮罐中保存。
3 小鼠血清TRAb、TT4测定 以放射免疫法进行测定。
4 甲状腺组织病理学检查 小鼠处死后,分离甲状腺,4%甲醛固定,石蜡包埋切片,HE染色,光镜下观察。
5 实时定量PCR实验 提取总RNA,逆转录为cDNA,取八连管,做好标记,加入反应体系:蒸馏水6μl,SYBR Green Realtime PCR Master Mix 10μl,引物2μl(CD80上游引物:GGCAAGGCAGCAATACCTTA,下 游 引 物:CTCTTTGTGCTGCTGATTCG;CD86上游引物:TCTCCACGGAAACAGCATCT,下游 引 物:CTTACGGAAGCACCCATGAT),cDNA 2μl总量20μl;反应条件:PCR扩增条件为:预变性95℃10s,变性95℃5s,复性55℃15s,延伸72℃15s,40个循环。基因表达量通过计算2-△△(Ct)得出结果。在进行实时定量PCR反应时,均设置阴性对照(即不含任何cDNA模板,但具有所有反应试剂的PCR反应体系)。琼脂糖凝胶电泳进行参物鉴定。
6 CD86免疫组化及评分标准
6.1 免疫组化 甲状腺组织标本经脱蜡、水化、抗原修复、3%过氧化氢室温15min消除内源性过氧化物酶;山羊血清37℃封闭20min后,滴加一抗(1∶200稀释)。4℃冰箱过夜。过夜后复温40min至1h。PBS缓冲液冲洗3次,每次5min;滴加生物素化二抗,37℃孵育30min,PBS缓冲液冲洗3次,每次5min;滴加辣根酶标记链霉卵白素工作液,DAB显色,苏木素复染,脱水,透明,中性树胶封片;显微镜下观察、分析。
6.2 评分标准 每个组织块评分由两部分组成:总分=阳性面积+强度。阳性面积评分标准:0分,阳性滤泡个数/总滤泡个数<25%;1分,25%≤阳性滤泡个数/总滤泡个数<50%;2分,50%≤阳性滤泡个数/总滤泡个数<75%;3分,阳性滤泡个数/总滤泡个数≥75%。强度评分标准(选择阳性率最高的滤泡):0分,阳性滤泡上皮细胞个数/总滤泡上皮细胞个数<25%;1分,25%≤阳性滤泡上皮细胞个数/总滤泡上皮细胞个数<50%;2分,50%阳性滤泡上皮细胞个数/总滤泡上皮细胞个数<75%;3分,阳性滤泡上皮细胞个数/总滤泡上皮细胞个数≥75%。总分:0~1,低表达或不表达;2~4,较强表达;5~6强表达。
7 统计学处理 本组应用SPSS13.0统计软件包,组间比较采用独立样本t检验;以P<0.05为有显著性差异,P<0.01为有极显著性差异。
结 果
1 血清T4结果 以对照组小鼠血清T4的作为正常上下限(24.92~104.9ng/ml),超过正常上限视为甲亢(见图1)。
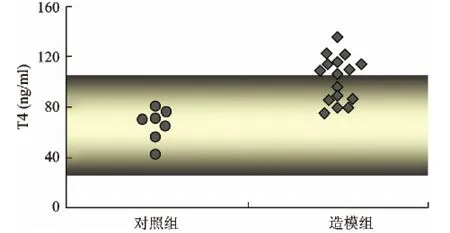
图1 对照组(Ad-LacZ)和造模组(Ad-TSHR289)小鼠血清T4水平 阴影部分代表对照组小鼠血清T4的,血清T4水平高于上限的小鼠视为甲亢鼠(甲亢组)
2 CD80/CD86在甲状腺组织中的表达 既往的研究由于受到药物干预以及环境因素等的影响,关于CD80/CD86在甲状腺组织的表达尚无统一结论,我们首先检测了CD80/CD86在甲状腺组织mRNA水平的表达(见图2A),我们发现:CD86mRNA水平表达在造模组以及甲亢组均明显增高(P<0.05),而CD80mRNA水平的表达在各组间无显著性差异(P>0.05)。造模组及对照组均有4只小鼠低表达或不表达CD86;造模组有9只小鼠而对照组仅有3只小鼠较强表达CD86;造模组有3只小鼠高表达CD86(见图2B)。造模组CD86的表达相对于对照组明显升高(P<0.05),甲状腺滤泡上皮细胞CD86也有较强表达(见图2C)。
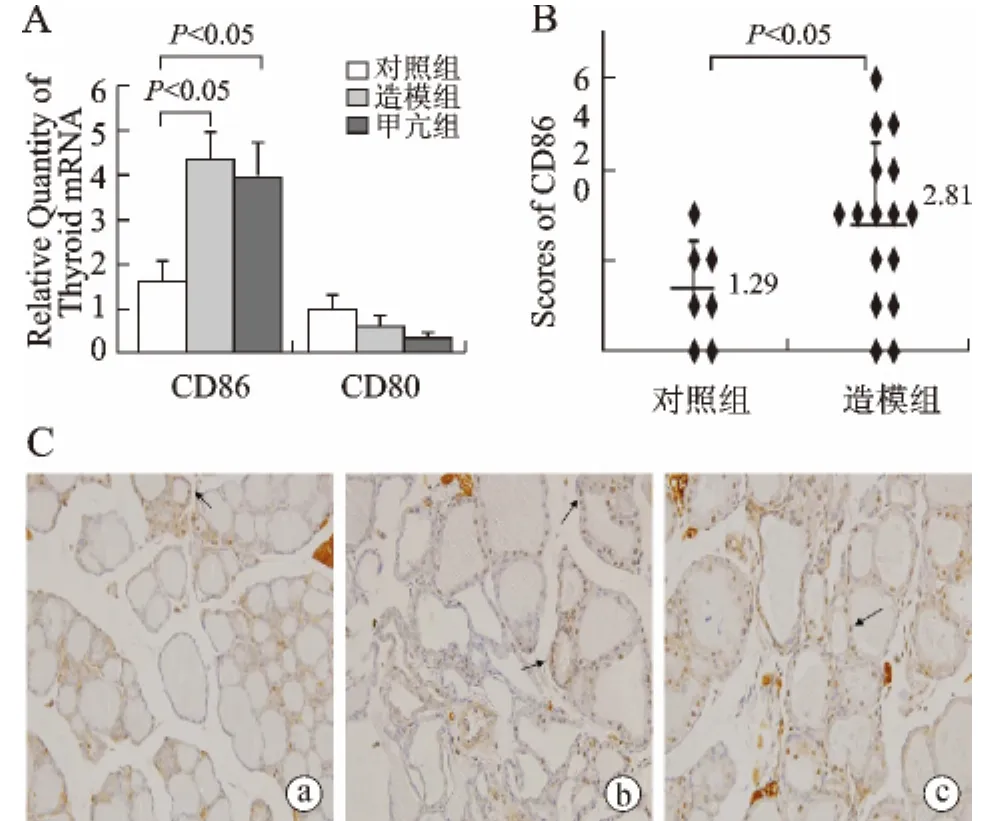
图2 对照组、造模组和甲亢组小鼠甲状腺组织CD80/CD86mRNA以及蛋白水平的表达 阳性染色如箭头所示:a~c为CD86(×400);a,低表达;b,较强表达;c,强表达
3 CD80/CD86在其它组织中的表达 见图3。与对照组相比,造模组及甲亢组CD86在肝脏组织的表达明显增高(P<0.05),而在心脏组织、胸腺组织、脾脏组织的表达无明显差异(P>0.05),CD80在各组织的表达无显著性差异(P>0.05)。

图3 对照组、造模组和甲亢组小鼠不同组织CD80/CD86 mRNA水平的表达
讨 论
B7是分子量为44~54KDa的I型跨膜糖蛋白,属于丁酰苯受体家族,目前研究较多的是CD80和CD86。CD80、CD86主要表达于活化的APC细胞、巨噬细胞和B细胞,两者结构上都有IgV和IgC区,具有25%的同源序列,配体均为CD28/CTLA-4,且都通过与配体结合为T细胞活化提供第二信号,但两者无论是在结构上还是功能上均存在一些区别[3,4]。①相对于CD86,CD80与配体的结合能力较强,它与CTLA-4、CD28结合的平衡解离常数(Kd)分别为0.2μM、4μM,而CD86大约弱5~10倍,其 Kd值分别为2.6μM、20μM;②两者与配体结合的倾向性不一样,CD80主要与CTLA-4结合,下调T细胞自身免疫反应,在同种异体移植诱导免疫耐受中起着重要作用,而CD86更倾向与CD28结合,介导T细胞活化;③表达时间不一致,虽然CD80与CTLA-4不是组成性地表达,但都是在细胞活化后若干天上调,CD80可稳定表达4~5d,而CD86与CD28组成性地表达,在APC活化后迅速上调,48h达高峰;④ Th1/Th2分化,CD80和CD86参与诱导T细胞向Th1/Th2分化,CD80更倾向于诱导T细胞向Th1分化,而CD86促进IL-4的产生,诱导T细胞向Th2分化,抑制体内CD80表达会加重自身免疫反应,而抑制体内CD86表达会减弱自身免疫反应。例如:在1型糖尿病小鼠体内注射抗CD80抗体可加重病情发展,而注射抗CD86抗体可阻止该病的发生。⑤介导B细胞作用,CD80、CD86在介导B细胞信号传导中扮演着不同的角色。CD86促进B细胞增殖活化,增加IgG1、IgG2a以及IgE的产生,上调抗-凋亡分子的表达,而CD80作用相反。因此,尽管CD80和CD86分子结构同源,而且有着共同的配体,但两者在免疫反应中的作用不同,导致T和B细胞向不同的方向发展。
B7-CD28/CTLA-4体内的双向调节作用,决定了其在自身免疫性疾病中的重要性。大量研究发现:B7-CD28/CTLA-4共刺激因子功能异常在自身免疫性疾病的发生、发展以及病生机制中起着重要作用。在自身免疫性疾病,如:MS、RA、银屑病以及SLE等患者体内均发现CD80或CD86的高表达,本研究发现:Ad-TSHR289干预组小鼠甲状腺组织CD86的表达相对于对照组明显增高。CD86是体内重要的共刺激因子,高表达于活化的T细胞、树突状细胞,在自身免疫性疾病的早期阶段起着重要作用,CD86的高表达可能参与了甲亢的发病机制。因此,我们对比了甲亢鼠与对照鼠甲状腺组织CD86的表达,我们发现甲亢鼠甲状腺组织CD86表达明显增高,并且血清T4水平与甲状腺组织CD86的表达有正相关趋势,这进一步表明:CD86在甲亢发病机制中的重要性。值得注意的是:在我们的研究中,我们仅发现CD86明显增高,并未发现CD80的增高,这可能与它们在介导辅助性T细胞向Th1和Th2分化中起着不同的作用有关。Th1和Th2型辅助性T细胞之间的平衡破坏是GD发病机制中一个很重要的因素。以前也有研究发现甲亢患者体内CD86明显增高并认为CD86在促使甲状腺组织辅助性T细胞向Th2分化中起着重要作用[5],但关于甲亢到底是Th1还是Th2介导为主的疾病的争论由来已久,我们的研究在一定程度上更支持甲亢是Th2介导为主的自身免疫性疾病。另外,Marek[6]等通过体内外研究发现:T3以及L-T4可增加CD86+DCs细胞比例,而对CD80+DCs细胞无影响,进一步表明CD86而不是CD80与GD密切相关。
既往研究发现:CD86在急性肝功能衰竭的肝脏组织的多种细胞中的表达明显升高,而且CD86在大面积肝坏死以及肝脏炎性侵润之前就增高了,意味着它们在肝组织损伤前就已经起到了重要的作用,是肝损伤的潜在危险因素[7]。本研究也发现:甲亢组小鼠肝脏组织的CD86表达相对于对照组明显增高。因此我们认为:甲亢组小鼠肝脏组织的CD86的明显增高可能是甲亢肝损的潜在危险因素,当然这还需要后续实验进一步证实。
总之,我们的研究发现造模组和甲亢组小鼠甲状腺组织高表达CD86,认为CD86可能参与了GD的发病机制。同时肝脏组织的CD86的上调可能是甲亢引起肝脏损伤的潜在危险因素。
[1] Brent GA.Graves'disease[J].New England Journal of Medicine,2008,359(13):2594-2605.
[2] Podojil J R,Miller SD.Targeting the B7family of costimulatory molecules:successes and challenges[J].Bio Drugs,2013,27(1):1-13.
[3] Bhatia S,Edidin M,Almo SC,etal.B7-1 and B7-2:similar costimulatory ligands with different biochemical[J].oligomeric and signaling properties,Immunology Letters,2006,104(1):70-75.
[4] Lim TS,Goh JK,Mortellaro A,etal.CD80and CD86differentially regulate mechanical interactions of T-cells with antigen-presenting dendritic cells and B-cells[J].P Los One,7(9):1-8.
[5] Inukai Y,Momobayashi A,Sugawara N,etal.Changes in expression of T-helper(Th)1-and Th2-associated chemokine receptors on peripheral blood lymphocytes and plasma concentrations of their ligands,interferon-inducible protein-10 and thymus and activation-regulated chemokine,after antithyroid drug administration in hyperthyroid patients with Graves'disease[J].European Journal of Endocrinology,2007,156(6):623-630.
[6] Dedecjus M,Stasiolek M,Brzezinski J,etal.Thyroid hormones influence human dendritic cells'phenotype function,and subsets distribution[J].Thyroid,2011,21(5):533-540.
[7] Leifeld L,Trautwein C,Dumoulin FL,etal.Enhanced expression of CD80(B7-1),CD86(B7-2),and CD40and their ligands CD28and CD154in fulminant hepatic failure[J].American Journal of Pathology ,154(6):1711-1720.
