癌蛋白PRC17与人肌球蛋白调节轻链相互作用的初步鉴定
2014-12-25何泽陈洋张永臣万青赵虎子赵蕾沈传陆
何泽,陈洋,张永臣,万青,赵虎子,赵蕾,沈传陆
(1.东南大学医学院病理学与病理生理学系,江苏南京 210009;2.东南大学生命科学研究院,江苏南京 210009)
PRC17即前列腺癌基因17,也称TBC1D3,是人类特有的基因,该基因在15%的前列腺癌中高扩增,并且在50%转移性前列腺癌中过表达。因为PRC17促进细胞增殖并且能使NIH3T3细胞恶性转化而被鉴定为癌基因[1]。最近的研究发现,PRC17能够延迟表皮生长因子受体(EGFR)和胰岛素受体底物-1(IRS-1)的降解,增强和延长信号活性来促进细胞增殖。PRC17能抑制EGFR对C-卡西塔斯B细胞淋巴瘤蛋白(c-Cbl)的募集,减少EGFR的多泛素化,从而延迟EGFR降解[2]。PRC17对胰岛素信号的调节通过激活蛋白磷酸酶2(PP2A)途径完成。激活的PP2A通过抑制核糖体蛋白S6激酶活性,而下调IRS-1上能够被Cul7泛素连接酶识别的磷酸化位点,最终延迟IRS-1的降解[3]。另外,PRC17能与 ADP核糖基化因子6(Arf6)一起同时结合高尔基关联的含γ衔接蛋白耳的ARF结合蛋白3(GGA3),一起协作促进细胞的巨胞饮内吞[4]。
为了进一步研究PRC17的功能,我们尝试寻找新的与PRC17结合的蛋白。前期的实验工作证明MLC2能够与转染重组转化因子(Tre17)结合[5],而Tre17与PRC17具有相似的TBC结构域,并且PRC17与Tre17氨基端的序列达到了89%的一致性[6],推测PRC17与MLC2很可能相互作用。鉴定PRC17与MLC2之间的相互作用将为进一步研究PRC17及MLC2的功能奠定基础。
1 材料与方法
1.1 材料
1.1.1 细胞株 SMMC-7721细胞为作者所在实验室保存。
1.1.2 菌株和质粒 菌种E.coli DH 5a和BL21、原核表达载体质粒pGEX-6P-1、真核表达载体pcDNA-3.0-HA为作者所在实验室保藏。重组载体pcDNAHA-PRC17、pcDNA-HA-PRC17(353)和 pcDNA-HAPRC17(251)由作者所在实验室以前成功构建并保存,分别用于SMMC7721细胞表达PRC17、PRC17氨基末端的353和251个氨基酸片段。pcDNA-HA-PRC17(164)和pcDNA-HA-PRC17(Δ164)为本次构建,分别用于细胞表达PRC17氨基端的164个氨基酸或氨基端164个氨基酸缺失的PRC17突变体。
1.1.3 试剂与抗体 限制性内切酶(Bam HⅠ、Eco RⅠ等)、T4DNA连接酶、PrimeSTARTMHS DNA聚合酶购自大连TaKaRa生物有限公司,DNA分子质量标准购自金斯瑞生物科技有限公司,蛋白分子质量标准购自Fermentas公司,凝胶回收试剂盒和质粒小量提取试剂盒购自Axygen公司,抗生素、异丙基β-D-硫代半乳糖苷(IPTG)购自南京鼎国生物工程公司,Glutathione Sepharose 4B购自GE Healthcare公司,抗-GST抗体购自Cell Signal公司,抗-HA抗体和HRP(辣根过氧化物酶)标记的羊抗鼠IgG、羊抗兔IgG购自Santa Cruz公司,化学发光(ECL)试剂盒购自Thermo SIENTIFIC公司,转染试剂 LipoD293TMReagent购自 SignaGen公司。
1.2 方法
1.2.1 细胞培养 SMMC-7721细胞用含10%小牛血清、2 mmol·L-1谷氨酰胺、100 U·L-1青霉素和100μg·L-1链霉素的DMEM(高糖)培养基,于体积分数5%的CO2中37℃培养。
1.2.2 PCR扩增 根据PRC17基因全长cDNA序列(GeneID:729873),以pcDNA-HA-PRC17为模板,设计扩增 PRC17(164)和 PRC17(Δ164)的引物:PRC17(164)上游引物ATGTTCCAGATTACGCTTCTA,PRC17(164)下游引物 CTGAATTCCGTATCGATCCCTG,PRC17(Δ164)上游引物TAGGATCCACCACCATGACC AAGCAGCGGGAAC,PRC17(Δ164)下游引物 CTGGCA ACTAGAAGGCACAGTCGAGGCTGATCA。扩增条件:预变性94℃ 2 min;变性98℃ 10 s,退火55℃ 10 s,延伸72℃ 1 min,35个循环;总延伸72℃ 7 min。
1.2.3 PRC17突变体表达载体的构建 PCR扩增的PCR产物PRC17(164)和PRC17(Δ164)经1.2%琼脂糖凝胶电泳,然后通过凝胶回收试剂盒回收,PRC17(164)、PRC17(Δ164)和载体pcDNA-HA分别经过相应的双酶切后用凝胶回收试剂盒回收,然后载体与目的DNA片段按照1∶3的比例混合,用T4DNA连接酶连接。将连接产物转化E.coli DH 5a感受态细胞后,置于摇床,37℃、250 r·min-1振荡培养1 h,涂布于含100μg·min-1氨苄青霉素的LB培养板,37℃过夜培养。挑取单菌落培养并抽提质粒DNA,酶切鉴定正确后对阳性克隆进行测序鉴定。
1.2.4 GST融合蛋白的原核表达和纯化 GSTMLC2融合蛋白的原核表达和纯化主要见参考文献[7-9]。即挑取表达GST-MLC2的单菌落于氨苄青霉素抗性的LB液体培养基37℃ 振荡培养过夜。次日,按照1∶100比例转接种于10 ml氨苄青霉素LB培养基中,37℃振荡培养至培养基OD600nm为0.6~0.8之间,用 0.1 mmol·L-1的 IPTG,在 30 ℃、200 r·min-1条件下振荡培养诱导6 h。经过裂解液及超声处理,离心后通过 Glutathione Sepharose 4B吸附上清液中的GST融合蛋白,裂解液清洗3遍并离心弃上清获得纯化蛋白。SDS-PAGE电泳及考马斯亮蓝染色,拍照后通过灰度分析确定目的蛋白的纯度。
1.2.5 GST沉淀实验分析 在每35 mm皿中接种3×105SMMC-7721细胞培养20 h,pcDNA-HA-PRC17、pcDNA-HA-PRC17(353)、pcDNA-HA-PRC17(251)、pcDNA-HA-PRC17(164)和 pcDNA-HA-PRC17(Δ164)被分别转染到SMMC-7721细胞,24 h后将细胞于冰上,PBS洗2遍后每皿加150μl裂解液(20 mmol·L-1Tris-Cl,pH 7.5,0.5%Triton X-100,150 mmol·L-1氯化钠,1 mmol·L-1乙二胺四乙酸,10 mmol·L-1氟化钠,1 mmol·L-1正钒酸钠,1 mmol·L-1PMSF,5μg·ml-1抑肽素,5 μg·ml-1亮抑酶肽,2 μg·ml-1抑蛋白酶肽)裂解10 min。4℃、12 000 r·min-1离心20 min得上清液,留取上清液的1/10作为全细胞裂解物(WCL),剩下的裂解物上清分别与5μg纯化的GST-MLC2树脂混合,4℃旋转混匀4 h,GST则作为阴性对照。然后裂解液洗3遍后,离心弃上清,沉淀用1倍的样品缓冲液重悬后于沸水中煮5 min,样品通过蛋白质印迹法检测分析。
1.2.6 蛋白质印迹法检测 蛋白样品通过SDSPAGE电泳分离后,用250 mA恒流转PVDF膜1 h,然后PVDF膜用含2%BSA的TBST室温封闭1 h,加一抗抗体4℃过夜标记,TBST洗膜3次,每次5 min,加入HRP标记的二抗室温标记1 h,TBST洗膜3次,每次5 min,ECL显色观察分析结果。
2 结 果
2.1 PRC17截短突变体的构建和鉴定
构建的pcDNA-HA-PRC17(164)质粒经Bam HⅠ和Eco RⅠ双酶切后,出现502 bp大小的特征性片段;pcDNA-HA-PRC17(Δ164)质粒经Bam HⅠ和XhoⅠ双酶切后出现1 173 bp大小的特征性片段(图1)。DNA序列测定证实上述PRC17截短突变体序列无误。

图1 PRC17截短突变体重组表达载体的酶切鉴定Fig 1 Identification of recombinant plasmid expressing truncated PRC17 mutant by restriction enzyme digestion M.DNA ladder;Lane 1.pcDNA-HA-PRC17 digested with Bam HⅠand Eco RⅠ;Lane 2.pcDNA-HA-PRC17(164)digested with Bam HⅠ and Eco RⅠ;Lane 3.pcDNA-HA-PRC17(Δ164)digested with Bam HⅠ and XhoⅠ
2.2 GST-MLC2融合蛋白的诱导表达与纯化
转化pGEX-MLC2或空载体pGEX-6p-1的BL21细菌经0.1 mmol·L-1的IPTG诱导6 h后细菌裂解,裂解物上清经Glutathione Sepharose 4B亲和层析纯化。SDS-PAGE蛋白电泳及考马斯亮蓝染色结果显示,纯化的GST和GST-MLC2蛋白分子质量分别约为28.4 kD和46.6 kD,符合预期;两种蛋白的纯度均在95%以上(图2),GST和GST-MLC2蛋白均得到了很好的表达与纯化。
2.3 PRC17与MLC2相互作用的分析
为了分析PRC17与MLC2之间的相互作用,我们将PRC17及其一系列氨基酸片段缺失突变体分别转染SMMC-7721细胞,以GST蛋白为对照,与纯化的GST-MLC2进行GST沉淀分析。结果显示,PRC17及其突变体都能在SMMC-7721中表达(图3、图4B)。并且PRC17明显结合MLC2而不结合阴性对照GST(图4C),说明PRC17能特异性结合MLC2。与全长PRC17相似,突变体PRC17(353)和PRC17(251)均能有效结合MLC2,相反,PRC17(164)和PRC17(Δ164)都不能与MLC2结合(图4)。这些结果提示PRC17蛋白序列上与MLC2结合的部位位于其氨基端251位氨基酸之内,可能在164位氨基酸附近。
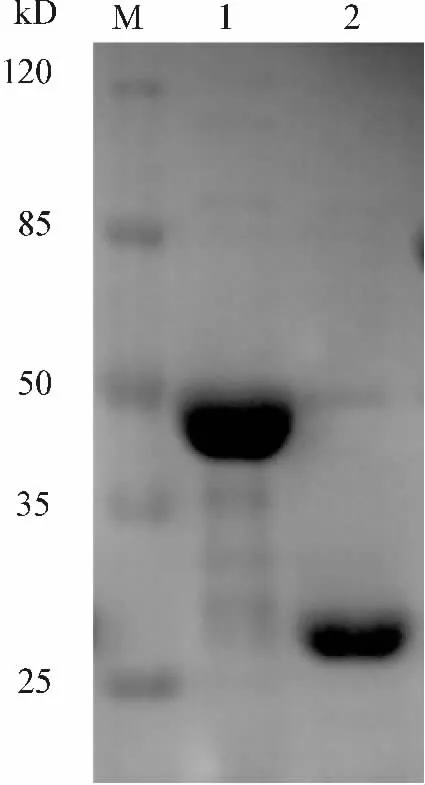
图2 GST和GST-MLC2纯化蛋白的SDS-PAGE分析Fig 2 SDS-PAGE analysis of purified GST-MLC2andGST protein M.protein marker;Lane 1.purified GST-MLC2;Lane 2.purified GST

图3 PRC17及其截短突变体示意图Fig 3 Schematic illustration of full-length wild type PRC17 truncated mutant
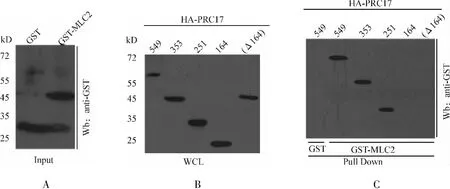
图4 PRC17与MLC2相互作用及PRC17蛋白序列上结合位点的鉴定Fig 4 Identification of the interaction between PRC17 and MLC2 and the MLC2-binding site on PRC17 A.Western blot analysis of purified GST and GST-MLC2;B.Whole cell lysate of SMMC-7721 cells expressing PRC17 mutants respectively were tested by Western blot;C.GST-pull down was performed to test the interaction between MLC2 and PRC17 or its truncated mutants
3 讨 论
人类的DNA中有一些基因是其它物种所没有的,这些独有的基因是区别人类与其它物种的基础,但是人们对他们还了解甚少。PRC17作为一个人类特有的癌基因,相关的研究虽然已经有所进展,但它的功能及其调节机制都不清楚。我们通过PRC17与TRE17的同源性预测与TRE17结合的MLC2可能也与PRC17相互作用,并通过实验证明PRC17与MLC2之间结合,为下一步研究它们相互作用的功能打下了基础。
首先,PRC17参与了对细胞巨胞饮的调节。巨胞饮是在某些因素刺激下,细胞膜皱褶形成直径为0.5~2μm大的内吞泡的过程,是非选择性内吞细胞外液相大分子和营养物质的有效途径。最新的研究显示,巨胞饮途径可能是肿瘤细胞获得氨基酸等营养物质促进肿瘤生长的重要途径,通过药物抑制巨胞饮途径可以切断肿瘤的营养供给,阻碍肿瘤的生长[10]。巨胞饮整个过程需要肌动蛋白的参与[11]。肌球蛋白Ⅱ由一对重链和两对轻链组成,轻链在肌球蛋白轻链激酶(MLCK)的作用下发生磷酸化,使重链的构象变化暴露出与肌动蛋白的结合位点,调节细胞的运动等生理功能。研究表明,MLCK抑制剂ML-7能显著抑制细胞膜皱褶的运动及巨胞饮体的产生[12],这也意味着肌球蛋白轻链参与了细胞巨胞饮的过程。PRC17与MLC2之间的相互作用在细胞巨胞饮过程中的功能和机制有待我们进一步研究。
另外,作为肌球蛋白的重要组成部分,肌球蛋白轻链参与了许多重要的生理功能,包括细胞的迁移、细胞质分裂及细胞形态的改变[13-17]。研究显示,MLC2也参与了癌细胞的侵袭和转移,抑制肌球蛋白轻链磷酸化可以阻扰癌细胞的侵袭[18-20]。一些蛋白通过与MLCK或MLC的相互作用影响肌球蛋白轻链磷酸化,从而参与对癌细胞侵袭的调节。人ARD1(hARD1)与MLCK相互作用后能使激活的MLCK被乙酰化失活,导致MLC磷酸化的减弱,并抑制肿瘤细胞的侵袭[21]。肌纤维生成调节因子-1(MR-1)则与MLC2相互作用,促进细胞的增殖和迁移[19]。PRC17与MLC2之间的相互作用是否调节着MLC2的磷酸化并继而影响细胞恶性转化和转移有待进一步研究。
[1]PEI L,PENG Y,YANG Y,et al.PRC17,a novel oncogene encoding a Rab GTPase-activating protein,is amplified in prostate cancer[J].Cancer Res,2002,62(19):5420-5424.
[2]WAINSZELBAUM M J,CHARRON A J,KONG C,et al.The hominoid-specific oncogene TBC1D3 activates Ras and modulates epidermal growth factor receptor signaling and trafficking[J].JBiol Chem,2008,283(19):13233-13242.
[3]WAINSZELBAUM M J,LIU J,KONG C,et al.TBC1D3,a hominoid-specific gene,delays IRS-1 degradation and promotes insulin signaling by modulating p70 S6 kinase activity[J].PLoSOne,2012,7(2):e31225.
[4]FRITTOLI E,PALAMIDESSI A,PIZZIGONI A,et al.The primate-specific protein TBC1D3 is required for optimal macropinocytosis in a novel ARF6-dependent pathway[J].Mol Biol Cell,2008,19(4):1304-1316.
[5]杨永刚,田田,郭丹,等.细胞骨架蛋白肌球蛋白轻链与癌蛋白TRE17相互作用的鉴定[J].南通大学学报:医学版,2008,28(2):82-84.
[6]PAULDING C A,RUVOLO M,HABER D A.The Tre2(USP6)oncogene is a hominoid-specific gene[J].Proc Natl Acad Sci USA,2003,100(5):2507-2511.
[7]陈洋,何泽,张永臣,等.人肌球蛋白调节性轻链的原核表达及纯化[J].东南大学学报:医学版,2013,32(4):408-412.
[8]沈涛,许晓军,李妍,等.GST-hCAP融合蛋白表达载体的构建及其在原核细胞中的表达[J].东南大学学报:医学版,2012,31(1):24-28.
[9]张红艳,李彦姝,姚远,等.pGEX-5X-1-hLMO4原核质粒构建及重组蛋白表达[J].东南大学学报:医学版,2012,31(2):139-143.
[10]COMMISSOC,DAVIDSONSM,SOYDANER-AZELOGLU R G,et al.Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells[J].Nature,2013,497(7451):633-637.
[11]SWANSON JA,WATTSC.Macropinocytosis[J].Trends Cell Biol,1995,5(11):424-428.
[12]ARAKI N,HATAE T,FURUKAWA A,et al.Phosphoinositide-3-kinase-independent contractile activities associated with Fcgamma-receptor-mediated phagocytosis and macropinocytosis in macrophages[J].J Cell Sci,2003,116(Pt 2):247-257.
[13]KOSAKO H,YOSHIDA T,MATSUMURA F,et al.Rho-kinase/ROCK is involved in cytokinesis through the phosphorylation of myosin light chain and not ezrin/radixin/moesin proteins at the cleavage furrow[J].Oncogene,2000,19(52):6059-6064.
[14]王丛阳,王辉,沈传陆.肌球蛋白轻链的调节及其对肿瘤细胞增殖、转移的影响[J].医学综述,2010,16(21):3251-3254.
[15]OLAZABAL I M,MACHESKY L M.Abp1p and cortactin,new"hand-holds"for actin[J].J Cell Biol,2001,154(4):679-682.
[16]THAIPARAMBIL J T,EGGERSC M,MARCUS A I.AMPK regulates mitotic spindle orientation through phosphorylation of myosin regulatory light chain[J].Mol Cell Biol,2012,32(16):3203-3217.
[17]MIZUTANI T,HAGA H,KOYAMA Y,et al.Diphosphorylation of the myosin regulatory light chain enhances the tension acting on stress fibers in fibroblasts[J].JCell Physiol,2006,209(3):726-731.
[18]KANEKO K,SATOH K,MASAMUNE A,et al.Myosin light chain kinase inhibitors can block invasion and adhesion of human pancreatic cancer cell lines[J].Pancreas,2002,24(1):34-41.
[19]REN K,JIN H,BIAN C,et al.MR-1 modulates proliferation and migration of human hepatoma HepG2 cells through myo-sin light chains-2(MLC2)/focal adhesion kinase(FAK)/Akt signaling pathway[J].J Biol Chem,2008,283(51):35598-35605.
[20]UMEDA D,YAMADA K,TACHIBANA H.H89(N-[2-(p-bromocinnamylamino)ethyl]-5-isoquinolinesulfonamide)induces reduction of myosin regulatory light chain phosphorylation and inhibits cell proliferation[J].Eur J Pharmacol,2008,590(1-3):61-66.
[21]SHIN D H,CHUN Y S,LEE K H,et al.Arrest defective-1 controls tumor cell behavior by acetylating myosin light chain kinase[J].PLoSOne,2009,4(10):e7451.
