纳米银冻干粉小鼠经口最大耐受剂量实验
2014-12-25王醒江筱莉周昱薇陈明祺吕海顾宁
王醒,江筱莉,周昱薇,陈明祺,吕海,顾宁
(1.东南大学生物科学与医学工程学院,江苏南京 210009;2.江苏省中医院重症医学科,江苏南京 210029)
在生物医学领域,纳米银的抗菌性能已为人们逐渐认识和使用。纳米银抗菌谱广,对G+和G-菌均有良好的抑制作用,同时,纳米银还可以抗病毒和抗其它真核微生物[1-3]。与临床上其他抗菌剂比较,纳米银不仅是一种广谱抗菌剂,微量即可发挥杀菌作用,而且它不同于抗生素,不会产生耐药性,且效力持久,是一种长效的抗菌剂[4-6]。但目前有关纳米银生物安全性评价的研究尚不多见。开展纳米银在动物体内的安全性评价实验,对促进纳米银材料抗菌导管进入临床试验阶段具有重要意义。本研究通过对健康小鼠一次性经口灌胃给药行最大剂量耐受实验,为纳米银的生物安全应用提供一定的支持和依据。
1 材料与方法
1.1 实验材料
ICR小鼠40只,体重18~22 g,由扬州大学实验动物中心提供,合格证号:SCXK(苏)2012-0004。纳米银冻干粉由东南大学生物科学与医学工程学院重点实验室提供,粒径15~30 nm;临床成人日用量为1.67μg·kg-1。实验条件:室温[(20±2)℃],湿度55% ~65%,光照适度,通风洁净良好。
1.2 实验方法
1.2.1 实验动物分组 将40只ICR小鼠随机分为实验组与对照组各20只。实验组给予纳米银冻干粉6 mg·kg-1,对照组给予等量生理盐水(NS)。
1.2.2 实验方法 所有动物实验前正常饲养,给药前禁食(不禁水)12 h,实验组用150μg·ml-1纳米银(最大浓度)灌胃给药,按0.4 ml·(10 g鼠重)-1灌胃1次。全价营养颗粒饲料饲养2周。
1.2.3 观察指标 给药后观察2周内小鼠行为、外观、进食、排泄物、有无死亡情况等。2周后处死实验动物进行尸检,肉眼观察各主要脏器(心、肝、脾、肺、肾)有无异常改变,并在电镜下观察有无损伤情况。
1.3 统计学处理
2 结 果
2.1 两组小鼠一般情况
纳米银冻干粉按6 mg·kg-1剂量给实验组小鼠经口灌胃后,未观察到动物出现不良反应。小鼠活动未见明显改变,行为无异常,安静,无明显烦躁;皮毛干燥整洁,尿液及粪便正常。摄食量、体重等与对照组比较差异无统计学意义(P>0.05,表1)。两组动物2周内均未发生死亡。
表1 纳米银灌胃最大给药量对小鼠一般特征的影响±s)Tab 1 General characteristics of mice after intragastric administration with the maximum dose of nano silver lyophilized powder±s)
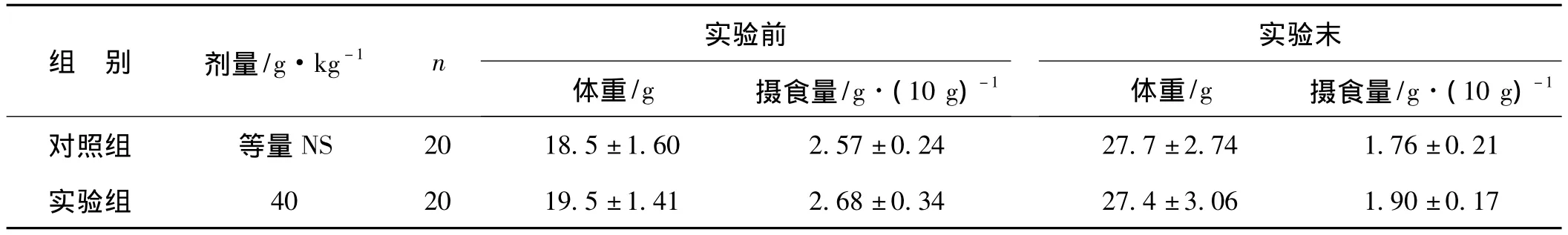
表1 纳米银灌胃最大给药量对小鼠一般特征的影响±s)Tab 1 General characteristics of mice after intragastric administration with the maximum dose of nano silver lyophilized powder±s)
组 别 剂量/g·kg-1 n 实验前体重/g 摄食量/g·(10 g)-1实验末体重/g 摄食量/g·(10 g)-1对照组 等量NS 20 18.5±1.60 2.57±0.24 27.7±2.74 1.76±0.21实验组 40 20 19.5±1.41 2.68±0.34 27.4±3.06 1.90±0.17
2.2 主要脏器病理改变情况比较
给药2周后处死两组小鼠,肉眼观察两组小鼠各内脏(心、肝、脾、肺、肾)外形、颜色、质地、大小等均未见异常改变。HE染色后电镜下观察两组小鼠主要脏器切片形态,显示两组心、肾、肺、肝、脾均形态结构正常,无明显细胞凋亡、变性,无纳米银颗粒沉积(图1)。
3 讨 论
随着纳米银材料在医疗领域应用的日益广泛,纳米银的生物安全性问题愈加值得关注。纳米银可通过呼吸道、消化道、皮肤暴露等多种途径进入人体内,与机体相互作用后所产生物质的化学特性、生物活性与化学成分相同的常规物质有很大不同,具有潜在的毒性效应,并成为一些疾病的诱因[7]。以往研究认为,银尚属于相对安全的抗菌材料。银的常规毒性表现为银中毒,但一般只有当患者存在大面积开放性创伤,且长期使用大剂量的银离子抗菌剂时才会出现银离子的蓄积中毒[8]。有关纳米银的体外细胞毒性实验中发现,当纳米银的浓度和蓄积量达到一定程度,其对细胞的形貌和活性都会产生一定的影响,并且随着浓度增加而毒性作用进一步增强[9-11]。Asharani等[12]对纳米银的细胞毒理和基因毒理进行了研究,并对纳米银的毒理机制进行了较为详细的探讨,发现:纳米银可以改变细胞形态、细胞的生存能力、代谢活动、氧化过程;纳米银可以减少细胞中ATP的量,造成线粒体的损害,增加活性氧的产物。Asharani等[13]通过斑马鱼模型进一步研究了纳米银在活体中的毒性:鱼的精胚和纳米银共孵育一段时间后可发现,纳米银吸附于一些重要器官,如脑部;随着鱼的生长可进一步引起后期的发育缺陷。该研究也在一定程度上证实了纳米银在活体的沉积吸附方式,以及其如何与生物分子相互作用(如蛋白和DNA)。

图1 电镜下两组主要脏器病理形态 4×10 A1~A5为对照组(依次为心、肾、肺、肝、脾),B1~B5为实验组(依次为心、肾、肺、肝、脾)Fig 1 Comparison of major organs pathological form(4 ×10)A1-A5 for the control group(heart,kidney,lung,liver,spleen),B1-B5 for the experimental group(heart,kidney,lung,liver,spleen)
本研究中,纳米银冻干粉经口灌胃给药后小鼠未能测出LD50,小鼠经口最大给药量、最大容积的实验结果表明:20只小鼠给药后无明显毒性反应,2周内亦无死亡。因此,纳米银经口给药的小鼠最大给药量为6 mg·kg-1,如按临床成人1日口服1.67μg·kg-1计算,则该药的小鼠1日灌胃药量为临床成人1日口服量的3 592倍。
本实验肉眼观察了两组小鼠主要脏器外形、颜色、质地、大小等,均未见异常改变;HE染色后电镜下观察,两组小鼠主要脏器切片均形态结构正常,无明显细胞凋亡、变性,这与目前已进行的大鼠28 d经气道和经口毒性实验取得的结果[14-15]相似。Ji等[14]给大鼠吸入纳米银粒子(4~80 nm),结果显示,大鼠在28 d的体重、器官重量均未发生显著变化,亦未发现明显脏器毒性。Kim等[15]用纳米银颗粒(60 nm)进行了大鼠经口毒性实验,发现各组大鼠28 d体重无明显变化,未见明显脏器损害情况,仅在高剂量(300 mg·kg-1)时引起轻度肝损,而该剂量为本实验小鼠经口给药剂量的50倍,表明该剂量的纳米银是相对安全的。
然而,纳米银是通过其释放的银离子还是自身通过细胞膜进入细胞后与其它亚细胞器反应而产生毒性,目前尚未定论。在设计高效抗菌的纳米银抗菌材料的同时,因其要求抗菌效果实现持久缓慢的特点,更需要注重纳米银的安全性。所以,进一步深入开展纳米银生物安全性方面的研究,有助于推进医用纳米银抗菌材料的推广应用。
[1]张宇,葛存旺,虞伟,等.无机纳米抗菌剂用于医用无菌纱布的研究[J].东南大学学报:自然科学版,2001,31(2):11-11.
[2]向冬喜,郑丛龙.纳米抗菌材料抗病毒作用的研究进展[J].中国微生态学杂志,2009,21(8):760-761.
[3]苗迎秋,向冬喜,郑丛龙.纳米银抗流感病毒H3N2作用的实验研究[J].山东医药,2010,50(16):18-20.
[4]陈美婉,彭新生,吴琳娜,等.纳米银抗菌剂的研究和应用[J].中国消毒学杂志,2009,26(4):424-426.
[5]ALT V,BECHERT T,STEINRUCKE P,et al.An in vitro assessment of the antibacterial properties and cytotoxicity of nanoparticulate silver bone cement[J].Biomaterials,2004,25(18):4383-4391.
[6]JEON H J,YI S C,OH S G.Preparation and antibacterial effects of Ag-SiO2thin films by sol-gel method[J].Biomateri-als,2003,24(27):4921-4928.
[7]孙倩,李明春,马守栋.纳米银抗菌活性及生物安全性研究进展[J].药学研究,2013,32(2):103-105.
[8]YOU C,HAN C,WANGX,et al.The progress of silver nanoparticles in the antibacterial mechanism,clinical application and cytotoxicity[J].Mol Biol Rep,2012,39(9):9193-9201.
[9]BRAYDICH-STOLLE L,HUSSAIN S,SCHLAGER J,et al.In vitro cytotoxicity of nanoparticles in mammalian germline stem cells[J].Toxicol Sci,2005,88(2):412-419.
[10]BURD A,KWOK CH,HUNGSC,et al.A comparative study of the cytotoxicity of silver-based dressings in monolayer cell,tissue explant,and animal models[J].Wound Repair Regen,2007,15(1):94-104.
[11]TANGJ,XIONGL,WANGS,et al.Distribution,translocation and accumulation of silver nanoparticles in rats[J].JNanosci Nanotechnol,2009,9(8):4924-4932.
[12]ASHARANI PV,MUN GL K,HANDE M P,et al.Cytotoxicity and genotoxicity of silver nanoparticles in human cells[J].ACSNano,2009,3(2):279-290.
[13]ASHARANI P V,WU Y L,GONG Z Y,et al.Comparison of the toxicity of silver,gold and platinum nanoparticles in developing zebrafish embryos[J].Nanotoxicology,2011,5(1):43-54.
[14]JI JH,JUNG J H,KIM SS,et al.Twenty-eight-day inhalation toxicity study of silver nanoparticles in Sprague-Dawley rats[J].Inhal Toxicol,2007,19(10):857-871.
[15]KIM Y S,KIM J S,CHO H S,et al.Twenty-eight-day oral toxicity,genotoxicity,and gender-related tissue distribution of silver nanoparticles in Sprague-Dawley rats[J].Inhal Toxicol,2008,20(6):575-583.
