RNAi 和GroEL 介导的双价转基因番茄对TYLCV的抗性
2014-12-23杨玛丽张保龙郭佳茹赵统敏余文贵赵丽萍王银磊
杨玛丽, 张保龙, 郭佳茹, 赵统敏, 余文贵, 赵丽萍, 王银磊
(1.江苏省农业科学院蔬菜研究所,江苏 南京210014;2.江苏省农业科学院农业生物技术研究所,江苏 南京210014)
番茄黄化曲叶病毒(TYLCV)属于双生病毒科(Geminiviridae)菜豆金色花叶病毒属(Begomovirus),是一类具有孪生颗粒形态的植物单链DNA 病毒,变异频率较高[1-6]。由该病毒引起的番茄黄化曲叶病(TYLCD)是目前番茄生产上最为严重的病害之一,已在世界上40 多个国家大面积暴发并逐年加重,给当地农民均造成巨大经济损失[7-12]。该病害暴发突然、扩展迅速、危害性极强,一旦发生化学方法难以防治。另外,对双生病毒的抗性资源的相对匮乏,抗性遗传机制不明确等因素,又增加了利用常规育种手段进行植物双生病毒抗性改良的难度[13]。近年来,随着番茄基因工程技术的发展,为利用外源基因提高番茄对TYLCV 的抗性提供了一条有效途径。目前主要是通过转基因植物表达病毒蛋白(病毒外壳蛋白、复制相关蛋白和运动相关蛋白)[14-16]、RNAi 或反义RNA 技术[17-19]、利用烟粉虱体内的GroEL分子伴侣蛋白[20-21]等策略来实现对双生病毒的抗性。
然而,利用上述策略提高植物对双生病毒的抗性均存在一定的局限性。比如,植物表达病毒复制酶基因需要转基因植株的高表达、复制酶同时对植物的生长和发育的干扰及其抗性机制的不明确都限制了复制酶基因在抗双生病毒中的实际应用[22-23]。双生病毒是DNA 病毒,通过RNAi 技术并不能从根本上降解病毒,从而降低了利用RNAi 抗病毒的效果[24]。为了寻找新的有效防治TYLCVD 的策略,本研究根据RNAi 和GroEL基因抗性机制的不同,将实验室前期利用烟粉虱体内共生菌GroEL基因构建的SUC2-GroEL植物表达载体,及利用TYLCV 的AC1和AC2反向重复序列构建的植物表达载体pBI121-AC1-AC2,通过农杆菌介导的转化法共转化番茄,以期得到含单个基因和双基因的抗病再生植株,为番茄抗TYLCV 改良提供新的种质资源。
1 材料与方
1.1 材料
1.1.1 植物材料及病毒源 有限生长类型番茄CT9210 自交系由江苏省农业科学院蔬菜研究所提供。含有侵染性克隆PTYj01 的农杆菌EHA105 由江苏省农业科学院植物保护研究所季英华老师提供。
1.1.2 菌株及载体 大肠杆菌(Escherichia coli)DH5α、根 瘤 农 杆 菌(Agrobacterium tumefaciens)EHA105、质粒pBIl21 均为江苏省农业科学院农业生物技术研究所提供。TA 克隆载体PMD20-T 载体购自TaKaRa 公司,载体iHp[25]和pBI121 由江苏省农业科学院农业生物技术研究所提供。
1.1.3 试剂 T4 DNA 连接酶、限制性内切酶(Hind Ⅲ、BamH Ⅰ、SacⅠ、XhoⅠ)、DNA 分子量标准均购自TaKaRa 公司,其他试剂为国产分析纯试剂,组织基因组DNA 提取试剂盒购自TIANGEN 生物公司,质粒提取试剂盒、PCR 清洁试剂盒、DNA 片段快速纯化/回收试剂盒购于AXYGEN 公司。
1.2 方法
1.2.1 植物表达载体图谱 反向重复序列表达载体pBI121-AC1-AC2及SUC2-GroEL由江苏省农业科学院农业生物技术研究所提供,构建图谱见图1。
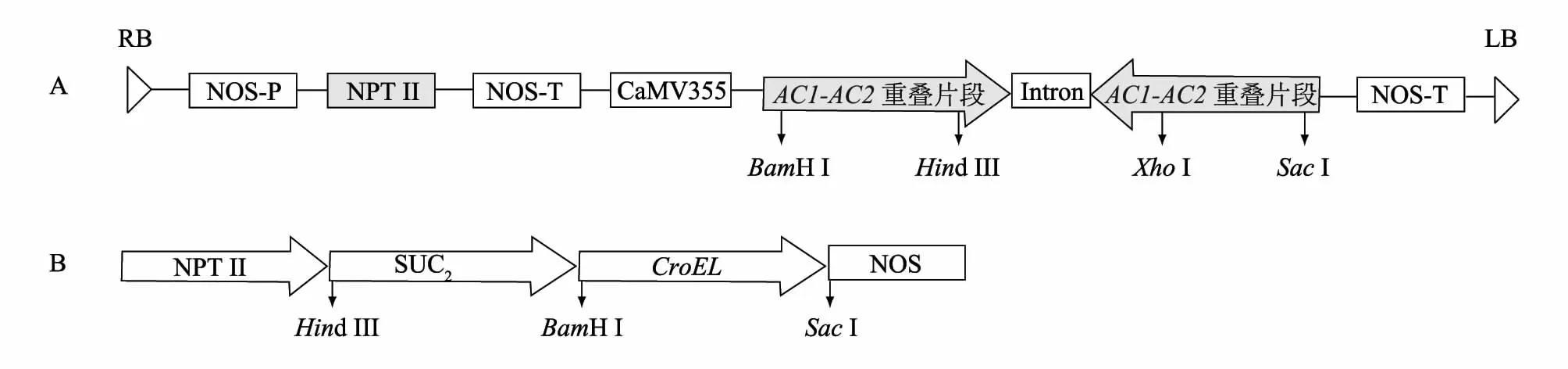
图1 反向重复序列表达载体(A)及标记载体SUC2-GroEL(B)构建图谱Fig.1 The construction of inverted repeat sequence express vector pBI121-AC1-AC2(A)and plant expression vector SUC2-GroEL(B)
1.2.2 RNAi 表达载体转化番茄及转基因植株鉴定
利用农杆菌介导的叶盘转化法转化番茄。樱桃番茄感病自交系CT9210 种子用70%乙醇浸泡30 s,然后用10%次氯酸钠消毒15 min,期间不断摇动,随后用无菌水冲洗3 遍,接种于1/2 MS 培养基上培养10 d;取番茄无菌苗的子叶或下胚轴为外植体,用OD600=0.3 左右的农杆菌菌液浸泡感染外植体5 min。取出外植体,置于无菌干燥滤纸上吸干残留菌液,转入MS+IAA 0.2 mg/L+6-BA 2.0 mg/L培养基上黑暗处共培养48 h,然后转入MS + IAA 0.2 mg/L+6-BA 2.0 mg/L +头孢霉素500 mg/L +卡那霉素50 mg/L筛选培养基上,25 ℃、18 h(光)/6 h(暗)的光照周期进行培养。每3 周换1 次培养基。约40 d 左右分化出绿色芽点;待再生芽长到3 ~4 cm时切下并转入1/2MS+IBA 1.0 mg/L+头孢霉素400 mg/L生根培养基中培养;根系发达后移栽至土壤。
用CTAB 法提取番茄再生植株叶片总DNA,用引物GroELF496/GroELR1058(表1)验证SUC2-Gro-EL载体,内含子特异引物FAD-intronF/FAD-intronR验证pBI121-AC1-AC2载体。PCR 扩增程序如下:95℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72℃延伸50 s,30 个循环;72 ℃延伸5 min。PCR 产物经1%琼脂糖凝胶电泳检测。
选择PCR 检测所得到的阳性转基因番茄再生植株和对照植株,用Trizol 试剂盒提取植株叶片总RNA。以反转录所得到的cDNA 为模板,以引物NPTF/NPTR 验 证pBI121-AC1-AC2载 体,以Gro-ELF496/ GroELR1058 验证SUC2-GroEL载体。取10 μl PCR 产物在1.2%琼脂糖凝胶上进行电泳检测。

表1 引物序列及扩增片段Table 1 Primer sequences and the sizes of amplified fragments
1.2.3 抗性鉴定 采用TYLCV 侵染性克隆农杆菌注射接种法对3 ~4 叶期苗龄的非转基因和转基因番茄进行接种,接种时用1 ml 一次性注射器吸取TYLCV 侵染性克隆农杆菌(OD600=0.5 ~0.6),在距离根部1 ~2 cm 处取3 点进行韧皮部注射,接种植株置于防虫温室,在25 ℃、18 h(光)/6 h(暗)的光照周期下培养。提取农杆菌注射接种后30 d 的番茄叶片DNA,用引物AV494/COPR[26]进行PCR检测,PCR 扩增程序如下:95 ℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸50 s,30 个循环;72 ℃延伸5 min。
2 结果与分析
2.1 转基因阳性植株的获得
2.1.1 转基因植株的再生 在转化前,对番茄外植体进行卡那霉素临界浓度测定,结果显示最佳临界筛选浓度为90 mg/L。通过农杆菌介导转化番茄CT9210 子叶和下胚轴外植体,筛选获得卡那霉素抗性番茄植株(图2),总计19 株。
2.1.2 再生番茄植株的PCR 检测 提取全部再生植株的总DNA,以引物GroELF496/GroELR1058 检测SUC2-GroEL载体,内含子特异引物FAD-intronF/FAD-intronR 检测pBI121-AC1-AC2载体,以非转基因番茄植株DNA 为对照。电泳检测结果显示:利用GroEL基因引物扩增,有11 株番茄再生植株能扩增出562 bp 的目的条带(图3A),利用RNAi 载体的FAD 引物扩增,有9 株能扩增出约800 bp 的目的条带(图3B),非转基因植株用两对引物均没有扩增到特异条带,初步推断GroEL外源基因和AC1、AC2的反向重复序列已经导入番茄基因组中,其中转SUC2-GroEL载体的有2、3、6、9、11、14、15、17 号植株,转pBI121-AC1-AC2载体的有1、4、5、8、10、13 号植株,转SUC2-GroEL和pBI121-AC1-AC2双载体的有3 株(7、12、19 号植株)。
2.1.3 转基因番茄植株的RT-PCR 检测 以引物GroELF496/GroELR1058、NPTF/NPTR 分别对PCR 检测呈阳性的转基因植株做RT-PCR 检测,结果显示:11 株转SUC2-GroEL载体的阳性苗中,有7 株能扩增出562 bp 的目的条带(图4A);9 株转pBI121-AC1-AC2载体阳性苗中有5 株能扩出约600 bp 的目的条带(图4B),转SUC2-GroEL和pBI121-AC1-AC2双载体的有2 株(7、12 号)。说明GroEL外源基因与AC1和AC2的反向重复序列成功在转录水平表达。其中转SUC2-GroEL载体的有5 株(2、6、9、14、17 号),转pBI121-AC1-AC2载体的有3 株(4、10、13 号)。

图2 番茄的遗传转化Fig.2 Genetic transformation of tomato
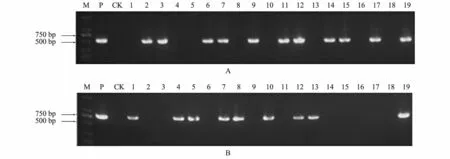
图3 再生植株[SUC2-GroEL 载体(A)和pBI121-AC1-AC2 载体(B)]的PCR 检测结果Fig.3 The amplification of regenerated tomato plants via SUC2-GroEL vector (A)and pBI121-AC1-AC2 vector (B)by PCR
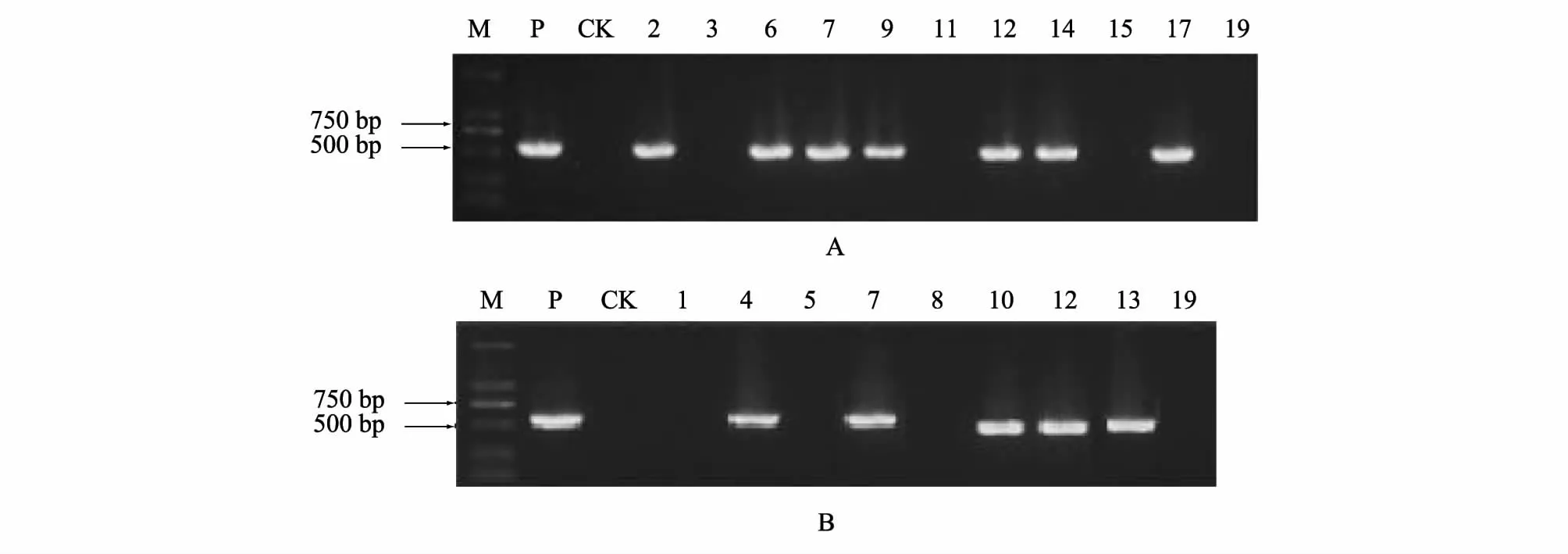
图4 再生阳性植株[SUC2-GroEL 载体(A)和pBI121-AC1-AC2 载体(B)]的RT-PCR 检测Fig.4 The amplification of transgenic tomato plants via SUC2-GroELvector (A)and pBI121-AC1-AC2 vector (B)by RT-PCR
2.2 转基因植株抗病性鉴定
2.2.1 T0代转基因植株抗病性鉴定 提取接种病毒后30 d 的非转基因番茄植株和在转录水平表达的单/双价转基因番茄植株叶片的总DNA,用TYLCV 病毒特异引物AV494/COPR 做PCR 检测。结果如图5 所示,接种病毒后的非转基因植株能扩增出570 bp 的病毒条带,转基因植株中有3 株扩出微弱条带,7 株未扩出条带。其中转SUC2-GroEL载体的植株中,2 号和14 号扩出570 bp 的病毒条带,而6、9、17 号未扩出570 bp 的病毒条带;转pBI121-AC1-AC2基因的植株中,10 号扩出570 bp 的病毒条带,4号和13 号未扩出570 bp 的病毒条带;转SUC2-Gro-EL/ pBI121-AC1-AC2双价载体的7 号和12 号植株均未扩增出570 bp 的病毒条带。发病情况调查结果,非转基因番茄植株在接种20 d 时开始表现症状,接种30 d 新叶边缘黄化、卷曲,叶片皱缩,植株严重矮化,发病症状严重;转基因番茄植株中检测到病毒条带的2、14 号植株,接种20 d 时有轻微症状,接种30 d 时的叶片边缘黄化,卷曲,植株轻度矮化;而检测到病毒条带的10 号植株在接种20 d 时没有任何症状,接种30 d 时叶片表现轻微黄化,卷曲不明显;未检测到病毒条带的转基因番茄植株(4、6、7、9、12、13、17 号)均生长正常,未表现发病症状。

图5 转基因番茄植株病毒引物PCR 分析Fig.5 The analysis of transgenic tomato plants by PCR with virus primers
2.2.2 T1代转基因番茄的抗病性鉴定 转SUC2-GroEL、pBI121-AC1-AC2、SUC2-GroEL/ pBI121-AC1-AC2不同载体的3 类转基因番茄中,每类选取2 个T0代未扩出病毒条带株系,每个株系随机挑选10株阳性植株进行接种。30 d 后对这些植株提DNA检测病毒含量并统计发病情况,结果显示:在T1代非转基因植株能扩增到570 bp 的病毒条带(图6);转SUC2-GroELT0代未扩出病毒条带的2 个株系20个植株中有7 株扩出病毒条带,带毒率35%;转pBI121-AC1-AC2T0代未扩出病毒条带的2 个株系20 个植株中有5 株扩出病毒条带,带毒率25%;转SUC2-GroEL/pBI121-AC1-AC2T0代未扩出病毒条带的2 个株系20 个植株中有3 株扩出病毒条带,带毒率是15%(表2)。

图6 部分转基因番茄植株(T1 代)病毒引物的PCR 分析Fig.6 The analysis of some transgenic tomato plants by PCR with virus primers
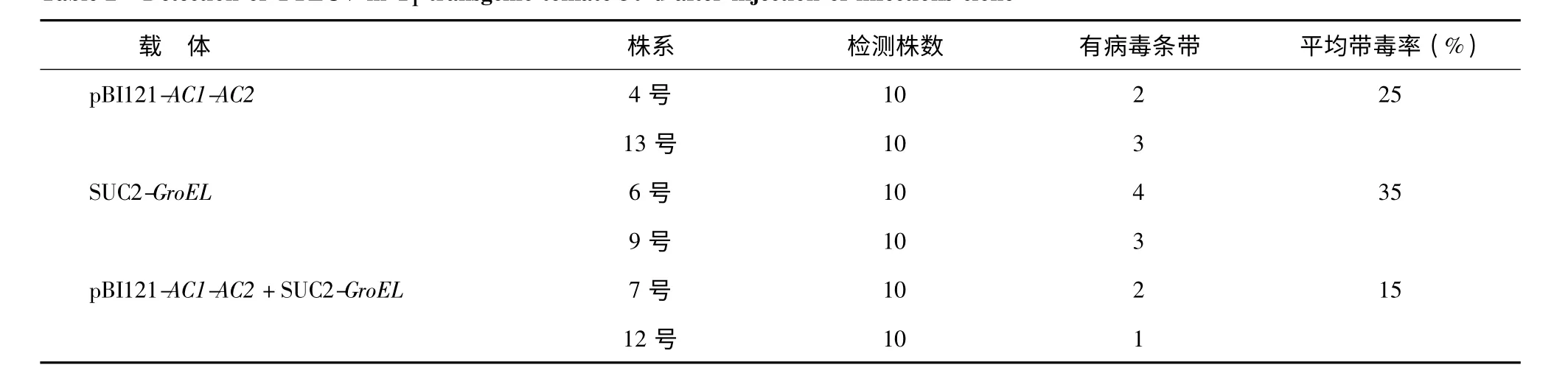
表2 T1 代转基因番茄TYLCV 侵染性克隆农杆菌注射30 d 后病毒检测结果Table 2 Detection of TYLCV in T1 transgenic tomato 30 d after injection of infections clone
发病情况调查结果发现,接种30 d 后,非转基因植株已明显矮化,叶片边缘黄化、卷曲、皱缩;扩出病毒条带的转基因植株中部分植株的新叶有轻微卷曲,部分植株不表现病症;未扩出病毒条带的转基因植株均表型正常,表现一定的抗性。
3 讨论
通过转基因技术将外源基因导入植物体内,能够提高植株的抗病能力,但是在高选择压下或病毒发生变异的情况下,只将单个基因导入植物获得的抗病性还不能达到满意的效果,而将多个与抗病相关的基因转入到同一个植物中可能会提高转基因植物的抗病毒能力。GroEL基因是烟粉虱体内共生菌编码的基因,通过在转基因植物韧皮部特异表达GroEL 蛋白,使病毒粒子被包裹在GroEL 蛋白中,抑制病毒的复制和移动,从而达到转基因番茄对TYLCV 的抗性[20]。我们前期研究中构建SUC2-GroEL载体并转化番茄,同样证实了利用基因GroEL提高番茄黄化曲叶病毒抗性具有可行性[21]。RNA 干扰(RNA interference,RNAi)是动植物抗病毒的一种防卫机制,正在被应用于作物遗传改良和抗病毒分子育种。利用RNAi 抗病毒可通过转基因植物表达病毒dsRNA 来实现,当出现dsRNA 时,核糖核酸酶III 家族中特异识别双链RNA 的dicer酶切割dsRNA,并将RNA 降解为21 ~25 bp 的双链小分子干扰RNA[27]。本研究前期研究中采集番茄黄化曲叶病毒(TYLCV)毒源,利用重叠PCR 技术获得TYLCV 的AC1-AC2融合基因片段,构建了RNAi 植物表达载体,同时沉默了TYLCV 的2 个目标基因。本研究根据GroEL基因和RNAi 抗性机制的不同,将构建的SUC2-GroEL和pBI121-AC1-AC2两个载体进行共转化,成功获得了含单基因和双基因的抗病再生植株,为番茄抗TYLCV 改良提供新的种质资源。本研究中对T1代转基因植株进行TYLCV 侵染性克隆农杆菌注射接种鉴定,发现转SUC2-GroELT0代未扩出病毒条带的2 个株系植株平均带毒率35%,转pBI121-AC1-AC2T0代未扩出病毒条带的2 个株系植株带毒率25%,转SUC2-GroEL/pBI121-AC1-AC2T0代未扩出病毒条带的2 个株系植株带毒率15%,可见,相比转单个基因的植株,转双基因的番茄植株中抗病单株的比例更高,发病单株的症状明显较轻,而利用引物AV494/COPR 进行病毒检测时扩出的病毒条带也较弱,因此初步推断转双基因的植株抗病能力要优于转单基因植株抗病能力。在今后工作中,将进一步利用T2代同时含有RNAi和GroEL的转基因植株进行TYLCV 接种,研究其抗性的遗传稳定性。
番茄黄化曲叶病自近年在我国广东、浙江、江苏等地发生以来,自南向北迅速蔓延至我国大部分地区,而不同地区的病毒变异较大[28-32],因此,有必要利用各地区相应病毒(番茄黄化曲叶病毒、番木瓜曲叶病毒、中国番茄黄化曲叶病毒、烟草曲叶病毒等)的侵染性克隆接种鉴定,对本研究所得转基因材料的抗性进行系统研究,确定其是否具备广谱抗性。
[1] RYBICK EP,BRIDDON RW,BROWN JK,et al.FamilyGeminiviridae[C]//Van Regenmortel MHV,Fauquet CM,Bishop DHL,et al.Virus taxonomy:Seventh report of the international committee on taxonomy of Viruses.New York:Academic Press,2000:285-297.
[2] HARRISON B D,ROBINSON D J.Natural genomic and antigenic variationin whitefly-transmitted gemininivirus (begomovirus)[J].AnnuRev Phytopatho1,1999,37(1):369-398.
[3] PADIDAM M,SAWYER S,FAUQUET C M.Possible emergence of new geminiviruses by frequent recombination[J].Virology,1999,265(2):218-225.
[4] 季英华,周晓伟,张 晖,等.应用DIBA 快速检测番茄黄化曲叶病毒[J].江苏农业学报,2013,29(3):685-687.
[5] 邢卫锋,丁雪玲,柯红娇,等.番茄黄化曲叶病毒病生防菌的筛选及防治效果研究[J].江苏农业科学,2013,41(9):110-112.
[6] 何 鑫,赵统敏,赵丽萍,等.问作及几种物理防治对番茄黄化曲叶病毒病的防控效果[J].江苏农业科学,2013,41(5):86-90.
[7] VARMA A,MALATHI V G.Emerging geminivirus problems:A serious threat to crop production[J].Annals of Applied Biology,2003,142(2):145-164.
[8] BOULTON M I.Geminiviruses:major threats to world agriculture[J].Annals of Applied Biology,2003,142(2):142-143.
[9] MONCI F,NAVAS-CASTILLO J,CENIS J L,et al.Spread of tomato yellow leaf curl virus sar from the mediterranean basin:Presence in the Canary Islands and Morocco[J].Plant Disease,2000,84(4):490.
[10] ACCOTTO G P,BRAGALONI M,LUISON D,et al.First report of tomato yellow leaf curl virus (TYLCV)in Italy[J].Plant Pathology,2003,52(6):799.
[11] UEDA S,TAKEUCHI S,OKABAYASHI M,et al.Evidence of new tomato yellow leaf curl virus in Japan and its detection using PCR[J].Journal of General Plant Pathology,2005,71(4):319-325.
[12] MORIONES E,NAVAS-CASTILLO J.Tomato yellow leaf curl virus,an emerging virus complex causing epidemics worldwide[J].Virus Research,2000,71(1-2):123-134.
[13] GARCIA-ANDRDS S,ACCOTTO G P,NAVAS-CASTILLO J,et al.Founder effect,plant host,and recombination shape the emergent population of begomoviruses that cause the tomato yellow leaf curl disease in the Mediterranean basin[J].Virology,2007,359(2):302-312.
[14] BRUNETTI A,TAVAZZA M,NORIS E,et al.High expression of truncated viral Rep protein confers resistance to Tomato yellow leaf curl virus in transgenic tomato plants[J].Mol Plant-Microbe Interact,1997(10):571
[15] BRUNETTI A,TAVAZZA M,NORIS E,et al.Transgenically expressed T-Rep of tomato yellow leaf curl Sardinia virus acts as a transdominant-negative mutant,inhibiting viral transcription and replication[J].Journal of Virology,2001(75):10573 –10581.[16] LUCIOLI A,NORIS E,BRUNETTI A,et al.Tomato yellow leaf curl Sardinia virus rep-derived resistance to homologous and heterologous geminiviruses occurs by different mechanisms and is overcome if virus-mediated transgene silencing is activated[J].Journal of Virology,2003(77):6785 –6798.
[17] ZRACHYA A,KUMAR PP,RAMAKRISHNAN U,et al.Production of siRNA targeted against TYLCV coat protein transcripts leads to silencing of its expression and resistance to the virus[J].Transgenic Research,2007,16(3):385-398.
[18] FUENTES A,RAMOS PL,FIALLO E,et al.Intron-hairpin RNA derived from replication associated proteinC1gene confers immunity to tomato yellow leaf curl virus infection in transgenic tomato plants[J].Transgenic Research,2006,15(3):291-304.
[19] REZK A A S,ABDALLAH N A,ABDEL A M,et al.Transgenemediated RNA silencing ofTYLCVgenes affecting the accumulation of viral DNA in plants[J].Arab Journey of Biotechnology,2006,9(1):143-158.
[20] AKAD F,EYBISHTZ A,EDEIBAUM D.Making a friend from a foe:expressing a Groel gene from the whitefly Bemisiatabaci in the phloem of tomato plants confers resistance to tomato yellow leaf curl virus[J].Archives of Virology,2007,152(7):1323-1339.
[21] 彭 宏,余文贵,赵统敏,等.GroEL基因抗番茄黄化曲叶病毒(TYLCV)的研究[J].江苏农业学报,2011,27(2):371-377.
[22] ANTIGNUS Y,VUNSH R,LACHMAN O,et al.TruncatedRepgene originated from Tomato yellow leaf curl virus-Israel (Mild)confers strain-specific resistance in transgenic tomato[J].Annals of Applied Biology,2004,144(1):39-44.
[23] SHEPHERD D N,MANGWENDE T,MARTIN D P,et al.Inhibition of maize streak virus (MSV)replication by transient and transgenic expression of MSV replication-associated protein mutants[J].Journey of General Virology,2007,88(1):325-336.
[24] GLICK E,ZRACHYA A,LEVY Y,et al.Interaction with host SGS3 is required for suppression of RNA silencing by tomato yellow leaf curl virus V2 proteinv[J].PNAS,2008,105(1):157-161.
[25] STOUTJESDIJK P A,SINGH S P,LIU Q,et al.hpRNA-mediated targeting of the ArabidopsisFAD2gene gives highly efficient and stable silencing[J].Plant Physiology,2002,129:1723-1731.
[26] 何自福,毛明杰,虞 皓,等.朱槿曲叶病样中烟粉虱传双生病毒的分子检测[C]//王 琦,姜道宏.植物病理学会第8 届青年学术研讨会论文集.北京:中国农业科学技术出版社,2007:114-116.
[27] BASS B.Double-stranded RNA as a template for gene silencing[J].Cell,2000,101(3):235-238.
[28] 何自福,虞 皓,罗方芳.广东番茄曲叶病毒G3 分离物基因组DNA-A 的分子特征[J].植物病理学报,2005,35(3):208-213.
[29] 岳 宁,丁 铭,董家红,等.中国番茄黄化曲叶病毒在云南的发生分布及其遗传多样性[J].云南大学学报:自然科学版,
2008,30(S1):57-62.
[30] 赵统敏,余文贵,周益军,等.江苏省番茄黄化曲叶病毒病(TYLCD)的发生与诊断初报[J].江苏农业学报,2007,23(6):654-655.
[31] 余文贵,赵统敏,杨玛丽,等.山东、安徽两省栽培番茄烟粉虱传双生病毒的PCR 检测及序列分析[J].江苏农业学报,2009,
25(4):747-751.
[32] 李云洲,梁 燕, 王巧丽,等.杨凌番茄黄化曲叶病毒外壳蛋白基因的克隆与其核心序列分析[J].中国蔬菜,2013(4):
38-45.
