一种应用LORF11 同源子鉴别诊断鸭瘟病毒的PCR方法
2014-12-23许梦微张传健王志胜侯继波王继春
许梦微, 张传健, 周 希, 王志胜, 侯继波, 王继春
(1.江苏省农业科学院国家兽用生物制品工程技术研究中心,江苏 南京210014;2.南京农业大学动物医学院,江苏 南京210095;3.无锡市锡山区城区畜牧兽医站,江苏 无锡214101)
鸭瘟(Duck plague)是由鸭瘟病毒(Duck enteritis virus,DEV)引起的鸭、鹅和天鹅等水禽的一种急性传染病,其特征是传播迅速、发病率和死亡率高,严重威胁养鸭业的发展[1]。鸭瘟的临床特症包括感染鸭精神萎顿、下痢、流泪等,部分病鸭出现头颈部肿胀的特征性病症,组织病变包括食道黏膜出血或溃疡,泄殖腔黏膜出血与坏死,肝出血或有坏死灶等[2]。接种鸭瘟弱毒活疫苗或灭活疫苗可以产生有效保护。无论是自然感染还是人工感染的耐过鸭,均可获得坚强的免疫力,能对强毒攻击完全保护,且免疫保护的持续期可达数年[3-4]。
诊断鸭瘟的常用方法有病毒中和试验(NT)、琼脂糖凝胶沉淀试验(AGP)、酶联免疫吸附试验(ELISA)和聚合酶链式反应(PCR)等。NT 试验通常作为抗体检测和病毒鉴定的可靠方法,但存在操作复杂、周期长、敏感性低等问题[5],不适用于基层和大量样品检测。AGP 是在琼脂糖凝胶中进行的抗原抗体免疫沉淀反应,特点是简便、特异性好、试验条件要求低,既可定性又可定量,易于推广,但敏感性不佳。ELISA 因其特异性和敏感性俱佳,且能检测大量样品而得到广泛应用,既可检测抗体,又可检测抗原,但要求抗原纯度较高。PCR 诊断技术作为一种新的检测手段和方法,具有快速、敏感、特异性强、操作简便等特点,被广泛用于病原的诊断[6-9]。1998 年Plummer 等首先用PCR 方法检测鸭瘟病毒DNA 获得成功[10]。谢芝勋等根据己发表的DEV 基因序列设计PCR 引物扩增特异片段,可检测到100 fg 的DEV DNA 模板[11]。但这些PCR 方法只能诊断是否是鸭瘟病毒,而无法鉴别鸭瘟病毒是强毒株还是弱毒株[12-14],更无法区别不同来源的毒株。
江苏省农业科学院国家兽用生物制品工程技术研究中心(下文称本实验室)分离鉴定了一株鸭瘟病毒强毒株(LH2011),对其LORF11 同源子序列测定结果表明其全长为4 341 bp (JX885588),与中国的另一株强毒株CHv 株(JQ647509.1)一致,对比已发表的其他毒株的LORF11 同源子序列发现,欧洲株2085 株(JF999965)、Holland 株(JQ595417)、Jansen 株 (JQ430740.1 )和 D11-JW-016 株(JQ430739.1)为3 171 bp,中国疫苗株VAC 株为828 bp (EU082088.2),而另一株中国疫苗株clone-03 株为2 412 bp(EU294364.1 )[15-16]。不同来源鸭瘟病毒毒株的LORF11 同源子表现明显的多态性,能够区别出毒株是强毒或弱毒,还能区别毒株的来源。本研究根据鸭瘟病毒LORF11 同源子的序列特点,设计特异性引物,建立用于鉴别鸭瘟病毒的PCR 方法。
1 材料与方法
1.1 毒株和菌株
鸭瘟病毒LH2011 株由本实验室分离鉴定,半数致死量(LD50)为1 ml 10-2.3;鸭瘟病毒v2085 株由德国柏林自由大学兽医学院病毒研究所提供,LD50为1 ml 10-1.6;鸭瘟病毒VAC 株和Clone-03 株来自南京天邦生物科技有限公司,半数组织培养感染剂量(TCID50)分别为1 ml 10-4.5、10-3.5。鸭坦布苏病毒JS/2010 由由南京天邦生物科技有限公司提供;禽流感病毒CCTCC-V200312 购自中国典型培养物保藏中心;鸭疫里默氏菌ATCC 11845 购自美国标准菌种收藏所;鸭沙门氏菌CMCC 50083 购自中国医学微生物菌种保藏管理中心;鸭大肠杆菌CVCC 83003、鸭病毒性肝炎病毒CVCC AR2111、番鸭细小病毒CVCC AV238、传染性法氏囊病病毒CVCC AV140、鸡新城疫病毒CVCC AV1615、巴氏杆菌CVCC 471 均购自中国兽医微生物菌种保藏管理中心。
1.2 试验鸭、鸡胚及试剂
试验鸭为鸭瘟抗体阴性的60 ~70 日龄健康鸭;9 日龄SPF 鸡胚来自北京梅里亚维通实验动物技术有限公司;Ex TaqDNA 聚合酶、RT-PCR 试剂和DNA Marker 购自大连TaKaRa 公司;蛋白酶K 购自哈尔滨宝泰克生物科技公司;DMEM 培养基和新生牛血清购自GIBCO 公司。
1.3 引物设计和基因测序
应用Invitrogen 软件,参考已公开发表的全部鸭瘟病毒株LORF11 等位基因序列,在其上游5 bp 和下游101 bp 的位置设计1 对引物Primer F(5'-CATCTCGTGTCAGTTAAAGG-3')和 Primer R (5'-AAAACAAGAGTCAAGAGCCG-3')。引物由南京金斯瑞生物科技有限公司合成,用灭菌超纯水将上游和下游引物均稀释为10 pmol/ml,存放于-20 ℃。序列测定由华大基因科技服务有限公司完成。
1.4 鸭瘟病毒的增殖与病毒样本的提取
分别取10 倍最小致死剂量的鸭瘟病毒LH2011株和v2085 株肌肉接种2 月龄健康非免鸭,待鸭只发病后,取鸭只的肝脏等约0.1 ~0.5 g,加入10 倍量无菌纯水,研磨后,反复冻融3 次,8 000 r/min离心15 min,取上清作为组织提取物备用。鸭瘟病毒VAC 株和Clone-03 株分别按0.01 的感染复数感染鸡胚成纤维细胞,当细胞病变(CPE)达60% ~70%时,将上清与细胞一起反复冻融3 次,8 000 r/min离心15 min,取上清作为组织提取物备用。同时设未感染鸭瘟病毒的鸡胚成纤维细胞为对照,按与感染病毒的细胞相同的方法处理。参照《中华人民共和国兽用生物制品规程》2000 版附录所述方法分别测定鸭瘟病毒LH2011 株和v2085 株的LD50,以及VAC 株和Clone-03 株的TCID50。
1.5 鸭瘟病毒DNA 提取
取组织提取物制备的上清液445 μl,加入10%SDS 50 μl,20 mg/ml蛋白酶K2.5 μl,混匀,56 ℃水浴1 h,99 ℃水浴10 min,冷却至室温;用等体积的酚抽提2 次,等体积的酚∶ 氯仿(1∶ 1)抽提1 次,取上清液,加入1/10 体积的3 mol/L醋酸钠(pH =5.2)和1 ~2 倍体积无水乙醇,上下颠倒混匀,置-20 ℃条件下40 min 至数天;4 ℃、12 000 r/min条件下离心20 min,弃上清,沉淀用70%乙醇洗涤,置超净台中风干,加入20 ~100 μl 无菌纯水溶解,作为病毒DNA 备用。
1.6 鸭瘟病毒各毒株的PCR 扩增
分别以各鸭瘟病毒毒株提取的病毒DNA 为模板,用特异性引物进行扩增。反应体系:10 × PCR Buffer 5.0 μl,dNTPs(2.5 mmol/L)4.0 μl,Mg2+(25 mmol/L)3.0 μl,上下游引物(10 pmol/μl)各2.0 μl,Ex Taq酶0.5 μl,DNA 模板2.0 μl,ddH2O 31.5 μl。反应条件:94 ℃预变性3 min;94 ℃变性30 s,52 ℃退火40 s,72 ℃延伸220 s,循环40 次;最后72 ℃延伸10 min。反应结束后取PCR 产物5 μl 与Marker 一起分别点入1% 琼脂糖凝胶上,电泳40 min,在紫外灯照射下观察扩增片段的长度。取PCR产物,回收后进行序列测定。
1.7 PCR 特异性试验
将鸭瘟病毒LH2011 株、鸭瘟病毒v2085 株、鸭瘟病毒VAC 株、鸭瘟病毒Clone-03 株与鸭坦布苏病毒JS/2010、禽流感病毒CCTCC-V200312、鸭疫里默氏菌ATCC 11845、鸭沙门氏菌CMCC 50083、鸭大肠杆菌 CVCC 83003、鸭病毒性肝炎病毒 CVCC AR2111、番鸭细小病毒CVCC AV238、传染性法氏囊病病毒 CVCC AV140、鸡新城疫病毒 CVCC AV1615、巴氏杆菌CVCC 471 等10 种病原体的DNA 或cDNA 分别按上述方法进行PCR 扩增。DNA 病毒和细菌按常规方法培养后,分别提取DNA作为模板,进行PCR 反应。RNA 病毒按照常规方法培养后,提取RNA,反转录后得到cDNA,以cDNA为模板进行PCR 反应。
1.8 PCR 灵敏性试验
分别取鸭瘟病毒各毒株的组织提取物用生理盐水10 倍梯度稀释,直到稀释度为10-9。对每种病毒样品组织提取物的各稀释液提取病毒DNA,并进行PCR 扩增,以出现阳性反应条带的模板用量的最高稀释倍数计算可检出最低病毒含量。
1.9 鸭组织样品中鸭瘟病毒的检测
分别取10 倍最小致死剂量的鸭瘟病毒LH2011株和v2085 株肌肉接种2 月龄健康非免鸭,待鸭只发病后,取鸭只的肝脏约0.1 ~0.5 g 作为组织样品。鸭瘟病毒VAC 株和Clone-03 株分别按103TCID50的量肌肉接种2 月龄健康非免鸭,1 d 后,取鸭只的肝脏约0.1 ~0.5 g 作为组织样品。分别在各组织样品中加入10 倍量无菌纯水,研磨后,反复冻融3 次,8 000 r/min离心15 min,取上清作为组织提取物用。同时设未感染鸭瘟病毒的鸭肝脏为对照,按感染病毒的样品相同的方法处理得到健康鸭的组织提取物。
1.10 临床病料的PCR 检测
魏雪涛等[17]选择鸭瘟病毒UL6、UL7 保守序列,设计了1 对特异性引物,建立了鸭瘟病毒快速鉴别诊断的PCR 方法。我们同时用本研究建立的PCR 方法和魏雪涛等建立的传统PCR 方法对本实验室保存的8 份疑似鸭瘟病毒感染的临床组织病料进行检测,同时设立已知的中国强毒株和中国疫苗株Clone-03 株作为阳性对照,正常鸭组织作为阴性对照。
2 结果
2.1 鸭瘟病毒的PCR 鉴定
将PCR 扩增产物进行琼脂糖凝胶电泳。以鸭瘟病毒LH2011 株为模板的PCR 扩增产物长度为4 430 ~4 460 bp;以鸭瘟病毒v2085 株为模板的PCR扩增产物长度为3 260 ~3 290 bp;以鸭瘟病毒VAC株为模板的PCR 扩增产物长度为920 ~950 bp;以鸭瘟病毒Clone-03 株为模板的PCR 扩增产物长度为2 510 ~2 540 bp(图1)。将PCR 产物分别进行测序,发现其大小分别为4 448 bp、3 277 bp、934 bp 和2 518 bp,而且序列与发表的序列完全相符。

图1 PCR 鉴别鸭瘟病毒毒株Fig.1 PCR identification of duck enteritis virus(DEV)strains
2.2 PCR 特异性试验
如图2 所示,以鸭瘟病毒LH2011 株为模板的PCR 产物为4 430 ~4 460 bp;以鸭瘟病毒v2085 株为模板的PCR 产物为3 260 ~3 290 bp;以鸭瘟病毒VAC 株为模板的PCR 产物为920 ~950 bp;以鸭瘟病毒Clone-03 株为模板的PCR 产物为2 510 ~2 540 bp;其他各样品均无条带。
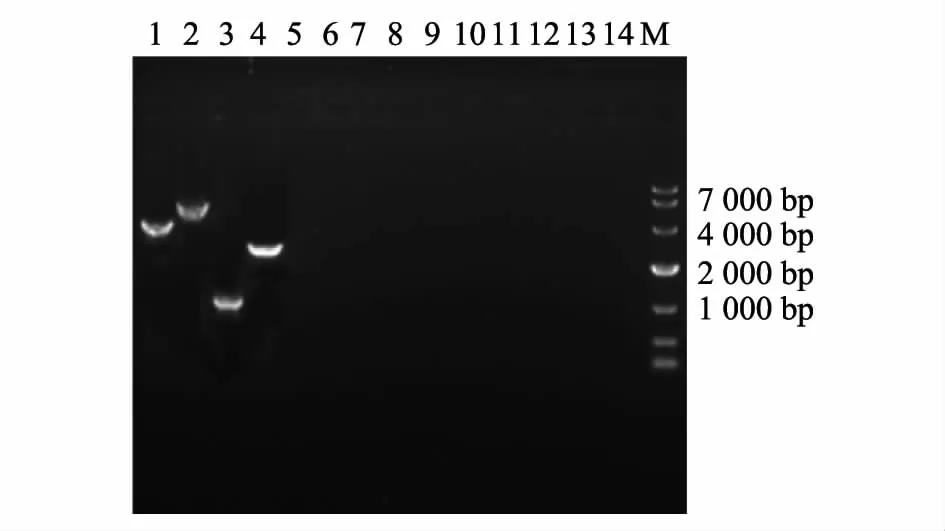
图2 鸭瘟病毒PCR 特异性试验Fig.2 Specificity of PCR method for DEV detection
2.3 PCR 灵敏性试验
以感染鸭瘟病毒LH2011 株的组织提取物稀释105倍后提取的DNA 为模板,得到的PCR 产物电泳后出现大小为4 430 ~4 460 bp 的特异性条带。该病毒样品组织提取物的LD50为1 ml 10-2.3,所以此方法可以检测到0.1LD50的鸭瘟病毒LH2011 株。以感染鸭瘟病毒VAC 株的组织提取物稀释107倍后提取的DNA 为模板,得到的PCR 产物电泳后出现920 ~950 bp 特异性条带。该病毒样品组织提取物的TCID50为1 ml 10-6.5,所以此方法可以检测到10TCID50的鸭瘟病毒VAC 株。以感染鸭瘟病毒Clone-03 的组织提取物稀释106倍后提取的DNA 为模板,得到的PCR 产物电泳后出现2 510 ~2 540 bp 特异性条带。该病毒样品组织提取物的TCID50为1 ml 10-5.5,所以此方法可以检测到10TCID50的鸭瘟病毒Clone-03 株。以感染鸭瘟病毒v2085 株的组织提取物稀释104倍后提取的DNA 为模板,得到的PCR产物电泳后出现3 260 ~3 290 bp 特异性条带。该病毒样品组织提取物的LD50为1 ml 10-1.6,所以此方法可以检测到0.1LD50的鸭瘟病毒v2085 株。
2.4 鸭组织样品中鸭瘟病毒的检测
如图3 所示,以鸭瘟病毒v2085 株感染鸭肝脏样品为模板的PCR 条带为3 260 ~3 290 bp;以鸭瘟病毒LH2011 株感染鸭肝脏样品为模板的PCR 条带为4 430 ~4 460 bp;以鸭瘟病毒VAC 株感染鸭肝脏样品为模板的PCR 条带为920 ~950 bp;以鸭瘟病毒Clone-03 株感染鸭肝脏样品为模板的PCR 条带为2 510 ~2 540 bp;以未接种的健康鸭肝脏样品为模板的无条带。
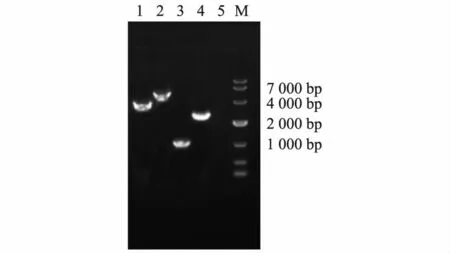
图3 感染鸭瘟病毒鸭组织样本检测结果电泳图Fig.3 The PCR detection of duck tissues infected with DEV
2.5 临床病料的PCR 检测
用本研究建立的PCR 法检测临床病料,结果(图4)显示1、2、4、7、8 号临床组织病料扩增出了4 448 bp 左右的条带,鸭瘟病毒LH2011 株(中国强毒株)扩增出4 448 bp 左右的条带,鸭瘟病毒Clone-03 株(中国疫苗株)扩增出2 518 bp 左右的条带,正常鸭组织未扩增出条带。确定1、2、4、7、8 号临床组织病料为鸭瘟病毒中国强毒株感染。传统PCR 检测结果如图5 所示,1、2、4、7、8 号临床组织病料、鸭瘟病毒LH2011 株(中国强毒株)及鸭瘟病毒Clone-03 株(中国疫苗株)均扩增出1 293 bp 左右的条带,正常鸭组织未扩增出条带。传统的PCR 方法只能检测临床样品是否感染了鸭瘟病毒,而本研究建立的PCR 方法不仅能检测临床样品是否感染了鸭瘟病毒,且能鉴别该鸭瘟病毒的来源。
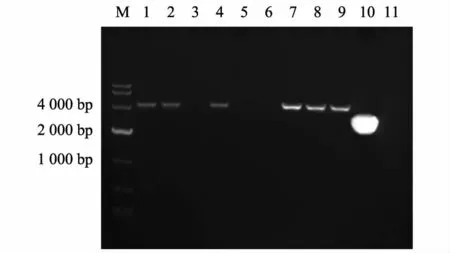
图4 本研究建立的PCR 方法检测临床病料结果Fig.4 Detection of clinical samples by PCR established in this study
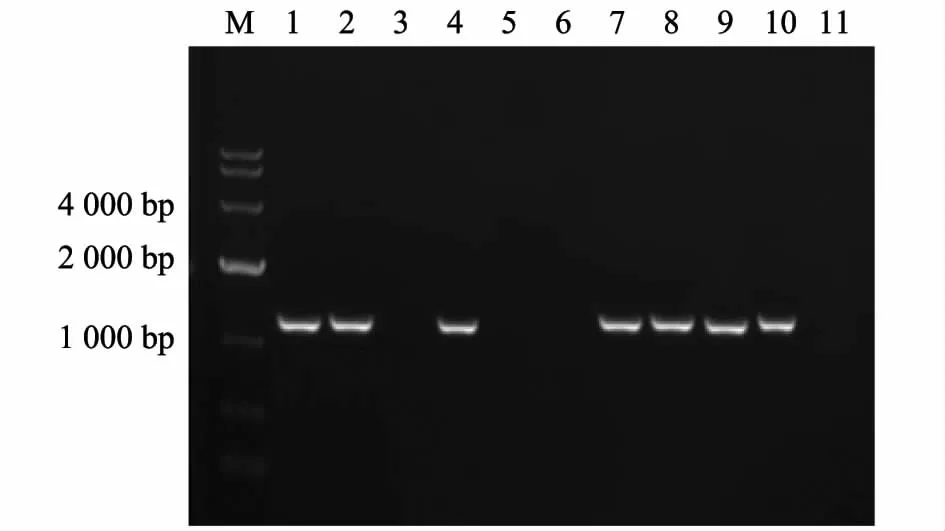
图5 传统PCR 方法检测临床病料结果Fig.5 Detection of clinical samples by conventional PCR
3 讨论
本研究中对比分析了已发表的鸭瘟病毒欧洲强毒株、中国强毒株及中国弱毒株的LORF11 等位基因序列,发现鸭瘟病毒欧洲强毒株LORF11 等位基因的开放阅读框(ORF)为3 171 bp,鸭瘟病毒中国强毒株的LORF11 等位基因序列中则发生了基因片段的插入,使其等位核苷酸序列变为4 342 bp,鸭瘟病毒VAC 株(中国疫苗株)的LORF11 等位基因大小为828 bp,鸭瘟病毒Clone-03(中国疫苗株)的LORF11 等位基因大小为2 412 bp。可见其多态性显著,且因来源不同和毒株不同而有明显的特征,据此推断可以根据LORF11 等位基因设计引物,来鉴别样品是否感染了鸭瘟病毒,且应能鉴别该鸭瘟病毒是欧洲强毒株、中国强毒株、中国疫苗株(弱毒株)VAC 株还是中国疫苗株(弱毒株)Clone-03 株。试验结果表明,本研究设计的引物(Primer F 和Primer R)对鸭瘟病毒强毒株和弱毒株均能扩增出与预计大小相符合的特异条带,与推测的结果一致,序列测定的结果进一步验证了此PCR 方法的可靠性。
本试验中选取了鸡新城疫病毒、鸡传染性法氏囊病病毒、禽流感病毒以及鸭病毒性肝炎病毒、番鸭细小病毒、鸭坦布苏病毒、鸭巴氏杆菌、鸭大肠杆菌、鸭沙门氏菌和鸭疫里默氏杆菌等鸭的主要细菌性和病毒性传染病病原作为对照,结果表明,本研究设计的引物(Primer F 和Primer R)对鸭瘟病毒强毒株和弱毒株均能扩增出与预计大小相符合的特异条带,而对其他10 种对照禽病病原体却扩增不出任何条带。这说明本研究建立的PCR 方法对于鸭瘟病毒的检测扩增是特异的,为鉴别与鸭瘟临床症状和病理变化相似的传染病提供了一种诊断技术。
本研究建立的PCR 方法能检测到10TCID50或0.1LD50的鸭瘟病毒DNA 含量,与贺东生等[18]建立的光敏生物素标记鸭瘟病毒核酸探针方法相比较,灵敏度提高至少10 倍。经对鸭组织样品中鸭瘟病毒的PCR 检测,结果均扩增出特异性条带。对疑似鸭瘟的临床病料检测也证实本PCR 方法具有快速、灵敏、特异的特点。如果再对PCR 产物进行测序,可以作为鸭瘟病毒诊断的一种标准方法。
LORF11 在强、弱毒株之间的差异可能与病毒的致病力变化密切相关,值得进一步研究。对于弱毒株中LORF11 所缺失的碱基对应的蛋白质片段,应可以作为血清学诊断的靶标,这样就可以与抗原诊断的PCR 方法配合起来,更加便于临床上的鉴别诊断。
[1] MONTGOMERY R,STEIN G J.An outbreak of duck virus enteritis (duck plague)in a captive flock of mixed waterfowl[J].Avian Dis,1981,25(1):207-213.
[2] 李金华,张馨月.鸭病毒性肠炎病毒(DEV)的主要特点及防制措施[J].浙江畜牧兽医,2007(6):10-11.
[3] 程安春,汪铭书,刘 菲,等.PCR 在鸭瘟临床诊断和免疫及致病机理研究中的初步应用[J].病毒学报,2004,20(4):364-370.
[4] LIU J,CHEN P,JIANG Y,et al.A duck enteritis virus-vectored bivalent live vaccine provides fast and complete protection against h5n1 avian influenza virus infection in ducks[J].J Virol,2011,85(21):10989-10998.
[5] 许宗丽,谢芝勋,谢丽基,等.鸭源新城疫病毒、鸭瘟病毒和鸭圆环病毒三重PCR 检测方法的建立[J].动物医学进展,2013,34(4):23-26.
[6] PRITCHARD L I,MORRISSY C,VAN PHUC K,et al.Development of a polymerase chain reaction to detect Vietnamese isolates of duck virus enteritis[J].Veterinary Microbiology,1999,68:149-156.
[7] 迪芬巴赫C W,德维克斯勒G S.PCR 技术实验指南[M].黄培堂,译.北京:科学出版社,1998.
[8] 彭秀玲,袁汉英.基因工程实验技术[M].2 版.长沙:湖南科学技术出版社,1997.
[9] ZHAO L C,CHENG A C,WANG M S,et al.Identification and characterization of duck enteritis virus dUTPase gene[J].Avian Dis,2008,52(2):324-331.
[10] PLUMMER P J,ALEFANTIS T,KAPLAN S,et al.Detection of duck enteritis virus by polymerase chain reaction[J].Avian Dis,1998,42:554-564.
[11] 谢芝勋,谢志勤,刘加波,等.用聚合酶链反应检测鸭瘟病毒的研究[J].中国兽药杂志,2000,34(4):10-12.
[12] 韩先杰,王君伟,布日额,等.PCR 检测鸭瘟病毒的研究[J].中国兽医科技,2003,33(8):10-14.
[13] PLUMMER P J,ALEFANTIS T,KAPLAN S,et al.Deteion of duck enteritis virus by polymerase chain reaction[J].Avian Diseases,1998,42:554-564.
[14] HANSENW R,NASHOLD S W,BEOWN S E,et al.Diagnosis of duck plague in waterfowl by polymerase chain reaction[J].Avian Dis,2000,44(2):266-274.
[15] LI Y,HUANG B.Molecular characterization of the genome of duck enteritis virus[J].Virology,2009,391(2):151-161.
[16] WANG J,HÖPER D.Complete genome sequence of virulent duck enteritis virus(DEV)strain 2085 and comparison with genome sequences of virulent and attenuated DEV strains[J].Virus Res,2011,160(1-2):316-325.
[17] 魏雪涛,张晓勇,李 银,等.鸭瘟病毒PCR 检测方法的建立[J].浙江农业学报,2010,22(6):750-753.
[18] 贺东生,赵善昌.光敏生物素标记鸭瘟病毒核酸探针的制备及应用的研究[J].广西农业大学学报,1993,12(3):69-74.
