双孢蘑菇子实体多糖的响应面法优化提取及其纯化
2014-12-23赵荷娟魏启舜
王 琳, 赵荷娟, 魏启舜, 周 影
(江苏丘陵地区南京农业科学研究所,江苏 南京210046)
双孢蘑菇因为其营养价值高、脂类含量低、口味佳等优点,几个世纪来一直是倍受人们喜爱的食物[1-4]。双孢蘑菇含有丰富的多糖,双孢蘑菇多糖具有清除自由基、防治败血症、抗炎镇痛、增强免疫力等功效,是一类无毒、无副作用的免疫活性物质[5-7]。常见的双孢蘑菇多糖的提取方法有水提法、碱提法、酶辅助提取法、微波助提法、超声波助提法等[8-12],其中热水浸提法是使用较为广泛的从植物中提取多糖的方法[13],但是提取时需要较高的温度和多次提取合并,具有耗能和耗时的缺点[14]。超声波辅助提取相对于其他提取方法具有速度快、对植物材料的细胞分子结构破坏较少[15]、并且能够在低温下提取[16]等优点,因此超声波提取现在广泛用于植物多糖的提取[17]。但目前采用超声波提取双孢蘑菇多糖的研究较少,在工艺优化上,多是在单因素或正交试验的条件下获得,而未建立多糖得率与考察因素间关系的数学模型,从而对过程的放大和优化生产的指导产生了局限性。响应面法是一种应用较广的试验优化方法,由于采用了较为合理的试验设计,能以很少的试验数量和时间对试验进行全面研究,可以快速有效地确定多因子系统的最佳条件,目前已经广泛地应用于各类条件优化试验。因此本研究应用响应面法优化超声波辅助提取的各个工艺参数,从而提高双孢蘑菇多糖的提取效率,并使用离子交换层析的方法将多糖进行纯化,测定每个组分的分子量,旨在为双孢蘑菇的进一步利用打下基础。
1 材料与方法
1.1 材料的准备
试验材料双孢蘑菇由江苏无锡祥云菇业有限公司提供,其品种名为AS2796。双孢蘑菇用自来水洗净后切片,放入烘箱60 ℃烘3 d 后粉碎过60目筛,装入塑料袋中密封储存在干燥黑暗的地方备用。
1.2 多糖的提取
准确称取一定量双孢蘑菇粉末放入烧杯中,加适量的蒸馏水浸泡30 min,然后将烧杯置于超声波破碎仪(南京先欧JY92-IIDN)中进行超声波处理。提取液在离心机中以4 500 r/min的速度离心15 min,得到上清液后真空浓缩,浓缩至原体积的1/5 左右。在浓缩液中加入3 倍体积4 ℃体积分数95% 的乙醇,于4 ℃的冰箱中放置10 h,然后在离心机中以4 500 r/min的速度离心15 min,弃上清液,得到多糖粗品。取多糖粗品加蒸馏水重新溶解后,利用Sevage法[18]去除多糖粗品中的蛋白质,即可得到双孢蘑菇粗多糖产品。
1.3 多糖得率的测定
采用硫酸-苯酚法[9],以葡萄糖为标准品,并按照以下公式计算:多糖得率= [(测得多糖质量×稀释倍数)/双孢蘑菇样品的称样质量] ×100%。
1.4 单因素试验设计
1.4.1 水料比对双孢蘑菇多糖得率的影响称取2 g 双孢蘑菇子实体干粉放入100 ml 的烧杯中,分别加入20 ml、40 ml、60 ml、80 ml、100 ml 水搅拌均匀,即水料比分别为10∶ 1、20∶ 1、30∶ 1、40∶ 1、50∶ 1。超声功率585 W,超声时间20 min,超声处理后离心取上清测定总糖含量。
1.4.2 超声功率对双孢蘑菇多糖得率的影响 称取2 g 双孢蘑菇子实体干粉放入100 ml 的烧杯中,加入40 ml 水搅拌均匀,超声波处理15 min,超声功率分别为405 W、495 W、585 W、675 W、765 W、855 W,测定总糖含量。
1.4.3 超声时间对双孢蘑菇多糖得率的影响称取2 g 双孢蘑菇子实体干粉放入100 ml 的烧杯中,加入40 ml 水搅拌均匀,超声功率为585 W,超声时间分别为10 min、15 min、20 min、25 min、30 min,测定总糖含量。
1.5 响应面法试验设计
根据超声波提取工艺的单因素试验结果,以水料比、超声时间、超声功率3 个因素为研究对象,以提取液中多糖含量为响应值设计Box-Benhnken 试验,研究各因素对双孢蘑菇子实体多糖得率影响的程度,优化提取工艺,试验因素水平及编码见表1。
1.6 回归模型验证试验
按照软件Design Expert 7.0 给出的最优参数进行试验,重复3 次,计算试验值与理论值之间的误差。
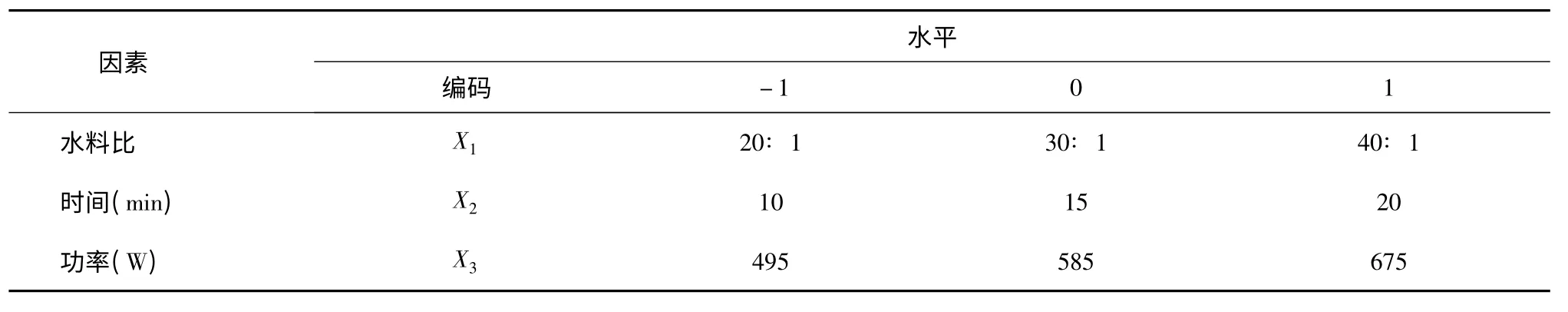
表1 响应面试验因素水平设计Table 1 Factors and levels in response surface analysis
1.7 多糖的分离纯化
将经过脱蛋白质、脱色的多糖样品溶于pH5、0.1 mol/L醋酸缓冲液,用0.45 μm 的滤膜过滤。使用纤维素离子交换层析纯化,层析柱规格1 cm×20 cm,用DEAE Sepharose F F 填料装柱,用0.1 mol/L、pH 5.0 醋酸缓冲液平衡。每次上样量为3 ml 10%的粗糖,先用2 倍柱体积缓冲液洗脱,再用0.2 mol/L NaCl(溶于pH 5.0 的0.1 mol/L HAc-NaAc缓冲溶液)进行线性洗脱,流速1 ml/min,每管收集3 ml。用苯酚-硫酸法检测多糖含量,绘制曲线,合并单峰部分冷冻干燥。
1.8 多糖分子量和纯度的测定
用高效凝胶渗透色谱(HPGPC)法检测样品纯度。采用装有凝胶过滤层析柱TSK-G4000 PWXL的安捷伦高效液相系统(Agilent 1100)。检测条件:样品浓度4 mg/ml,进样量20 μl,流动相0.2 mol/L氯化钠,流速0.6 ml/min,柱温30 ℃。示差折光检测器检测。
用高效体积排阻凝胶渗透色谱法(HPGPCSEC)确定多糖的分子量[19]。测定条件:色谱柱为Agilent PL aquagel-OH MIXED-H 8 μm,样品浓度为4 mg/ml,进样量为20 μl,洗脱流速为1.5 ml/min,柱温为30 ℃,流动相为0.2 mol/L NaCl,示差折光检测器检测。凝胶过滤柱通过葡聚糖标准品T-4.32、12.6、60.6、110、289、500 校正。
1.9 数据处理和统计分析
采用SPSS17.0 进行ANOVA 单因素方差分析及Ducan’s 多重检验。响应曲面优化及数据分析采用Design Expert7 .0 软件。
2 结果与分析
2.1 单因素试验
2.1.1 水料比对双孢蘑菇多糖得率的影响 水料比是提取过程中的一个重要影响因素,从传质速率的角度来说,主要表现在影响固相主体和液相主体之间的浓度差。溶剂用量越多,传质动力越大,扩散到溶剂里的多糖就越多[20]。但是在固液两相间,除了扩散溶解平衡外,还存在吸附平衡,低温有利于吸附。由于水料比的增大,在产生相同热量的条件下,提取液温度下降,吸附作用增强导致得率下降[21]。图1 显示,在开始阶段多糖的含量随着水料比的增大而增大,当水料比大于30∶ 1 时,浸提液中多糖的含量降低。统计分析结果表明,30∶ 1 与10∶ 1、20∶ 1、40∶ 1、50∶ 1 之间多糖的提取率差异显著(P<0.05),20∶ 1、40∶ 1、40∶ 1 与50∶ 1 之间差异不显著(P>0.05)。表明,水料比小于30∶ 1 时,水料比与双孢蘑菇提取率的影响正向显著,大于30∶ 1时则负向显著,因此选择水料比30∶ 1 作为响应面试验设计的中心点。
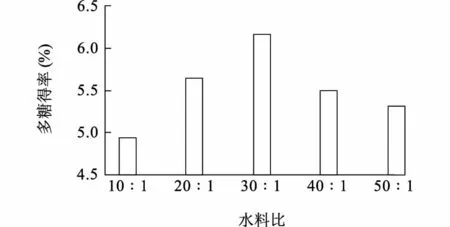
图1 水料比对双孢蘑菇多糖得率的影响Fig.1 Effects of water to solid ratio on the yield of Agaricus bisporus polysaccharides
2.1.2 超声时间对双孢蘑菇多糖得率的影响 随着超声时间延长,多糖得率先增大后降低,在15 min时达到最大(图2)。因为随着超声处理时间延长、细胞破碎程度增大,细胞内部的多糖物质开始向外扩散,使得溶剂中多糖的含量迅速升高。但超声波具有较强的剪切作用,时间过长会使大分子的多糖链断裂,多糖发生部分降解[22],造成多糖含量下降。统计分析结果表明,超声时间15 min 与其他超声时间处理之间对多糖的提取率具有显著差异(P>0.05),因此,以超声时间15 min 作为响应面设计的中心点。
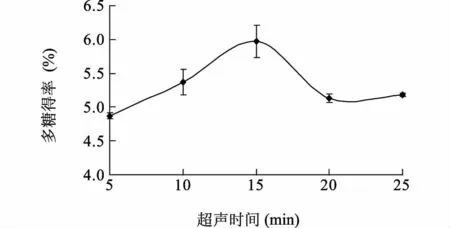
图2 超声时间对双孢蘑菇多糖得率的影响Fig.2 Effects of ultrasonic extraction time duration on the yield of A.bisporus polysaccharides
2.1.3 超声功率对双孢蘑菇多糖得率的影响 随着超声功率的提高,浸提液中多糖的含量也先增大后降低(图3)。增大超声波功率强化传质同时使细胞的破碎程度增加,从而有利于多糖的提取。然而当超声功率过大时,会引起部分多糖的降解。统计分析结果表明:超声功率585 W 处理与405 W、495 W、765 W、855 W 处理之间多糖的提取率有显著差异(P<0.05),585 W 与675 W 处理之间多糖的提取率差异不显著(P>0.05),而675 W 处理除了与405 W 处理之间多糖提取率差异显著(P<0.05)外,与其他处理不显著(P>0.05)。因此,选择超声功率585 W 作为响应面试验设计的中心点。
2.2 响应曲面试验
2.2.1 试验结果 综合单因素试验结果,选择水料比(X1)、超声时间(X2)、超声功率(X3)3 个因素所确定的水平范围,用Design-Expert 7.0 软件设计响应面试验。根据Box-Benhnken 设计原理,以双孢蘑菇多糖含量为响应值,进行3 因素3 水平共17 个试验点的响应面分析。试验以随机次序进行,结果见表2。双孢蘑菇多糖的得率从4.84%到6.41%。当水料比为30∶ 1 时,超声功率为585 W,超声时间为15 min 时多糖的得率最高,为6.41%。
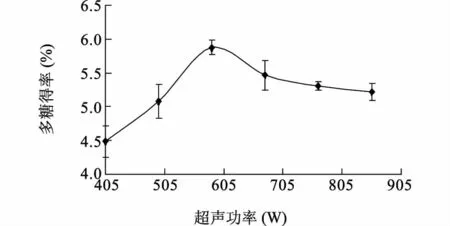
图3 超声功率对双孢蘑菇多糖得率的影响Fig.3 Effects of ultrasonic extraction power on the yield of A.bisporus polysaccharides
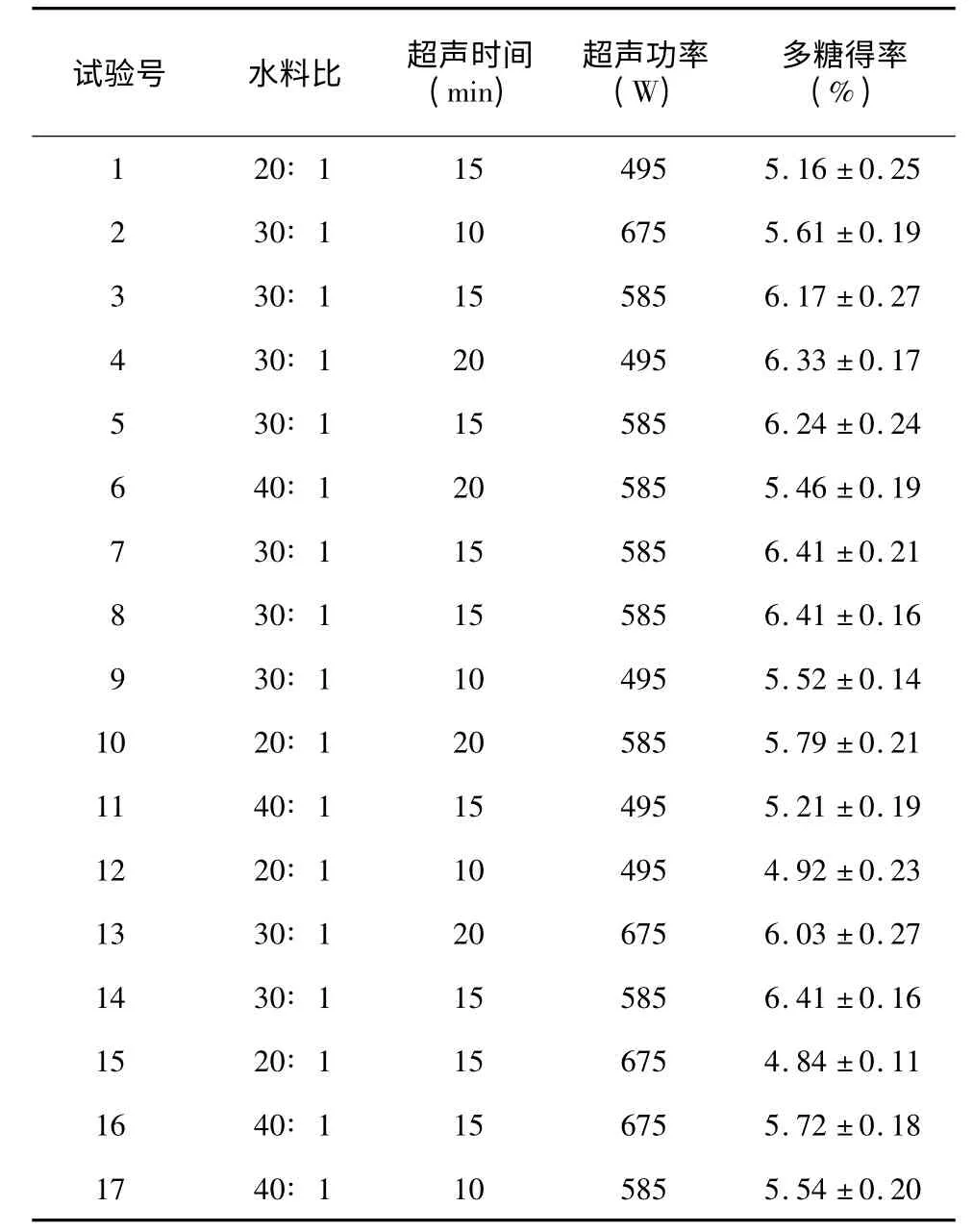
表2 响应面优化试验设计及结果Table 2 Designs of three factors and polysaccharides yields
模型方差分析结果(表3)表明,对多糖得率所建立的二次多项模型具有高度显著性(P=0.000 2<0.01)。失拟项P=0.207 9,大于0.05,不显著;模型的调整确定系数R2=0.924 6,该模型能解释92.46%响应值的变化,因而该模型拟合程度比较好,试验误差小,可以用此模型对超声波提取双孢蘑菇多糖进行分析和预测。
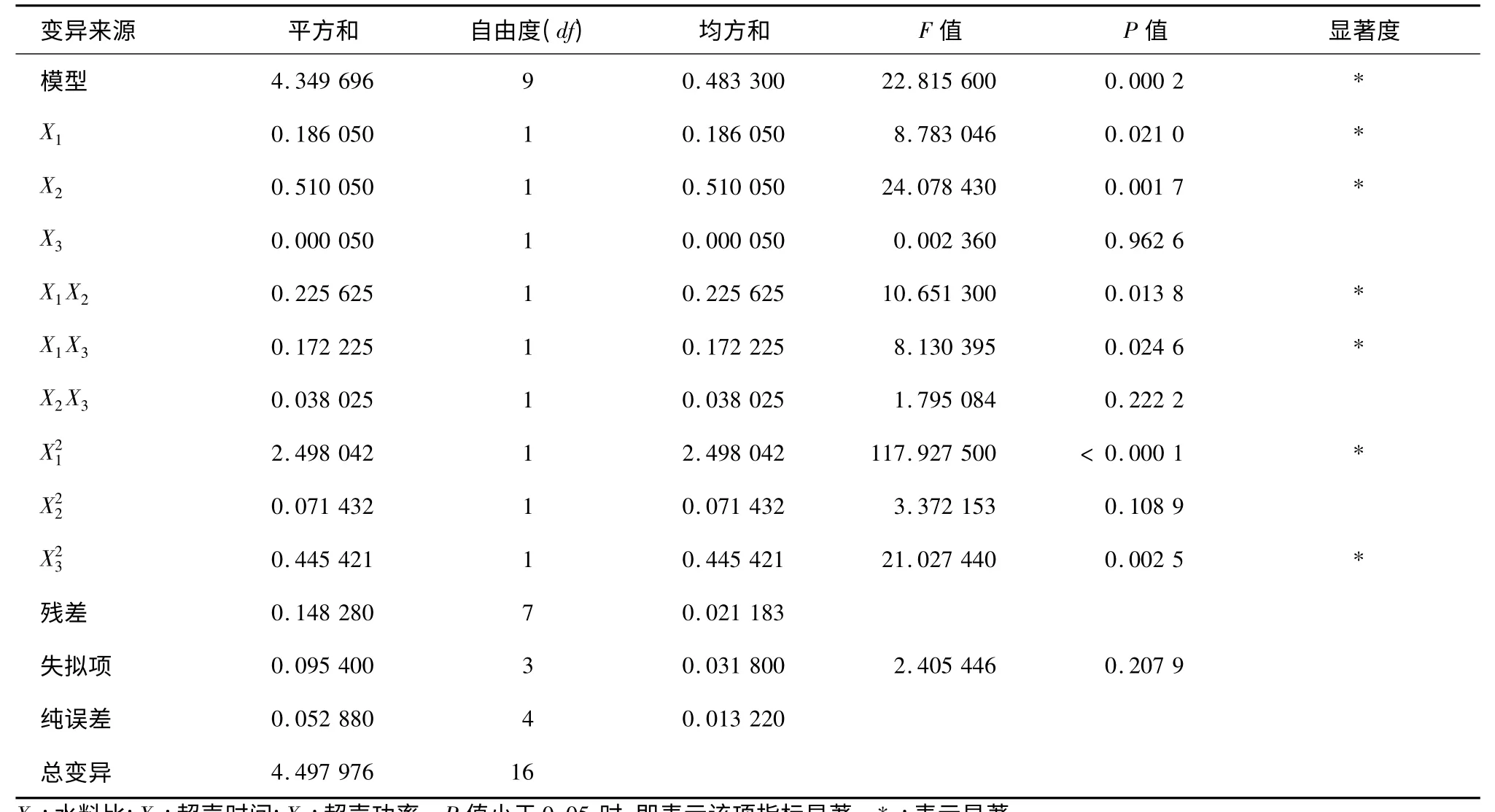
表3 双孢蘑菇多糖提取回归模型方差分析表Table 3 Variance analysis of regression model for A.bisporus polysaccaride extraction
模型方程回归系数及其显著性检验结果(表3)表明:模型一次项X1、X2极显著,X3不显著;二次项X1、X3极显著,X2显著;交互项X2X3不显著,X1X2、X1X3极显著。由F值可知,3 因素对多糖提取效率影响大小依次为时间>水料比>超声功率。因此各个具体试验因素与响应值都不是线性关系。
2.2.2 拟合模型 对数据进行多元回归分析,获得二次多元回归方程:Y= 6.330 0 - 0.160 0X1+0.150 0X2+0.250 0X3-0.002 5X1X2-0.240 0X1代表多糖的得率(%),X1、X2、X3分别代表水料比、超声时间、超声功率。
2.2.3 响应面分析 通过模型方程所作的响应曲面图及其等高线(图4)显示,多糖得率随各两因素的增加先呈上升趋势,随后略有下降。等高线的形状为椭圆形时表示交互作用强,为圆形时表示交互作用弱。由图4 可知,各两因素交互作用的等高线均呈椭圆形,说明各两因素之间交互作用明显。而从等高线密度沿坐标轴的变化可知,沿水料比轴、超声时间轴向等高线均比超声功率轴向的密,表明超声功率对多糖得率的影响最小,与表2 数据一致。
通过软件分析,超声波提取双孢蘑菇多糖的最佳条件为超声时间16.87 min、超声功率596.91 W、水料比为35.99∶ 1.00。在此条件下多糖得率可达6.17%。为检验响应面法法的可靠性,采用上述最优提取条件进行多糖的超声波提取试验,同时考虑到实际操作情况,将多糖最佳提取条件修正为水料比36∶ 1、超声时间17 min、超声功率594 W,实际测得的多糖得率为6.63%,与理论预测值比较误差为6.9%。因此采用响应曲面法优化得到的超声波提取条件参数基本准确可靠,具有一定的实用价值。
2.3 粗糖的分离纯化
如图5 所示,DEAE Sepharose F F 层析柱对双孢蘑菇多糖具有良好的分离效果。经过梯度洗脱得到2 个洗脱峰,说明双孢蘑菇多糖至少含有2 个多糖组分,命名为A I 和A II。收集各单峰部分,经苯酚-硫酸法检测,可知每个组分所占比例不同,不含NaCl 的缓冲液洗脱组分A I 占大部分,NaCl 梯度洗脱的组分A II 占少部分。
A I 和A II 的液相色谱图见图6,A I 的保留时间为5.124 min,A II 的保留时间为5.783 min,纯度分别为74%和73%,说明组分还有部分杂质,可以继续通过凝胶色谱柱进一步分离纯化。AⅠ和AⅡ的分子量分别为2.75 ×105和1.4 ×104。
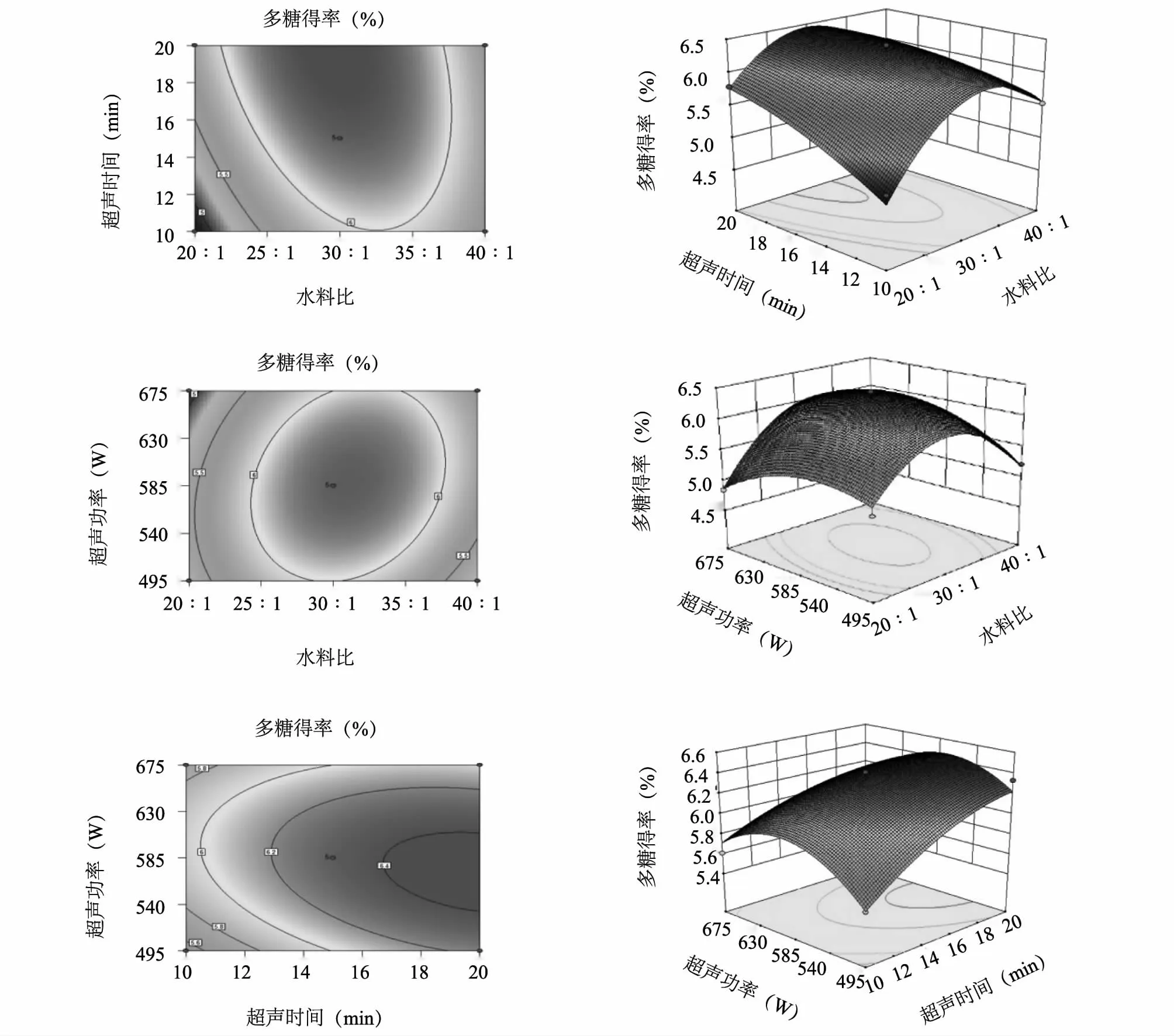
图4 不同因素对双孢蘑菇多糖提取率影响的响应曲面和等高线Fig.4 Response surface and contour showing the effects of different extraction parameters on yield of Agaricus bisporus polysaccharides
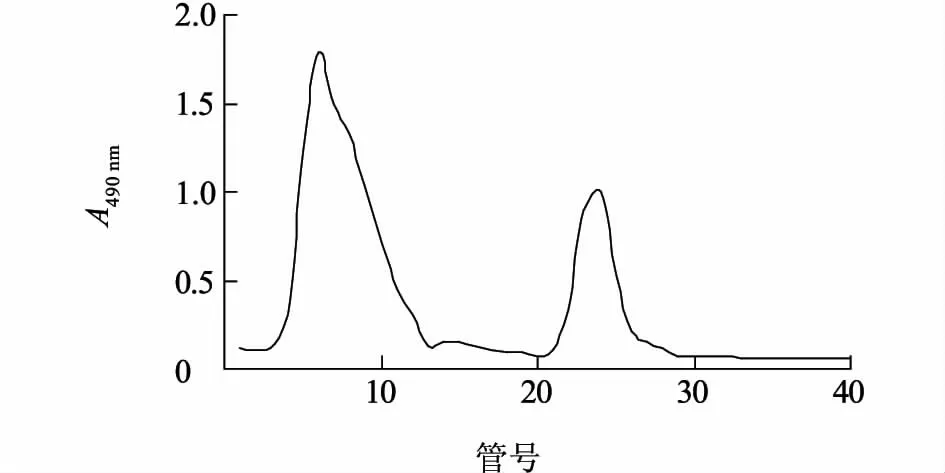
图5 双孢蘑菇多糖DEAE Sepharose F F 柱层析Fig.5 Elution profile of polysaccharides from A.bisporus through DEAE Sepharose F F column
3 讨论
近年来,超声波技术已广泛应用于功能成分的提取,具有提取效率高、提取时间短的特点,而且提取过程无需高温,避免了因高温对功能成分分子结构的破坏,是双孢蘑菇多糖工业比较理想的一种提取新工艺。通过对从双孢蘑菇子实体中提取多糖的工艺条件的单因素和响应曲面分析,得到超声波辅助提取双孢蘑菇多糖的最佳工艺条件为:超声时间17 min,超声功率594 W,水料比36∶ 1,在此条件下多糖得率为6.63%。
利用超声波辅助提取效率高,操作简便。乔德亮等[18]利用热水浸提双孢蘑菇多糖的得率为3.51%,而本研究通过超声波辅助提取多糖的得率为6.63%,超声波辅助提取大大提高了多糖的提取效率。Tian 等[23]利用响应面法优化双孢蘑菇多糖的提取工艺,得到最佳提取参数为:超声功率为230 W,提取温度70 ℃,提取时间62 min,水料比为30 ∶ 1,多糖的提取率为6.02%。本试验在提取中加大了超声功率,使用常温提取,避免了高温对多糖分子的破坏,节约能源,缩短了提取时间。本研究结果表明使用响应面法优化超声波辅助提取双孢蘑菇子实体多糖的工艺参数是有效可行的。
不同品种的双孢蘑菇所含多糖的组分并不一样,目前报导的纯化双孢蘑菇多糖均为单一成分。高宏伟等[24]从双孢蘑菇菌丝中分离出的胞内多糖以及Tian 等[23]从双孢蘑菇子实体中分离的多糖都由β-糖苷键组成,分子量均为1.58 ×105。Mao 等[7]从双孢蘑菇(Agaricus bisporusMJ-0811)中也分离出一种多糖,而本试验通过离子层析柱从双孢蘑菇(Agaricus bisporusAS2796)的多糖中分离出2 个组分的多糖,分子量分别为2.75 ×105和1.4 ×104。不同组分不同分子量的多糖结构有所差异从而有着不同的活性,对不同组分的多糖结构和活性分析是我们下一步要做的工作。
[1] CHIANG P D,YEN C T,MAU J L.Non-volatile taste components of canned mushrooms[J].Food Chemistry,2006,97(3):431-437.
[2] LIU Z Q,ZHOU J H,ZENG X L,et al.The enhancement and encapsulation ofAgaricus bisporusflavor[J].Journal of Food Engineering,2004,65(3):391-396.
[3] 张黎杰,姜若勇,王夏雯,等.新型菇菜连棚共生模式对环境因子的影响[J].江苏农业科学,2013,41(4):131-133.
[4] 于建光,李瑞鹏,常志州,等.双孢蘑菇菇渣不同堆制方式制作有机肥试验研究[J].江苏农业科学,2013,41(2):334-335.
[5] RUTHES A C,RATTMANN Y D,MALQUEVICZ O S M,et al.Agaricus bisporusfucogalactan:Structural characterization and pharmacological approaches[J].Carbohydrate Polymers,2013,92(1):184-191.
[6] YING Z,HAN X,LI J.Ultrasound-assisted extraction of polysaccharides from mulberry leaves[J].Food Chemistry,2011,127(3):1273-1279.
[7] MAO Y,MAO J,MENG X.Extraction optimization and bioactivity of exopolysaccharides fromAgaricus bisporus[J].Carbohydrate Polymers,2013,92(2):1602-1607.
[8] 熊 泽,邵 伟,黄 艺.双孢磨菇多糖提取工艺优化研究[J].三峡大学学报:自然科学版,2007,29(4):367-370.
[9] 高振鹏,袁亚宏,岳田利,等.超声波辅助提取双孢蘑菇多糖的研究[J].西北农林科技大学学报:自然科学版,2012,40(7):215-220.
[10] 吴 疆,班立桐.应用双水相萃取技术提取双孢蘑菇多糖的研究[J].食品研究与开发,2011(7):4-7.
[11] 邹 伟,张宝善,李 冰,等.水浴振荡辅助酶法提取双孢蘑菇多糖的工艺研究[J].食品工业科技,2011(5):223-224.
[12] 林 魁,魏云华,张燕青.酶法提取双孢蘑菇多糖工艺研究[J].现代农业科技,2012(18):289-290.
[13] LAI L S,YANG D H.Rheological properties of the hot-water extracted polysaccharides in Ling-Zhi (Ganoderma lucidum)[J].Food Hydrocolloids,2007,21(5):739-746.
[14] ZHONG K,WANG Q.Optimization of ultrasonic extraction of polysaccharides from dried longan pulp using response surface methodology[J].Carbohydrate Polymers,2010,80(1):19-25.
[15] VILKHU K,MAWSON R,SIMONS L,et al.Applications and opportunities for ultrasound assisted extraction in the food industry—A review[J].Innovative Food Science & Emerging Technologies,2008,9(2):161-169.
[16] GANG X,HONG Z,JIAN H.Leaching method of flavone from bamboo leaves [J].Chinese Journal of Analytical Chemistry,2000,28(7):857-859.
[17] PAN Y,HAO Y,CHU T,et al.Ultrasonic-assisted extraction,chemical characterization of polysaccharides from Yunzhi mushroom and its effect on osteoblast cells[J].Carbohydrate Polymers,2010,80(3):922-926.
[18] 乔德亮,陈乃富,张 莉,等.双孢蘑菇子实体多糖提取条件优化及部分特性研究[J].食品与发酵工业,2011,23(2):195-199.
[19] LUO L,WU M,XU L,et al.Comparison of physicochemical characteristics and anticoagulant activities of polysaccharides from three sea cucumbers[J].Marine Drugs,2013,11(2):399-417.
[20] BENDAHOU A,DUFRESNE A,KADDAMI H,et al.Isolation and structural characterization of hemicelluloses from palm ofPhoenix dactyliferaL.[J].Carbohydrate Polymers,2007,68(3):601-608.
[21] 冯年平,郁 威.中药提取分离技术原理与应用[M].北京:中国医药科技出版社,2005.
[22] 李钟玉,张京东,李临生.超声波法提取灵芝多糖的研究[J].中国食用菌,2004,23(2):42-44.
[23] TIAN Y T,ZENG H L,XU Z B,et al.Ultrasonic-assisted extraction and antioxidant activity of polysaccharides recovered from white button mushroom (Agaricus bisporus)[J].Carbohydrate Polymers,2012,88(2):522-529.
[24] 高宏伟,李兆兰,刘志礼,等.双孢蘑菇胞外多糖及胞内多糖的分离纯化和化学结构分析[J].南京中医药大学学,1997,15(4):224-225.
