高磁场响应性蛋白偶联磁性微球的制备及其在药物-蛋白结合常数测定中的应用
2014-12-23潘晓霞
潘晓霞
(天津大学 药物科学与技术学院,天津 300072)
药物进入体内一般都要通过血浆的贮存和转运,到达作用部位,发生药理作用。血清白蛋白是血浆中含量最丰富的载体蛋白,药物与白蛋白之间的作用,影响药物在体内的分布、代谢与排泄,从而影响药物的作用强度和时间。因此,药物与白蛋白相互作用的研究无论对于新药研发还是指导临床合理用药都具有重要意义[1-3]。
常用的研究药物与白蛋白相互作用的方法有平衡透析法、超滤法、紫外-可见吸收光谱法、荧光光谱法、圆二色谱法以及亲和色谱法和核磁共振法等[3-5]。其中平衡透析法、超滤法等传统方法存在步骤繁琐、药物在透析膜或超滤膜表面的吸附问题[6];紫外-可见吸收光谱法、荧光光谱法、圆二色谱法等光谱学方法[7]要求受体蛋白有较高的纯度,对于一些昂贵的受体蛋白研究很不利,且蛋白与药物的结合时间和结合温度难以准确控制。亲和色谱法是将蛋白固定于载体上,固定化的生物高聚物具有良好的稳定性和恒定的结合行为,但不易表征,且非生理实验条件可能改变蛋白质的构象和蛋白与药物的结合行为[8]。核磁共振法能提供大量蛋白结构信息,复杂程度也最高,但此法不适宜定量研究,且解析实验数据非常耗时[9-10]。
近年来,磁性微球在生物化学和生物技术学方面的应用受到广泛关注。用修饰蛋白的磁性微球研究药物与蛋白的相互作用,通过测定游离的药物浓度,计算药物与蛋白的结合常数,这种方法高效、快速[11-12]。但是使用的磁性微球磁响应性低,对药物的非特异性吸附明显;蛋白在磁性微球上的键合量低,需要使用较低浓度的药物,不利于药物的检测;而且缺乏对药物-蛋白作用模式的研究。针对以上问题,本课题以与人血清白蛋白(HSA)高度同源的牛血清白蛋白(BSA)为模型蛋白[13],通过对磁性微球基质的筛选、磁性微球与BSA 偶联条件的优化及药物与BSA 的结合、洗脱条件的研究,建立了一种新的用BSA 包覆的磁性微球用于测定药物-白蛋白结合常数的方法。该方法克服了前人工作中磁性微球磁响应低、对药物非特异性吸附强及蛋白在磁性微球上键合量低的缺点,并且对药物与蛋白的作用模式作了进一步探讨。
1 实验部分
1.1 试剂与仪器
牛血清白蛋白,分子生物学级,纯度98%;1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC);N-羟基琥珀酰亚胺(NHS)、戊二醛(纯度50%)、吡啶、甘氨酸、考马斯亮蓝G250 均为分析纯;布洛芬、色氨酸、罗氟司特、安立生坦、瑞替加滨均为医药级;表面氨基化的四氧化三铁磁性微球(Fe3O4-MB)、脲醛树脂磁性微球(UF-MB)、聚苯乙烯磁性微球(PSMB)均为色谱纯。
岛津高效液相色谱仪(包括LC-600 恒流泵,SPD-6AV 紫外检测器和N2000 色谱工作站);岛津UV-2450 紫外-可见分光光度计;C18色谱柱(250 mm×4.6 mm,5 μm)。
1.2 BSA 包覆的磁性微球的制备
分别采用EDC/NHS 和戊二醛作为偶联剂,将BSA 偶联至氨基修饰的磁性微球上。
1.2. 1 EDC/NHS 法 100 mg 磁性微球分散于2 mL 磷酸盐缓冲液(PBS 缓冲盐,10 mmol/L,pH 7.4)中,加入50 mg EDC,25 mg NHS 和适量BSA,室温振荡反应2 h。磁分离,保留上清,磁性微球用PBS 洗涤3 次。
1.2.2 戊二醛法 100 mg 磁性微球用吡啶缓冲液(10 mmol/L,pH 5.5)洗涤后,分散于2 mL 含5%戊二醛的吡啶缓冲液中,37 ℃反应5 h。用吡啶缓冲液洗涤磁性微球3 次;再将磁性微球分散于2 mL 吡啶缓冲液中,加入适量BSA,37 ℃反应16 h。磁分离,收集上清,磁性微球加入1 mL 甘氨酸终止液(1 mol/L,pH 8.0),于37 ℃反应1 h,用PBS 溶液洗涤3 次。
1.3 布洛芬与MB-BSA 上的相互作用
1.3.1 平衡吸附时间的考察在1.5 mL 的离心管中,加入200 μL MB-BSA(50 mg/mL)和200 μL 布洛芬(10 μmol/L),37 ℃振荡反应不同时间,磁分离,上清用高效液相色谱(HPLC)检测布洛芬的浓度。
1.3.2 洗脱条件的考察布洛芬与MB-BSA 作用后,收集上清,用HPLC 检测布洛芬的含量;用洗脱液将布洛芬洗脱后,将MB-BSA 再次与布洛芬作用,如此重复6 次。
1.3.3 结合常数的测定将布洛芬用PBS 缓冲盐溶解并稀释至不同浓度(1.0 ~40.0 μmol/L)。在1.5 mL 的离心管中加入 200 μL MB-BSA(50 mg/mL)和200 μL 一系列不同浓度的布洛芬,37 ℃振荡反应,磁分离,上清用高效液相色谱(HPLC)检测布洛芬的浓度,通过罗森塔尔方程[11-12]计算布洛芬与BSA 的结合常数。
1.4 药物和MB-BSA 的结合
步骤同1.5.2 节,测定色氨酸、安立生坦、瑞替加滨和罗氟司特4 种药物与BSA 的结合常数。
1.5 分析方法
1.5.1 蛋白键合量的测定采用Bradford 蛋白定量法,通过考马斯亮蓝G250 与蛋白的显色反应,测定键合前后上清液中的蛋白含量的变化,计算磁性微球上BSA 的键合量。
1.5.2 布洛芬的含量测定 HPLC 检测条件C18色谱柱(250 mm×4.6 mm,5 μm),流动相为甲醇/pH 2.5 的磷酸水溶液(85/15),速流1 mL/min,检测波长222 nm,进样量20 μL。
1.5.3 四种药物的含量测定
1.5.3.1 色氨酸流动相为甲醇/pH 2.5 的磷酸水溶液(35/65),检测波长225 nm。
1.5.3.2 安立生坦流动相为甲醇/pH 2.5 的磷酸水溶液(75/25),检测波长220 nm。
1.5.3.3 瑞替加滨流动相为甲醇/pH 2.5 的磷酸水溶液(60/40),检测波长220 nm。
1.5.3.4 罗氟司特流动相为甲醇/pH 2.5 的磷酸水溶液(80/20),检测波长213 nm。
2 结果与讨论
2.1 磁性载体的选择
药物与BSA 结合的同时,也会在载体磁性微球上产生非特异性吸附。磁性微球对药物的非特异性吸附越高,药物与BSA 之间的特异性吸附越不明显,实验误差就越大。因此,应当保证尽量低的非特异性吸附。对几种常用的商品化的磁性微球——UF-MB、PS-MB 和Fe3O4-MB 和对瑞替加滨、布洛芬、色氨酸3 种药物的非特异性吸附进行了考察,结果见图1。

图1 不同基质磁性微球对不同药物的空白吸附Fig.1 Nonspecific binding of different drugs to different MB
由图1 可知,UF-MB 和PS-MB 对布洛芬和色氨酸的非特异性吸附较低,而对瑞替加滨的非特异性吸附较明显;Fe3O4-MB 对3 种药物的非特异性吸附均较低,在10% 以下。在pH 7.4 的环境下,磁性微球表面的氨基带正电,瑞替加滨、布洛芬和色氨酸分别带正电、负电以及不带电,但是3 种磁性微球对布洛芬和色氨酸的非特异性吸附均较弱,说明药物与磁性微球表面的氨基之间的静电作用不是引起非特异性吸附的主要原因。由于UF-MB 内部较疏松,骨架中含有丰富的胺、酰基和羟基,PS-MB 也含有疏水性骨架,而瑞替加滨的极性最弱,药物分子易透过外面的包覆层与骨架通过疏水作用结合,导致了较高的吸附量;Fe3O4-MB 只能通过表面包覆的硅羟基和铁羟基与药物发生作用,因而对药物吸附较少。此外Fe3O4-MB 制备简单,磁响应性高(饱和磁化率>70 emu/g),比表面积大,有利于磁分离及进一步的蛋白修饰,因此,实验中选择四氧化三铁磁性微球为载体。
2.2 蛋白键合量
EDC 与NHS 联合使用,与蛋白上的羧基反应,形成活性中间体,该活性中间体与磁性微球上的氨基脱水形成酰胺键。戊二醛则是通过分子两端的醛基分别与蛋白和磁性微球上的氨基形成亚胺,从而将蛋白固定于微球上,结果见图2。
由图2 可知,当BSA 加入量较少时,蛋白键合量较低,但体系中BSA 几乎完全与磁球偶联,蛋白利用率接近100%;随着BSA 用量的增加,蛋白键合量随之增加,而蛋白利用率也随之降低;当BSA 与磁性微球的质量比达到100 μg/mg 左右时,键合量达到饱和,不再增加。EDC 法的蛋白最大键合量为44 μg/mg,蛋白利用率为44%;戊二醛法的最大键合量为49 μg/mg,蛋白利用率为49%。两种方法均比报道显著提高[11],使得研究药物-蛋白相互作用时可以使用较少的磁性微球,减少非特异性吸附的影响;同时可以使用较高的药物浓度,提高分析方法的准确度。两种方法的最大键合量相近,因EDC 法步骤简单。因此,实验中选择的蛋白偶联条件为:用EDC/NHS 作为偶联剂,BSA 与磁性微球的质量比为100 μg/mg。

图2 EDC/NHS 法(a)和戊二醛法(b)的蛋白键合量Fig.2 Binding capacity of BSA to MB by EDC/NHS method (a)and glutaraldehyde method (b)
2.3 布洛芬与MB-BSA 的作用
BSA 的晶体结构有3 个类似的结构域:I、II、III,每个结构域有2 个亚域结构A 和B,这些亚域结构被命名为IA、IB、IIA、IIB、IIIA 和IIIB,而药物分子主要结合在亚域结构IIA 和IIIA,其中,IIIA 中的结合空腔最活跃,布洛芬、色氨酸等药物是在结构域IIIA 结合的典型药物[14-15]。本课题以布洛芬为模型药评价该方法,研究布洛芬与MB-BSA 的平衡作用时间、布洛芬在MB-BSA 上的洗脱及MB-BSA 的重复利用性,并测定布洛芬与BSA 的结合常数。
2.3.1 MB-BSA 对布洛芬的吸附时间布洛芬与空白磁性微球和BSA 包覆的磁性微球作用前后的上清液色谱图,结果见图3。
由图3 可知,BSA 包覆的磁性微球对布洛芬具有明显的吸附作用,而空白磁性微球对布洛芬几乎没有吸附作用。

图3 对照组和实验组磁性微球与布洛芬作用前后上清中布洛芬液相色谱图Fig.3 HPLC analysis of ibuprofen of collected supernatant from control MB and MB-BSA
以布洛芬为模型药物,考察了MB-BSA 与药物的作用时间对结合量的影响,结果见图4。
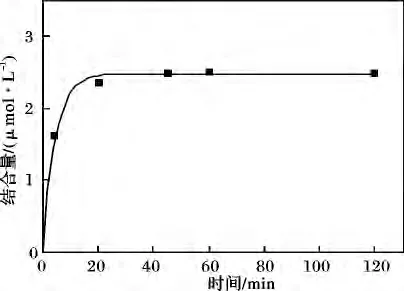
图4 MB-BSA 与布洛芬作用时间对结合量的影响Fig.4 Equilibrium binding time of ibuprofen to MB-BSA
由图4 可知,布洛芬在20 min 之前与MB-BSA迅速作用,并在20 min 达到吸附平衡。因此,固定MB-BSA 与药物的作用时间为20 min。
2.3.2 洗脱条件及MB-BSA 的重复利用性以布洛芬为模型药物,研究药物与BSA 的相互作用模式,结果见图5。
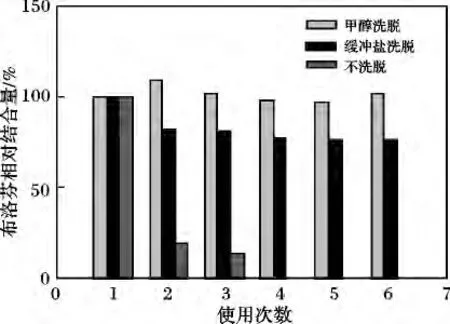
图5 用不同溶液洗脱MB-BSA 对布洛芬的相对吸附量的影响Fig.5 Relative binding amount of ibuprofen on MB-BSA of repeated use
由图5 可知,不洗脱时,随着重复使用次数的增加,MB-BSA 对布洛芬的结合量逐渐降低,在第4 次利用时,吸附量几乎为零,说明此时MB-BSA 对布洛芬的吸附达到了饱和。用纯甲醇洗脱后,MB-BSA对布洛芬的吸附量几乎没有变化;用缓冲盐洗脱后,MB-BSA 对布洛芬的相对吸附量约为80%。这说明BSA 与布洛芬之间存在疏水作用力和静电作用力,其中疏水作用力占主导。当用甲醇作为洗脱剂时,甲醇破坏了BSA 与布洛芬之间的疏水作用力,布洛芬从BSA 上完全解吸附;缓冲盐破坏了BSA 与布洛芬之间的静电作用,而疏水作用力仍存在,因此,布洛芬从BSA 上部分解吸附。另一方面,用甲醇作为洗脱剂并不影响MB-BSA 的重复利用,与文献中有机溶剂会影响BSA 活性的报道[16]并不相符,这是由于洗脱后BSA 在缓冲盐体系中又复性的缘故。用甲醇作为洗脱剂对MB-BSA 进行重复利用6 次,磁性微球对药物的吸附几乎不变,说明该MB-BSA可以重复利用。
2.3.3 布洛芬与BSA 的结合常数药物与蛋白的作用是一个动态过程,用S 代表蛋白上的位点,D 代表药物小分子,DB代表蛋白-药物分子复合物。假设药物与蛋白上的结合位点进行可逆结合,并且每个结合位点完全相同,且互不影响,则有:

当药物与蛋白的作用达到平衡时,药物与蛋白的结合常数Ka为:

假设蛋白上所有活性位点的浓度为Bmax,则整理式(2)可得罗森塔尔方程:

[DB]即结合药物的浓度,[D]为游离药物的浓度,用[DB]/[D]对[DB]作图,斜率即为Ka值。
图6 和图7 分别为布洛芬在MB-BSA 上的饱和吸附曲线及罗森塔尔曲线。可以计算布洛芬的Ka值为0.71 ×106L/mol,比Vowles 等[17]报道的数值0.47 ×106L/mol 大,比Kober 等[18]报道的数值1.3×106L/mol 小,与测定方法有关。
2.4 药物与BSA 的结合常数
各药物在MB-BSA 上的饱和吸附曲线图,结果见图6。
由图6 可知,随着药物浓度的增加,吸附量随之增加并趋于饱和。

图6 不同药物在MB-BSA 上的饱和吸附曲线Fig.6 Adsorption curve of different drugs on MB-BSA
不同药物的罗森塔尔曲线图,结果见图7。

图7 不同药物的罗森塔尔曲线Fig.7 Rosenthal plots obtained from incubation of different drugs with MB-BSA
由图7 可知,色氨酸及3 类新药安立生坦、瑞替加滨、罗氟司特与BSA 的结合常数与布洛芬的结合常数均在一个数量级上。
3 结论
建立了一种用BSA 包覆的Fe3O4磁球用于测定药物与白蛋白结合常数的方法,并测定了5 种药物与牛血清白蛋白的结合常数。通过选用对药物非特异性吸附小的Fe3O4磁性微球作为载体和优化蛋白键合方法,提高了方法准确度。用甲醇作为洗脱剂洗脱药物-蛋白复合物,可以实现对该磁性微球的重复利用。该方法快速、简单,对于新药研发和指导临床合理用药都具有重要意义。
[1] 高保安,陈建明. 药物与白蛋白相互作用的研究进展[J].药学实践杂志,2008,26(4):241-244.
[2] Bohnert T,Gan L S.Plasma protein binding:From discovery to development[J]. Journal of Pharmaceutical Sciences,2013,102(9):2953-2994.
[3] Zhang F L,Xue J P,Shao J W,et al.Compilation of 222 drugs’plasma protein binding data and guidance for study designs[J]. Drug Discovery Today,2012,17(9/10):475-485.
[4] 周大炜,李乐道,李发美.药物蛋白结合作用的分析方法研究[J].色谱,2004,22(2):116-120.
[5] 刘睿,谢跃生,潘桂湘,等. 药物血浆蛋白结合率测定方法的研究进展[J]. 天津中医药,2007,24(6):526-528.
[6] Barré J,Chamouard J M,Houin G,et al.Equilibrium dialysis,ultrafiltration,and ultracentrifugation compared for determining the plasma-protein-binding characteristics of valproic acid[J]. Clinical Chemistry,1985,31(1):60-64.
[7] Tajmir-Riahi H A.An overview of drug binding to human serum albumin:Protein folding and unfolding[J].Scientia Iranica,2007,14(2):87-95.
[8] Baynham M T,Patel S,Moaddel R,et al.Multidimensional on-line screening for ligands to the α3β4neuronal nicotinic acetylcholine receptor using an immobilized nicotinic receptor liquid chromatographic stationary phase[J].Journal of Chromatography B,2002,772(1):155-161.
[9] Meyer B,Peters T. NMR spectroscopy techniques for screening and identifying ligand binding to protein receptors[J].Angewandte Chemie International Edition,2003,42(8):864-890.
[10] Goldflam M,Tarragó T,Gairí M,et al. NMR studies of protein-ligand interactions[J]. Methods in Molecular Biology,2012,831:233-259.
[11]MarszaM P,Bucińsk A.A protein-coated magnetic beads as a tool for the rapid drug-protein binding study [J].Journal of Pharmaceutical and Biomedical Analysis,2010,52:420-424.
[12]MarszaM P,Bucińsk A,Kruszewski S. A new approach to determine camptothecin and its analogues affinity to human serum albumin[J]. Pharmacokinetics,Pharmacodynamics and Drug Metabolism,2011,100:1142-1146.
[13]Gelamo E L,Silva C H P T,Imasato H,et al. Interaction of bovine (BSA)and human (HSA)serum albumins with ionic surfactants:Spectroscopy and modeling [J].Biochimica et Biophysica Acta (BBA)-Protein Structure and Molecular Enzymology,2002,1594(1):84-89.
[14]谢余寰.酚酸类及生物碱类药物小分子和牛血清蛋白相互作用研究[D].桂林:广西师范大学,2008.
[15]周大炜.药物-蛋白结合作用的HPCE 和HPLC 法研究[D].沈阳:沈阳药科大学,2003.
[16]王秋玲,潘晓霞,吕波.磁性微球用于蛋白-抑制剂复合物解离常数的快速测定[J]. 应用化工,2013,42(5):950-954.
[17]Vowles D T,Marchant B.Protein binding of ibuprofen and its relationship to drug interaction[J]. British Journal of Clinical Practice Supplement,1979,6:13-19.
[18]Kober A,Sjoholm I.The binding sites on human serum albumin for some nonsteroidal anti-inflammatory drugs[J].Molecular Pharmacology,1980,18:421-426.
