1212例肾上腺淋巴瘤的影像学表现分析△
2014-12-22王小艺吴宁赵燕风梁晶张雯杰
王小艺 吴宁# 赵燕风 梁晶 张雯杰
中国医学科学院北京协和医学院肿瘤医院1影像诊断科,2病理科,3PET-CT中心,北京 100021
肾上腺淋巴瘤罕见,淋巴瘤首诊患者占1%~4%,而尸检约为25%[1-3],绝大多数为非霍奇金淋巴瘤的高度恶性亚型,且多为继发性,常与腹膜后淋巴结受侵同时存在。原发性肾上腺淋巴瘤极为罕见[4],组织学亚型多为弥漫性大B细胞型,有文献报道其发病与免疫功能低下有关[5],预后极差,如怀疑此病应及时活检,若确诊则须尽早实施治疗。临床上,有淋巴瘤病史的患者发现肾上腺肿瘤时易诊断为肾上腺受侵,但对于首诊表现为肾上腺肿瘤又不伴有全身淋巴结肿大的患者则常易误诊,继而可能接受不必要的手术治疗[2-3]。因此,提高对该疾病的认识非常重要。
1 资料与方法
1.1 临床资料
收集2002年1月至2013年5月我院肾上腺淋巴瘤12例,均为初诊未经治疗者,且影像学资料和病理结果完整。临床分期:根据2010年AJCC分期第7版[6],本组Ⅱ期1例,Ⅲ期1例,Ⅳ期8例,未分期2例。原发性肾上腺淋巴瘤诊断标准为[3-7]:双侧或单侧肾上腺非霍奇金淋巴瘤,不伴有淋巴结肿大、无同细胞型白血病和其他结外器官受侵。根据此标准,本组仅2例符合原发性肾上腺淋巴瘤诊断标准,其余10例或伴有淋巴结受侵、或伴有其他部位受侵。
1.2 CT检查
10例行CT扫描。采用螺旋CT扫描仪(GE LightSpeed VCT、GE LightSpeed Pro、GE Bright-Speed S、TOSHIBA Aquilion)。扫描层厚、层间距均为5 mm。管电压120 kV,管电流240 mA。对无碘禁忌证的患者行增强扫描,造影剂为非离子型碘对比剂(300 mg I/ml)100 ml,使用压力注射器以流速3.0 ml/s经肘静脉注射,延迟65秒开始扫描。本组8例行增强扫描,2例行平扫。7例行颈胸腹盆扫描,1例行胸腹部扫描(同期行全身PET-CT扫描)。1例仅腹盆部扫描、1例仅腹部扫描,故未能分期。2例行脑CT、1例行脑MRI扫描。
1.3 PET-CT T-CT检查
3例行PET-CT扫描(GE Discovery ST-16型扫描仪),显像剂18F-FDG注射剂量3.70~4.44 MBq/kg,注射后60~70 min后行全身PET-CT检查。扫描范围由头顶至股骨上段。平静呼吸下,先行CT扫描,采集条件为管电压120 kV,管电流150 mA,螺距1.75:1。再行PET图像3D采集,体部采集每床位3 min,5~6个床位。以CT数据行衰减校正,迭代法重建,在工作站融合PET-CT图像。每例均有胸部屏气螺旋CT扫描。
1.4 图像分析
病变单双侧,形态,最大径(横轴位测量病变最大径或最大厚度),边界,密度均匀性,有无坏死、囊变、脂肪、钙化、出血,增强扫描强化程度(与静脉期肝实质及肌肉比较,将静脉期与肝实质密度相似定义为中等强化)。邻近脏器及远处脏器受侵情况。淋巴结受侵情况。将“肿块型”定义为肾上腺正常分枝状形态消失,局部形成类球形或不规则形肿块影;将“增厚型”定义为肾上腺正常分枝状形态存在(“Y、V”字形或线形),分枝呈局限性或弥漫性增厚,厚度超过0.7 cm(正常肾上腺厚度通常为0.5~0.7 cm)[1]。
1.5 统计学方法
使用统计学软件SPSS 13.0进行统计分析。计量资料使用秩和检验。
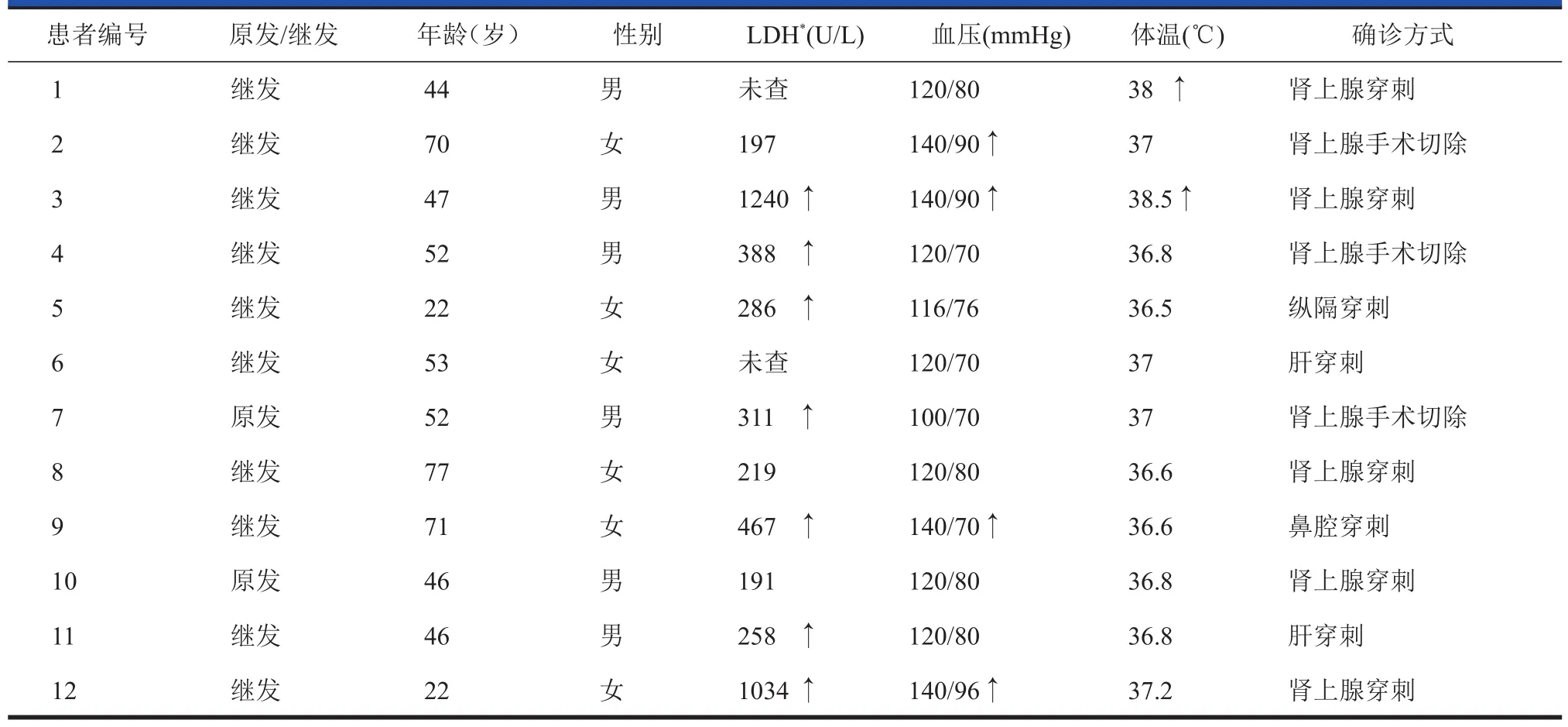
表1 1 2 1 2例病例一般资料统计
2 结果
2.1 一般情况
本组12例中,男6例,女6例,年龄22~77岁,中位年龄49.5岁。病理类型均为非霍奇金淋巴瘤,11例为弥漫性大B细胞型,1例未分T/B亚型。临床表现:乏力伴消瘦4例,腰腹部不适或疼痛4例,胸闷气短2例,肤色变黑1例,无明显自觉症状1例。4例血压升高(最高140/90 mmHg)。2例体温升高(最高38.5℃)。实验室检查结果:血清LDH 7例升高,3例正常,2例未查。10例钠、钾电解质正常,2例未查。治疗方式:10例行CHOP方案(环磷酰胺+多柔比星+长春新碱+泼尼松)化疗,其中5例治疗后好转,2例进展,1例化疗3周期后胸腹部病变缩小但出现脑膜受侵,1例因骨髓抑制中断化疗,1例化疗后失随;2例未接受治疗(表1)。
2.2 肾上腺病变CT表现
2.2.1 10例继发肾上腺淋巴瘤CT表现 1 0例中,8例为双侧病变、2例为单侧病变。8例表现为肿块型(图1),最大径1.2~16 cm,中位数5.6 cm。2例表现为增厚型(图2),厚度范围1.0~4.5 cm。4例伴有坏死、囊变,无一例伴有脂肪、钙化或出血。6例行增强扫描,静脉期肿物CT值略高于同层肌肉,但低于肝实质,差异有统计学意义(Z=2.201,P=0.028)。
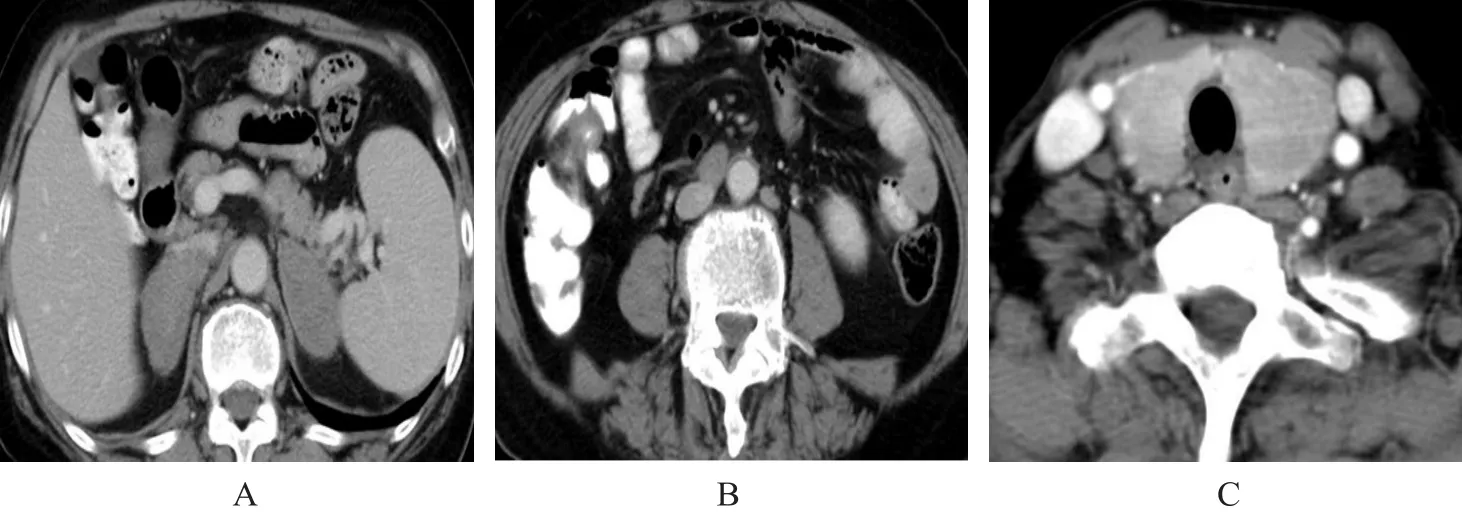
图1 继发性肾上腺淋巴瘤(女,70岁,患者2)
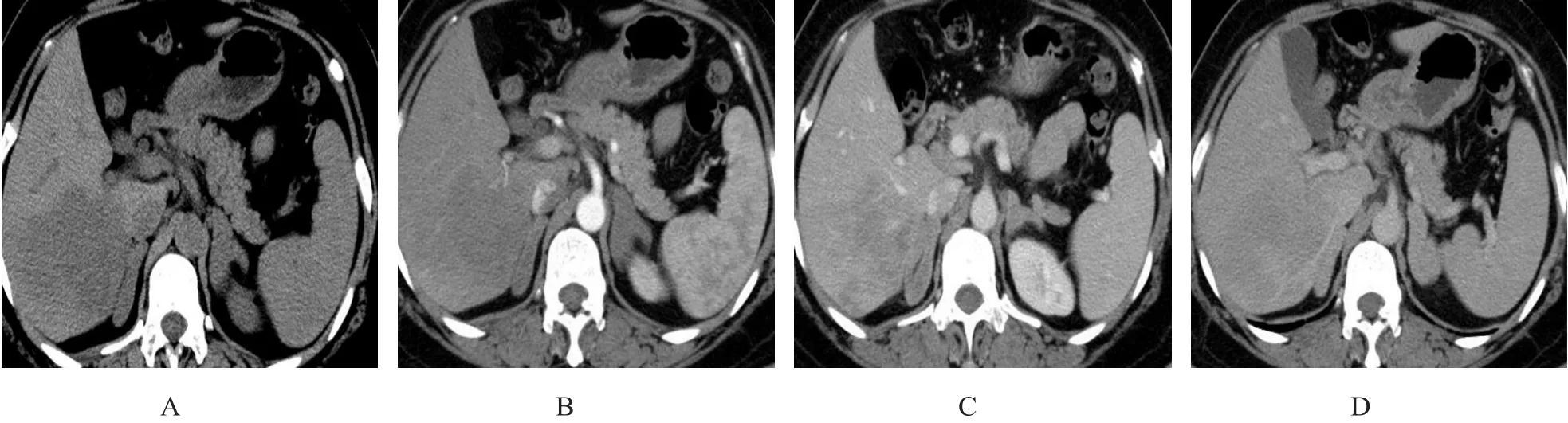
图2 继发性肾上腺淋巴瘤(女,54岁,患者6)
2.2..2 2 2 2例原发肾上腺淋巴瘤CT表现 2例均为双侧肾上腺病变,1例为双侧肿块,1例为一侧肿块、另一侧增厚(图3)。2例肿物均密度混杂,内伴有囊变、坏死,不伴脂肪、钙化或出血。增强扫描静脉期强化程度均低于肝实质。
2.2..33其他脏器受侵情况 邻近脏器直接受侵及大血管受侵:3例与邻近大血管界限不清,4例侵犯相邻膈肌脚(图4),4例直接侵犯同侧肾脏,其中1例侵犯同侧肾脏同时存在另一血行播散灶(图5)。其他腹腔脏器侵犯:3例伴有肝脏受侵,2例伴有脾脏受侵,2例伴有胰腺受侵,1例伴有小肠受侵。膈肌另一侧远处脏器侵犯:1例伴有肺受侵(图5),1例伴有脑受侵(表3)。
2.3 肾上腺病变PET-CT T-CT表现
本组3例继发病例行PET-CT扫描,3例肾上腺肿物均明显摄取增高(图6),SUVmax分别为12.2、24.5、26.6,其中2例伴有腹腔及腹膜后淋巴结受侵,1例伴有纵隔淋巴结受侵,SUVmax为24.7。
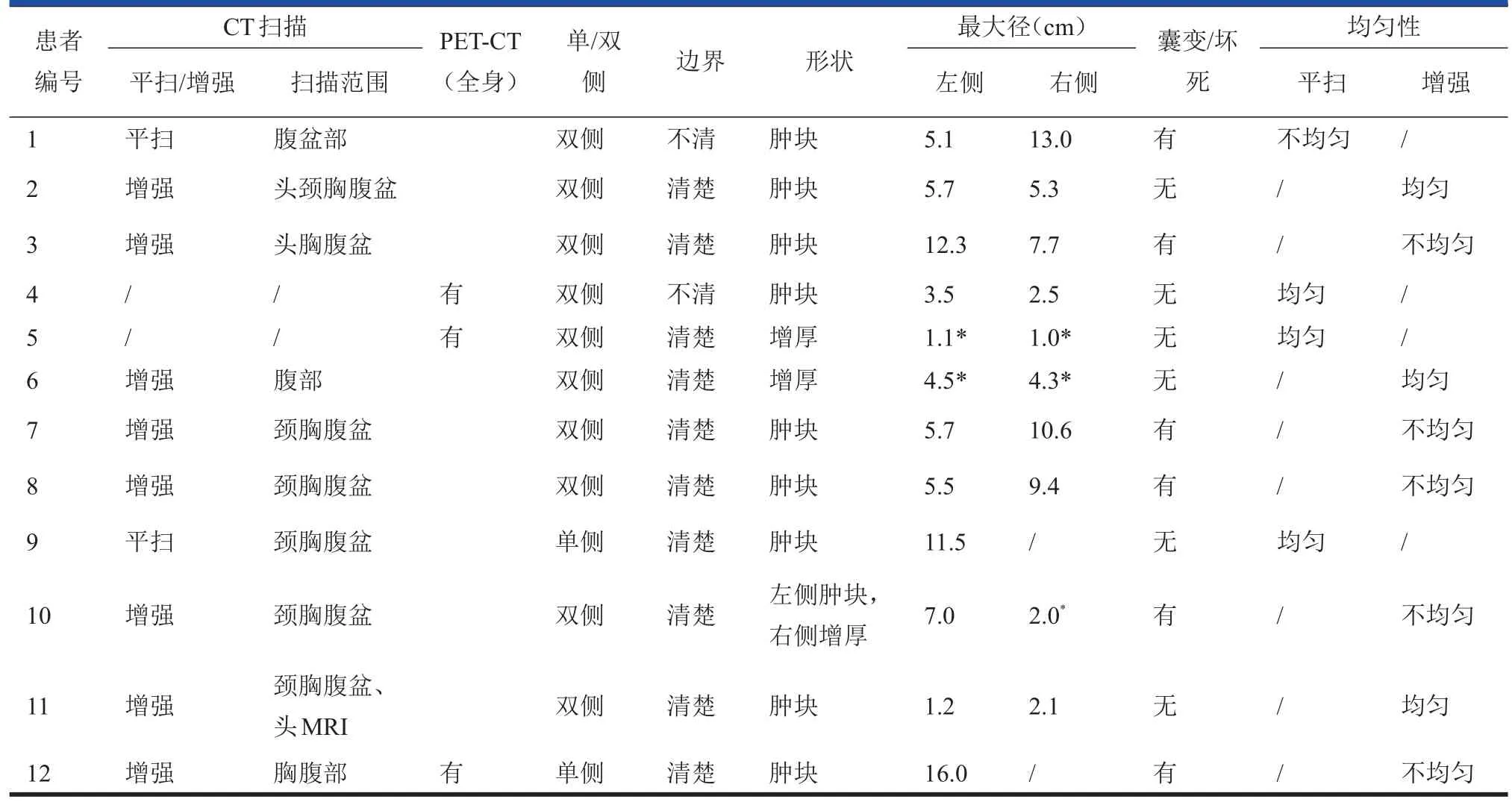
表212 12例肾上腺淋巴瘤CT及PET-CTET-CT影像学表现
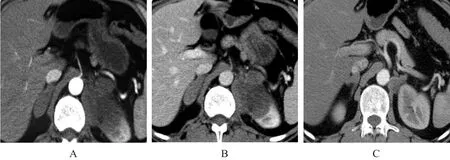
图3 原发性肾上腺淋巴瘤(男,46岁,患者10)
2.4 淋巴结受侵情况分析
本组10例继发病例中,9例伴有淋巴结受侵,1例无淋巴结受侵。受侵淋巴结分布和大小情况:8例腹膜后淋巴结短径0.7~3.9 cm,4例腹腔淋巴结短径1.0~1.6 cm,1例盆腔淋巴结短径2.1 cm,3例纵隔淋巴结短径0.8~4.0 cm,1例颈部淋巴结短径1.0 cm。受侵淋巴结表现为密度均匀,强化均匀,强化程度与肌肉近似,边界清楚。对于短径小于1.0 cm的淋巴结,均经化疗后随诊证实有明显缩小或消失。2例原发病例均不伴有淋巴结受侵。
3 讨论
3.1 肾上腺淋巴瘤的病理学特点与临床特征
肾上腺淋巴瘤组织学类型多为非霍奇金淋巴瘤弥漫性大B细胞型。以继发多见,原发罕见。过去40年有文献报道的原发性肾上腺淋巴瘤仅100余例[8-9],男性多于女性,老年居多,双侧肾上腺受累多于单侧,组织学亚型B细胞型多于T细胞型[10-11]。本组男女比例1∶1,年龄分布22~77岁,中位年龄49.5岁。病理类型均为非霍奇金淋巴瘤,除1例未分T/B亚型外,其余11例为弥漫性大B细胞型。多数表现为双侧肾上腺病变(10/12例),少数为单侧病变(2/12例)。根据原发性肾上腺淋巴瘤诊断标准,本组仅2例符合原发性肾上腺淋巴瘤,其余10例为继发。
临床症状无特异性,常见表现为发热、体重减轻、疲劳、皮肤色素沉着,局部肿瘤压迫症状如上腹部疼痛不适等。50%伴有肾上腺功能不全,尤其双侧肾上腺受累患者易出现肾上腺功能不全症状[5-12],原因可能是由于肿瘤高度侵袭破坏肾上腺结构[9]。部分患者伴血压升高。实验室检查可出现水钠电解质异常,血清LDH升高,ACTH升高,皮质醇异常。ACTH升高提示原发性肾上腺功能不全。本组临床表现包括乏力伴消瘦、腰腹部不适或疼痛、胸闷气短、肤色变黑。少数患者伴血压升高(4/12例)和(或)体温升高(2/12例)。多伴有血清LDH水平升高(7/10例)。水钠电解质均正常(10/10例)。

表3 1 2 1 2例病例其他脏器受侵情况统计
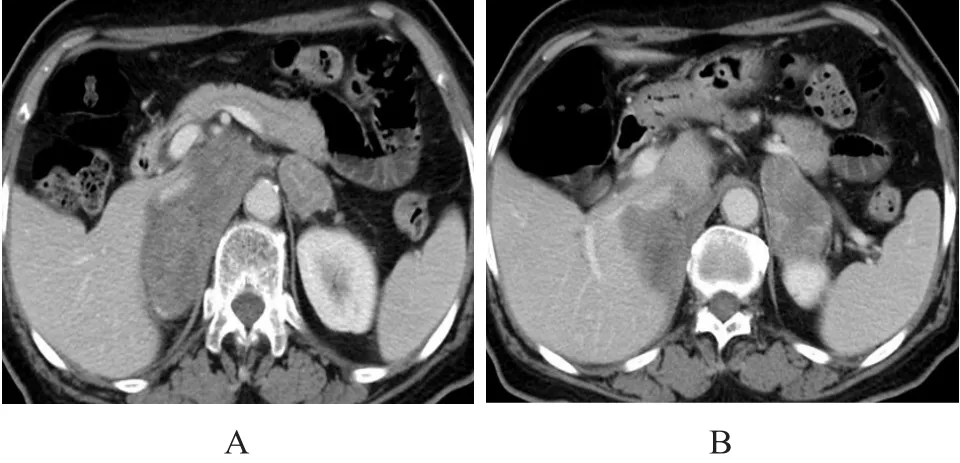
图4 继发性肾上腺淋巴瘤(女,77岁,患者8)
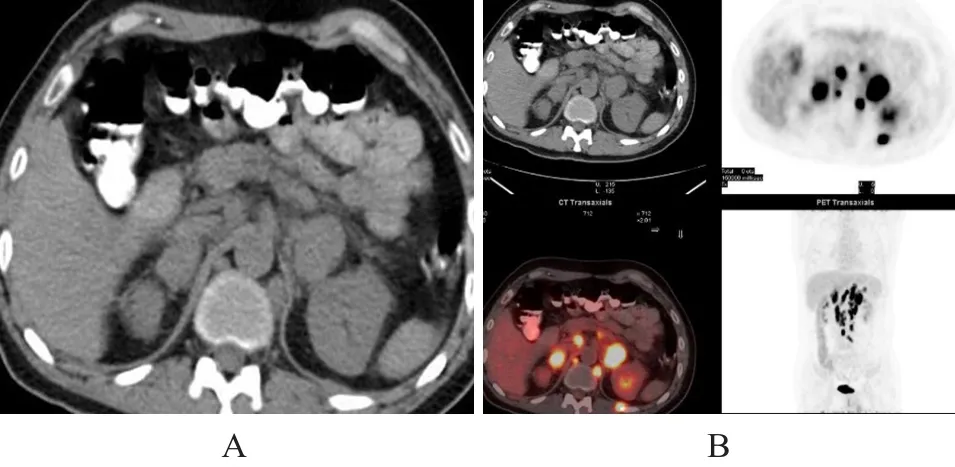
A:PET-CT的CT平扫;B:PET-CT融合图像。双侧肾上腺肿物,SUVmax为24.5,双侧膈肌脚后、腹膜后多发肿大淋巴结,左侧竖脊肌外侧结节,均呈明显代谢增高,为淋巴瘤侵犯
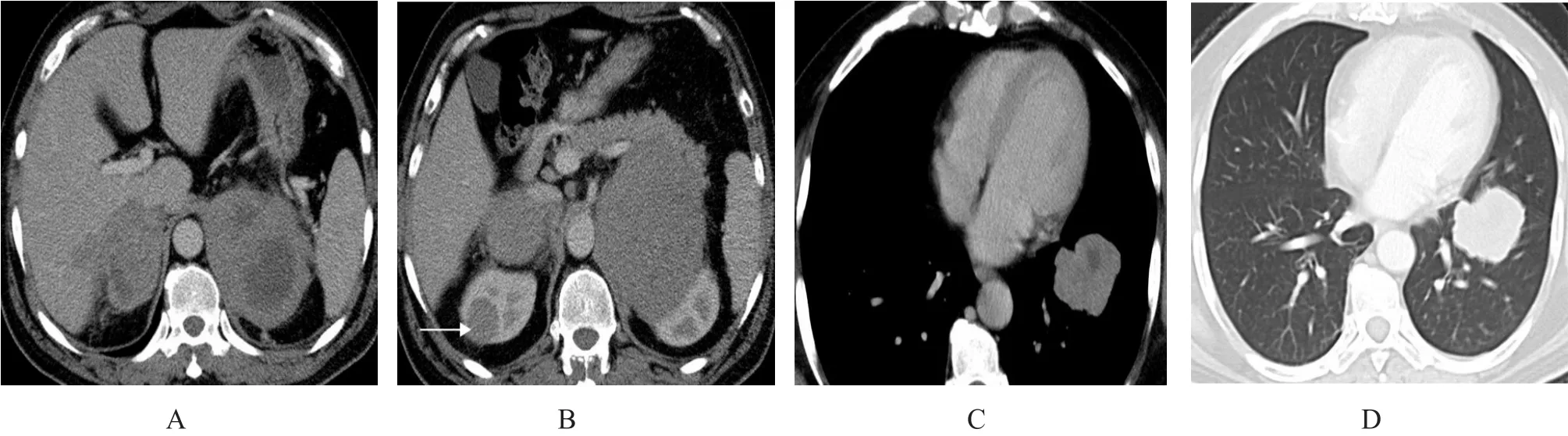
图5 继发性肾上腺淋巴瘤(男,47岁,患者3)
影响预后的因素包括年龄较大、肿瘤大小、LDH水平、出现肾上腺功能不全症状[5-13]。继发性肾上腺淋巴瘤以化疗为主。原发性肾上腺淋巴瘤预后极差[14],大多数生存时间短暂,大约一半患者1年内死亡,仅少数患者化疗后病情完全缓解[9-15-16]。本组8例继发性肾上腺淋巴瘤行CHOP方案化疗,其中4例治疗后好转,1例未愈,1例进展。2例原发性肾上腺淋巴瘤行CHOP方案化疗,1例好转,1例进展。另外2例未在本院治疗且失访。
3.2 肾上腺淋巴瘤的CT及P ET-CT表现
继发性肾上腺淋巴瘤以双侧性居多,也可为单侧性,本组10例继发性肾上腺淋巴瘤中,8例为双侧、2例为单侧。多数表现为肾上腺肿物(8/10例)、少数表现为肾上腺增厚(2/10例)。肿物轮廓规整,多数边界清楚。半数密度均匀,半数不均匀者内伴有坏死或囊变,但未见伴有出血、钙化或脂肪。6例增强扫描病例,强化程度低于静脉期肝实质,略高于肌肉。多数伴淋巴结肿大(9/10例)和多脏器受侵(8/10例),受侵淋巴结主要为腹膜后及腹腔淋巴结。
文献报道原发性肾上腺淋巴瘤CT表现与继发性肾上腺淋巴瘤有所差别,前者多表现为密度混杂,肿物内出血、坏死多见,仅少数表现为密度均匀,侵犯邻近大血管及肾脏,增强扫描强化程度较低,CT灌注为低血供[9]。本组原发病例2例,均表现为双侧肾上腺病变,肿物密度混杂,内见囊变、坏死,未见明显出血,增强扫描静脉期强化程度均低于肝实质,其中1例侵犯邻近膈肌脚及肾脏。本组全部2例原发病例与近半数(4/10例)继发病例均可出现肿瘤内坏死囊变,但均未见明显出血,可直接侵犯邻近脏器。故仅就本组病例笔者认为二者影像学表现无明显差异。
无论原发或继发性肾上腺淋巴瘤,FDG PET表现为摄取明显增高。PET-CT的重要作用是观察有无区域及远处淋巴结受累,有无其他脏器受累,并排除其他部位原发肿瘤,鉴别肿瘤良恶性[5]。本组3例继发病例行PET-CT扫描,无论肿块型或增厚型均明显代谢增高,且都伴有淋巴结受侵。
根据本组病例体会,结合既往文献报道,有以下情况者应怀疑本病:①中老年患者出现双侧肾上腺肿瘤,无其他部位恶性肿瘤;②伴有肾上腺功能不全;③CT扫描密度均匀或伴有坏死囊变,增强扫描静脉期强化程度低于肝实质;④多伴有淋巴结肿大、邻近或远处脏器受侵。但明确诊断仍需要依靠穿刺或手术病理证实。
3.3 鉴别诊断
淋巴瘤患者有双侧肾上腺增大时,诊断应考虑肾上腺受累,对单侧病变应先排除无功能腺瘤。对于单侧小病灶,腺瘤与淋巴瘤二者CT表现无明显特异性,鉴别诊断困难,此时FDG PET-CT检查有助于鉴别良恶性[17-18]。表现为增厚的肾上腺淋巴瘤需要与肾上腺增生鉴别。肾上腺增生常伴有内分泌症状,多表现为双侧肾上腺对称性增厚,增厚的程度远较淋巴瘤受侵为低,PET-CT检查肾上腺对FDG的摄取增生远较淋巴瘤受侵为低。
肾上腺最常见恶性肿瘤为转移瘤。一般认为,在没有恶性肿瘤病史的患者中,发现肾上腺肿瘤极少为转移瘤;而在有恶性肿瘤病史的患者中,发现肾上腺肿瘤往往为转移瘤。肾上腺转移瘤常来自肺癌、乳腺癌、黑色素瘤,亦有文献报道肾癌及胃癌常发生肾上腺转移[2]。转移瘤可发生在单侧,也可在双侧。肿瘤大小不一,大多数形态不规则。单纯肾上腺转移十分少见,有文献报道88%的病例在诊断时即存在肾上腺外转移,主要为肺、骨、肝、脑和淋巴结[2]。FDG PET-CT检查可用于排除其他部位的原发肿瘤。
综上所述,肾上腺淋巴瘤CT表现具有一定特征,多表现为双侧、边界清楚的低血供病变;与肾上腺其他原发肿瘤相比密度较为均匀,原发与继发均可伴有坏死、囊变。继发病例常伴有多脏器、多组淋巴结受累。PET-CT有助于肿瘤性质的鉴别诊断,有助于观察有无区域及远处淋巴结受累、有无其他脏器受累,藉此排除其他部位原发肿瘤。
[1]石木兰.肿瘤影像学[M].北京:科学出版社,2003:891-941.
[2]寿建忠,李长岭,马建辉,等.双侧肾上腺继发性肿瘤的临床分析[J].中华泌尿外科杂志,2006,27(8):523-526.
[3]寿建忠,马建辉,肖振东,等.肾上腺淋巴瘤的临床与病理特点分析[J].中华泌尿外科杂志,2007,28(4):2.23.
[4]Falchook FS,Allard JC.CT of primary adrenal lymphoma[J].J Comput Assist Tomogr,1991,15(6):1048-1050.
[5]Holm J,Breum L,Stenfeldt K,et al.Bilateral primary adrenal lymphoma presenting with adrenal insufficiency[J].Case Rep Endocrinol,2012:638298.
[6]Edge SB,American Joint Committee on Cancer.AJCC cancer staging manual[M].7th ed.New York:Springer,2010.
[7]Kumar R,Xiu Y,Mavi A,et al.FDG-PET imaging in primary bilateral adrenal lymphoma:a case report and review of the literature[J].Clin Nucl Med,2005,30(4):222-230.
[8]Lee JE,Evans DB,Hickey RC,et al.Unknown primary cancer presenting as an adrenal mass:frequency and implications for diagnostic evaluation of adrenal incidentalomas[J].Surgery,1998,124(6):1.2.
[9]Zhang LJ,Yang GF,Shen W,et al.Imaging of primary adrenal lymphoma:case report and literature review[J].Acta Radiol,2006,47(9):993-997.
[10]Bouchikhi AA,Tazi MF,Amiroune D,et al.Primary bilateral non-Hodgkin's lymphoma of the adrenal gland:a case report[J].Case Rep Urol,2012:325675.
[11]Tsukahara T,Takasawa A,Murata M,et al.NK/T-cell lymphoma of bilateral adrenal glands in a patient with pyothorax[J].Diagn Pathol,2012,7:114.
[12]Yang Y,Li Q,Pan Y.Bilateral primary adrenal lymphoma[J].Br JHaematol,2010,150(3):250.
[13]Xu A,Xiao X,Ye L,et al.Primary adrenal lymphoma[J].Leuk Lymphoma,2003,44(4):739-740.
[14]戴为信,周道斌,崔全才,等.双侧肾上腺及盆腔非霍奇金淋巴瘤一例[J].中华肿瘤杂志,2007,29(2):115.
[15]Takahashi Y,Iida K,Hino Y,et al.Silent intravascular lymphoma initially manifesting as a unilateral adrenal incidentaloma[J].Case Rep Med,2012:849285.
[16]Wang XL,Lü ZH,Mu YM,et al.Diffuse large cell non-Hodgkin lymphoma with pituitary and bilateral adrenal involvement[J].Intern Med J,2012,42(3):329-332.
[17]Blake MA,Slattery JM,Kalra MK,et al.Adrenal lesions:characterization with fused PET/CT image in patients with proved or suspected malignancy--initial experience[J].Radiology,2006,238(3):970-977.
[18]Blake MA,Kalra MK,Sweeney AT,et al.Distinguishing benign from malignant adrenal masses:multi-detector row CT protocol with 10-minute delay[J].Radiology,2006,238(2):578-585.
