In Situ PLA技术原位分析MTA1与NuRD复合体其他组分的相互作用△
2014-12-22刘健王海娟刘群李春晓刘欢黄骁舾孟希亭赵枚林晨黄常志钱海利
刘健王海娟刘群李春晓刘欢黄骁舾孟希亭赵枚林晨黄常志#钱海利#
都医科大学附属北京朝阳医院医学研究中心,北京 100020
国医学科学院北京协和医学院肿瘤医院肿瘤研究所分子肿瘤学国家重点实验室,北京100021
都医科大学附属北京妇产医院妇科肿瘤,北京100006
MTA1是1993年Pencil等利用差异cDNA文库筛选技术,从具有转移潜能的大鼠乳腺癌细胞株13762NF中筛选分离出的一个乳腺癌转移相关基因[1]。随后大量研究表明MTA1普遍高表达于乳腺癌、肺癌、肠癌、胃癌、食管癌、胰腺癌、卵巢癌、胸腺癌、肝癌、子宫内膜癌、前列腺癌等大多数类型的人类肿瘤组织中,参与了肿瘤侵袭转移、血管生成、上皮间质转化、细胞增殖、放化疗耐受等众多恶性行为的调控过程[2]。
MTA1/NuRD复合体是目前发现的MTA1参与肿瘤调控的一个最主要机制。NuRD即核小体重塑及组蛋白去乙酰化复合体,它由HDAC1、HDAC2、RbAp46、RbAp48、MTA1、MBD3 及 Mi2七种蛋白组成[3]。通过NuRD复合体MTA1在细胞核内抑制了多种肿瘤抑癌基因的表达,如BRCA1[4]、p21 WAF1[5]、HIC1[6]等。但最近研究表明MTA1不仅定位于胞核,在胞质中也有明显的分布,我们课题组的大量研究数据也充分证明了这一点。对于胞质定位的MTA1是否也存在于NuRD复合体中并通过其发挥功能这一疑问,至今还未见报道。
In Situ PLA技术是瑞典的Olink Bioscience公司发明的一项可以用于原位定量检测蛋白相互作用的新技术。邻位连接技术(proximity ligation assay,PLA)的原理是使用一对标记有一段寡聚脱氧核苷酸(单链DNA)的二抗探针(PLA探针)分别识别两种已经结合了不同目的蛋白的一抗,如果这两种目的蛋白具有相互作用,那么此时两个PLA探针之间的距离就会非常接近(<40 nm),即产生了所谓的邻近效应(proximity)。此时,通过加入一段分别与连接在抗体上的DNA互补的连接寡聚脱氧核苷酸,PLA探针上的DNA就会与该段DNA互补,然后在连接酶的作用下,形成一个闭环。然后再加入含有荧光标记的核苷酸和聚合酶的扩增缓冲液,通过滚环扩增(rolling circle amplification,RCA)最终可以在相互作用位点形成数百个密集的DNA环,而高浓度的荧光信号在荧光显微镜下显示为一个明亮的斑点,易于检出[7]。在本研究中,我们将In Situ PLA技术应用于原位验证MTA1与NuRD复合体其他组分的相互作用,并进一步实施亚细胞定位分析。
1 材料与方法
1.1 细胞
HCT116细胞为ATCC来源,培养条件为DMEM+10%胎牛血清,5%CO2。
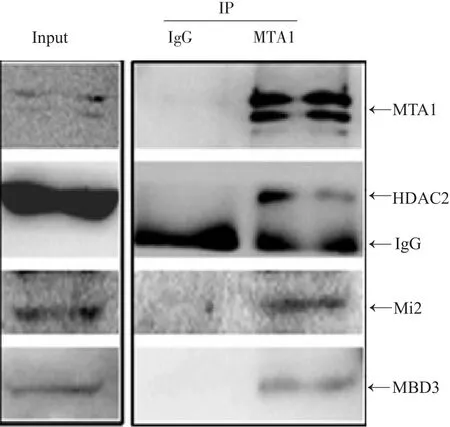
图1 体外IP实验证实MTA1与HDAC2、Mi2、MBD3的相互作用
1.2 抗体与Duo-link试剂盒
鼠源MTA1一抗购买于Abcam公司;兔源Mi2和MBD3一抗购买于SANTA Cruze;兔源HDAC2一抗购买于Bioworld公司;Duo-link试剂盒购买于Olink Bioscience公司。
1.3 体外co-IP实验
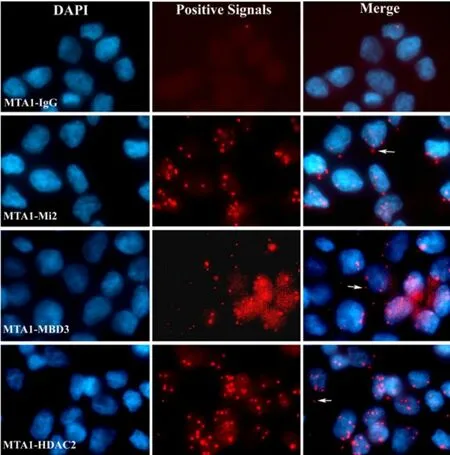
图2 原位显示MTA1与Mi2、HDAC2及MBD3的相互作用
实验步骤:①收集10 cm大皿的细胞,NP-40裂解液裂解,提取蛋白,采用考马斯亮蓝法进行蛋白定量;②取500μg总蛋白,加入2μg的MTA1一抗,于4℃摇床孵育过夜;③加入20μl proteinA/G beads(Santa Cruze),4℃摇床 2 h;④离心收集beads,NP-40裂解液洗涤6次;⑤使用25 μl蛋白上样缓冲液煮沸10 min,离心收集上清液;⑥采用Western Blot法鉴定捕获的蛋白。
1.4 In Situ PLA实验
按照Duo-link试剂盒说明书操作,大致步骤为:①制备HCT116细胞爬片;②将爬片固定于载玻片上,经多聚甲醛固定,Triton-X打孔,BSA封闭后加入鼠源MTA1一抗及另一种待测蛋白的兔源一抗,4℃孵育过夜;③加入试剂盒中带标记探针的二抗Mouse-PLUS和Rabbit-MINUS,于37℃下孵育1 h;④加入连接反应液,于37℃下反应30 min;⑤加入扩增反应液,于37℃下反应100 min;⑥封片,荧光显微镜下检测红色斑点状阳性信号。
2 结果
2.1 IP 技术证明HCT116 细胞中MTA1 与HDAC2、Mi2、MBD3的相互作用
研究报道MTA1是NuRD复合体的一个重要组分[3],在前期IP-质谱实验中我们也发现利用MTA1抗体可以捕获所有已知的NuRD组分,并且通过体外co-IP技术,我们证实HCT116细胞裂解液中MTA1与NuRD组分-HDAC2、Mi2、MBD3具有明显的相互作用(图1)。
2.2 In Situ PLA 技术原位显示MTA1 与HDAC2、Mi2、MBD3在胞内的相互作用
体外实验无法完全模拟复杂的细胞内环境,因此接下来我们首次利用In Situ PLA技术对MTA1与NuRD复合体其他组分HDAC2、Mi2、MBD3的相互作用进行了体内原位检测。如图2所示,红色点状颗粒即表示两种蛋白具有相互作用,为相互作用阳性信号。结果表明MTA1与Mi2、HDAC2、MBD3均具有明显的胞内相互作用。因为阳性信号数量的多少可以间接反映相互作用能力强弱,因此我们进一步对50个细胞内的阳性信号进行计数分析,结果表明MTA1-HDAC2组阳性信号数最多,为363个;MTA1-Mi2组次之,为280个;而MTA1-MBD3组最少,为208个,表明这三者中MTA1-HDAC2相互作用能力最强,MTA1-Mi2次之,MTA1-MBD3最弱。以MTA1-IgG为阴性对照,分别原位检测MTA1与Mi2、HDAC2及MBD3的相互作用,图中红色斑点颗粒即表示一个相互作用反应。箭头指示该相互作用位于胞质
2.3 MTA1/NuRD复合体在间期细胞中的亚细胞定位分析
最初文献报道MTA1是一个核定位蛋白,因此之前研究均将MTA1/NuRD视为一个核定位的转录抑制复合体进行功能探索。但是最近大量文献提示MTA1也分布于胞质中,并有可能在胞质中发挥重要功能[8],因此我们进一步对MTA1/NuRD复合体进行了亚细胞定位分析。结果表明在Mi2、HDAC2及MBD3三个实验组中分别有25.0%、22.1%及27.0%的胞质定位信号,表明MTA1/NuRD复合体在胞质中也有分布,其比例约占总数的 1/4(图 3)。
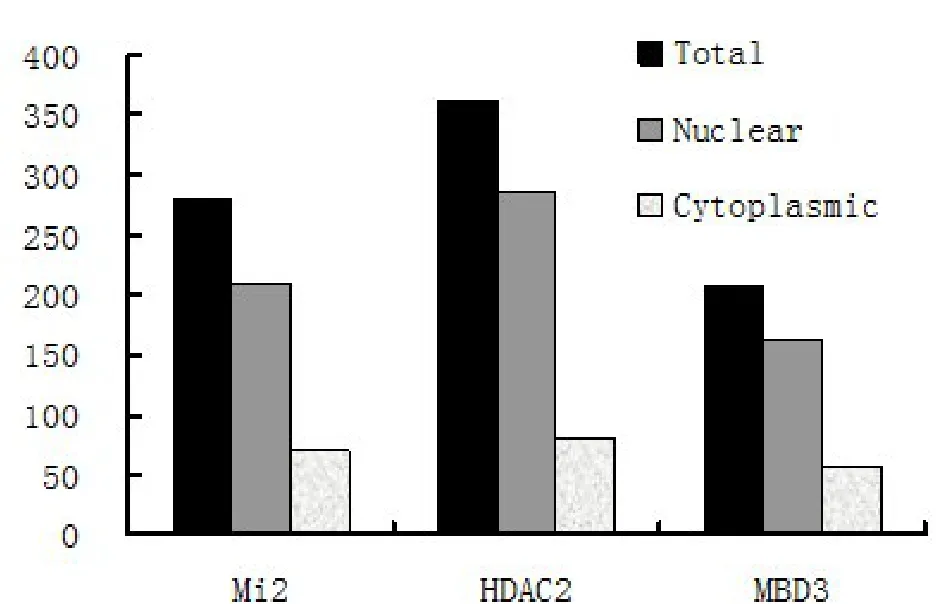
图3 对间期细胞中MTA1与Mi2、HDAC2及MBD3的相互作用信号进行定量分析
2.4 MTA1/NuRD 复合体在M 期细胞中的亚细胞定位分析
根据阳性信号分布,我们进一步对MTA1/NuRD复合体在有丝分裂期(M期)细胞中的分布进行了定位研究。结果我们首次发现,虽然在间期MTA1-Mi2主要作用于胞核,但是进入M期后,几乎全部的阳性信号均分布于凝集的染色体外周(图4)。MTA1-HDAC2及MTA1-Mi2相互作用的原位分析均得出一致的结果。该结果不仅进一步证实MTA1/NuRD复合体的确存在胞质分布,也提示MTA1/NuRD复合体可能参与了细胞周期调控。通过检测MTA1-Mi2在HCT116细胞中的相互作用,原位显示MTA1/NuRD复合体在有丝分裂期的亚细胞定位。图中红色斑点颗粒即表示一个相互作用反应。
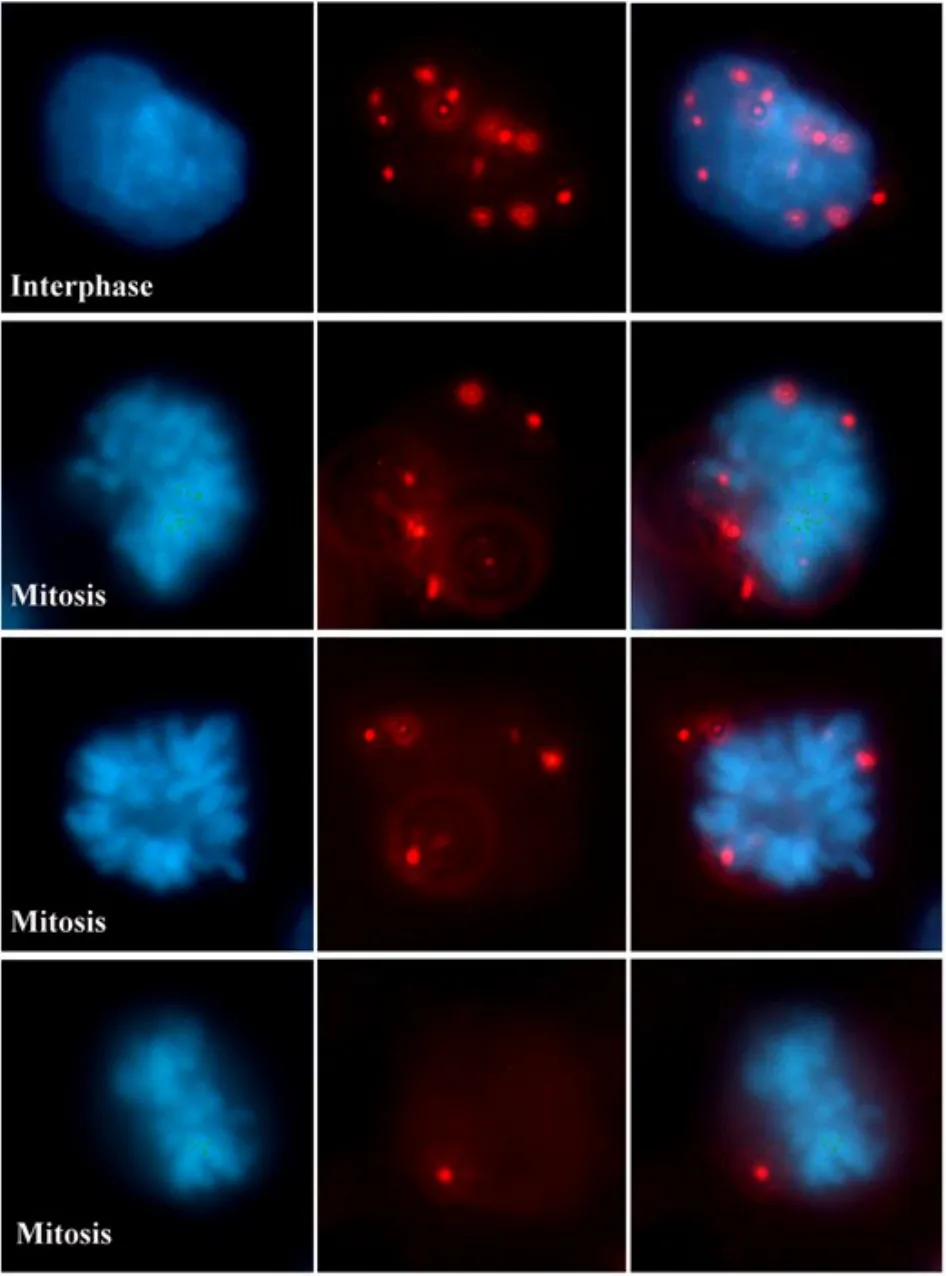
图4 MTA1/NuRD复合体在M期细胞中的分布
3 讨论
肿瘤转移相关蛋白MTA1在肿瘤发生发展尤其是侵袭迁移过程中发挥至关重要的作用。目前MTA1的功能研究主要集中于胞核转录因子。然而最近有多篇文章报道MTA1存在胞质定位,并且有文章研究指出MTA1在胞质中可能参与内吞过程[8]。
NuRD复合体是目前发现的MTA1促进肿瘤发生发展的最主要作用机制。但是关于MTA1与NuRD复合体的相互作用现在只有体外的IP-质谱证据,研究者同时指出NuRD复合体中的约70 kD的蛋白有可能是一个与MTA1非常相近的蛋白。在本实验,我们首次通过In Situ PLA实验对MTA1与NuRD复合体其他组分之间的相互作用进行了体内原位分析,从体内水平进一步验证了MTA1是NuRD复合体的一个组分。
Mi2、HDAC2、MBD3是NuRD复合体中的关键因子,其均与染色质结构调控有关。通过阳性信号数量分析,我们判断在NuRD复合体中,MTA1与HDAC2的相互作用能力最强,Mi2次之,而MBD3最弱。由于In Situ PLA实验的作用基础是两个蛋白分子有足够近的距离,因而该结果说明在NuRD复合体中MTA1可能与HDAC2的距离更近,从而有更多的机会发生寡核苷酸链的连接反应,产生阳性信号。
虽然一直以来MTA1/NuRD复合体一直被当作一个核转录抑制因子,但是至今没有确凿的证据表明MTA1/NuRD复合体只存在于胞核。由于已经有多篇文章报道MTA1存在胞质定位,提示我们MTA1/NuRD复合体可能也存在胞质定位。In Situ PLA技术的一个最大的优势就在于可以准确显示两个蛋白之间的作用位点。而通过该技术我们发现,MTA1/NuRD复合体不仅仅存在于胞核,在胞质中也有明显分布,胞质中的分布量约占整个细胞总量的1/4。该结果进一步表明,MTA1有可能既可以通过NuRD复合体在胞核中参与抑制肿瘤抑癌基因的表达,也可以通过NuRD复合体参与胞质内生物学功能的调控,如胞质蛋白的去乙酰化等。
另外,虽然MTA1/NuRD复合体在间期主要存在于胞核(3/4),但是借助于In Situ PLA技术的原位指示优势,我们还首次发现MTA1/NuRD复合体在M期几乎全部存在于染色体周围,表明在M期MTA1/NuRD复合体已经与染色质解离,无法参与基因的转录调控,但是很可能通过其胞质定位参与细胞周期进程调控。
[1]Toh Y,Pencil SD,Nicolson GL.A novel candidate metastasis-associated gene,mta1,differentially expressed in highly metastatic mammary adenocarcinoma cell lines.cDNA cloning,expression,and protein analyses[J].J Biol Chem,1994,269(37):22958-22963.
[2]Toh Y,Nicolson GL.The role of the MTA family and their encoded proteins in human cancers:molecular functions and clinical implications[J].Clin Exp Metastasis,2009,26(3):215-227.
[3]Xue Y,Wong J,Moreno GT,et al.NURD,a novel complex with both ATP-dependent chromatin-remodeling and histone deacetylase activities[J].Mol Cell,1998,2(6):851-861.
[4]Molli PR,Singh RR,Lee SW,et al.MTA1-mediated transcriptional repression of BRCA1 tumor suppressor gene[J].Oncogene,2008,27(14):1971-1980.
[5]Li DQ,Pakala SB,Reddy SD,et al.Revelation of p53-independent function of MTA1 in DNA damage response via modulation of the p21 WAF1-proliferating cell nuclear antigen pathway[J].J Biol Chem,2010,285(13):10044-10052.
[6]Van Rechem C,Boulay G,Pinte S,et al.Differential regulation of HIC1 target genes by CtBP and NuRD,via an acetylation/SUMOylation switch,in quiescent versus proliferating cells[J].Mol Cell Biol,2010,30(16):4045-4059.
[7]Söderberg O,Gullberg M,Jarvius M,et al.Direct observation of individual endogenous protein complexes in situ by proximity ligation[J].Nat Methods,2006,3(12):995-1000.
[8]Aramaki Y,Ogawa K,Toh Y,et al.Direct interaction between metastasis-associated protein 1 and endophilin 3[J].FEBSLett,2005,579(17):3731-3736.
