腰大池置管引流联合尼莫地平对颅内动脉瘤介入治疗后脑血管痉挛的作用
2014-12-20彭华邱俊
彭 华 邱 俊
四川宜宾市第二人民医院神经外科 宜宾 644000
颅内动脉瘤是目前脑血管疾病导致死亡的严重疾病之一,临床死于颅内动脉瘤的患者仅次于脑血栓以及高血压性脑出血[1-2],颅内动脉瘤破裂出血是患者死亡的直接原因。颅内动脉瘤破裂出血超早期血管内介入治疗具有微创、疗效肯定等优点,逐渐广泛应用于临床,但介入治疗不能及时清除蛛网膜下腔的积血,由此导致的脑血管痉挛(CVS)是围手术期的主要并发症之一,是指蛛网膜下腔出血(SAH)后脑底的大动脉迟发性狭窄,受影响的动脉末梢区域血流灌注减少,研究报告称CVS的发生率为35%~60%[3],CVS及继发的延迟性缺血性脑梗死和脑水肿是导致颅内动脉瘤患者术后死亡或致残的主要原因[4]。我们采取腰大池置管持续引流联合尼莫地平防治颅内动脉瘤介入治疗术后脑血管痉挛,取得较满意效果,现报告如下。
1 资料与方法
1.1 一般资料 选取我院2011-01—2013-06收治的破裂性颅内动脉瘤患者69例,Hunt-Hess分级均为Ⅲ级(出现局灶性神经功能异常),患者入院后均对颅内动脉瘤行血管内栓塞治疗术,术后采用随机分配原则分为2组,观察组35例,男19例,女16例;年龄35~66岁,平均(49.6±11.2)岁;动脉瘤位于前循环31例(共36个动脉瘤,其中前交通动脉瘤18个,颈内-后交通动脉瘤10个,脑中动脉动脉瘤6个,脉络膜动脉动脉瘤2个),位于后循环4例(共6个动脉瘤,均在椎基底动脉);动脉瘤大小1.4~26.6 mm,其中小型(≤4 mm)6个,中型(>4~14mm)23个,大型(>14~24mm)11个,巨大型(>24mm)2个,瘤颈宽1.3~8.5mm。对照组34例,男18例,女16例;年龄36~67岁,平均(50.1±10.4)岁;动脉瘤位于前循环30例(共34个动脉瘤,其中前交通动脉瘤16个,颈内-后交通动脉瘤9个,脑中动脉动脉瘤7个,脉络膜动脉动脉瘤2个),位于后循环4例(共4个动脉瘤,均在椎基底动脉);动脉瘤大小1.3~26.1 mm,其中小型(≤4 mm)4个,中型(>4~14mm)21个,大型(>14~24mm)10个,巨大型(>24 mm)3个,瘤颈宽1.4~8.6 mm。2 组年龄、性别、动脉瘤位置、大小及瘤颈宽等一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 方法 所有患者均于出血后3d内在DSA 辅助下行血管内介入栓塞治疗,于右股动脉穿刺,严格按动脉瘤血管内治疗规范进行操作,术中肝素化,围手术期给予尼莫地平预防脑血管痉挛,手术均顺利完成。观察组术后给予持续腰大池引流,患者取侧卧位,以L3~4或L4~5椎间隙为穿刺部位,缓慢放入18号穿刺针进入腰大池内,可见脑脊液流出,将硬膜外管送入15cm 左右,拔出穿刺针。引流速度控制住3滴/min左右,24h平均引流量控制在300 mL,最高不超过350mL。根据CT 检查结果决定引流的时间,一般2 周左右。对照组采取间断腰穿释放脑脊液,患者取侧卧位,穿刺部位也选择在L3~4或L4~5椎间隙,穿刺释放脑脊液,1次/d,40mL/d。根据CT 复查结果决定脑脊液释放的时间,颅内积血消失即可停止释放脑脊液,一般在2周左右。
1.3 观察指标 采用美国ACUSON 公司SEQUOIA512型经颅多普勒血流显像系统检查大脑中动脉血流速度(VMCA),收集2组患者脑脊液(CSF)标本,测定CSF 压力;CSF中红细胞(RBC)数目送检验科检查。观察2组CVS的发生情况及有无引流或穿刺并发症等。
1.4 CVS诊断标准 (1)患者症状好转或稳定后出现恶化,伴发热、血象高且无感染迹象;(2)意识障碍呈波动性加重或进行性加重;(3)新发或出现进行性加重的偏瘫、失语、失认和失用等神经系统定位体征;(4)出现头痛、呕吐、视乳头水肿等颅内压增高症状;(5)DSA、磁共振血管成像或CT 血管成像显示CVS;(6)经颅多普勒(TCD)检查,大脑中动脉平均流速>120cm/s或大脑中动脉平均流速/颈内动脉平均流速>3,并可见频谱异常,出现湍流现象[5]。将符合上述标准的(1)、(2)条及(3)~(6)中的1~2条判定为发生CVS。
1.5 统计学分析 采用SPSS 14.0进行统计学处理,计量资料以均数±标准差(±s)表示,组间比较行t检验,计数资料以频数或率(%)表示,组间比较行χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 2组VMCA、脑脊液压力及红细胞计数比较 见表1。2组术后VMCA、脑脊液压力以及红细胞计数与术前比较,差异均有统计学意义(P<0.05);术后3、7、10、14d观察组VMCA、脑脊液压力以及红细胞计数与对照组比较,差异有统计学意义(P<0.05)。
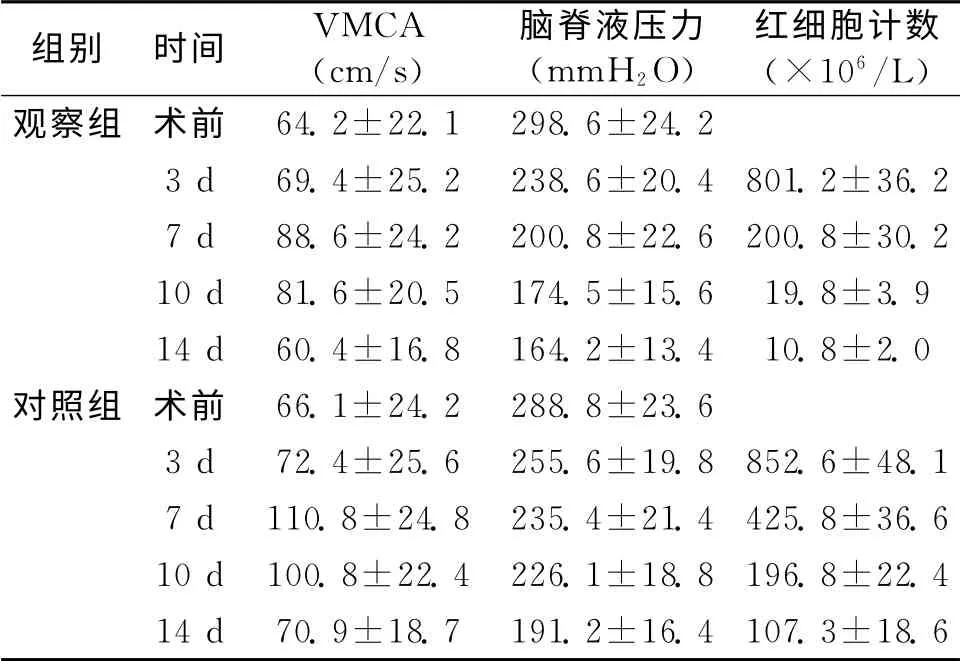
表1 表1 2组VMCA、脑脊液压力以及红细胞计数比较
2.2 2组CVS及其他相关操作并发症发生率比较 2 组CVS发生率比较,差异有统计学意义(P<0.05);观察组1例出现脱管,对照组l例出现颅内感染,经积极抗感染治疗后好转,未中断治疗,2组比较差异无统计学意义(P>0.05)。见表2。

表2 2组CVS及其他相关操作并发症发生率比较[n(%)]
2.3 2组CSS评分比较 术后14d,2组CSS评分均较术前改善,但观察组CSS评分减少程度显著优于对照组,差异均有统计学意义(P<0.05)。见表3。

表3 2组手术前后CSS评分比较
3 讨论
CVS是动脉瘤性蛛网膜下腔出血(SAH)术后预后不良的主要原因,患者易出现迟发性缺血性神经功能障碍,若不及时处理,易致残甚至造成患者死亡。据文献报道,CVS一般发生在SAH 后3~14d,在4~12d 时达到高峰[6]。目前,关于CVS的病理生理机制未完全明确,研究报道可能与蛛网膜下腔积血的刺激、血液中血管收缩物质的释放、红细胞降解产物的产生等因素有关[7]。血管内栓塞等介入治疗方法无法清除蛛网膜下腔积血及致痉物质,SAH 后CVS可造成脑缺血性损害。因此,如何在介入治疗后清除蛛网膜下腔的积血,是防治颅内动脉瘤破裂出血后CVS的重要措施。
本文采用介入治疗术后腰大池持续引流血性脑脊液,并配合尼莫地平静脉泵入,以及稀释血液等综合治疗措施,患者脑脊液压力降低更快,VMCA 及RBC数目均低于对照组,有效降低了CVS的发生,表明蛛网膜下腔持续引流明显加速积血的清除,减少了脑脊液中RBC 裂解产物的含量,从而减轻血管痉挛程度,缩短痉挛时程,临床疗效优于间断腰穿释放脑脊液这一治疗方法。
脑脊液中红细胞计数可直接反映蛛网膜下腔积血的清除情况,临床神经功能缺损评分的降低程度可早期判断患者神经功能的改善情况。颅内动脉瘤破裂出血进入蛛网膜下腔的RBC在12h内是新鲜和完整的,12h后开始溶解,5~8 d达到高峰,20d后完全溶解。SAH 后脑脊液中红细胞未溶解或开始溶解不久,清除红细胞速率越快,脑脊液中的致痉物质浓度越低,CVS的程度越轻,时程越短。因此,持续引流能引流脑脊液中各种物质,有利于清除阻塞脑血管外膜微孔道的有害物质,从而降低脑脊液中毒性物质的含量。综上所述,血管内治疗术后及早行腰大池蛛网膜下腔持续引流可有效降低脑脊液压力及RBC 的水平,减少CVS的发生,减轻血管痉挛程度,缩短血管痉挛时程,疗效优于间断腰穿释放脑脊液,是目前防治CVS的首选方式。
[1]陈荣华,宣井岗,彭亚,等.高分级颅内动脉瘤破裂出血的早期血管内治疗[J].天津医药,2012,40(2):177-178.
[2]李国彬,杨海英,孟庆海,等.颅内动脉瘤破裂出血急性期血管内介入治疗的疗效观察[J].山东医药,2011,51(37):62-63.
[3]陆士奇,孔小明,冀勇,等.动脉瘤性蛛网膜下腔出血患者血清sICAM-1含量变化的动态研究[J].医师进修杂志,2005,28(10A):17-19.
[4]巴华君,蔡建勇.动脉瘤性蛛网膜下隙出血后脑血管痉挛的治疗及临床分析[J].中国医师进修杂志,2011,34(23):30-32.
[5]张峰,侯凯,张品元,等.动脉瘤性蛛网膜下腔出血后症状性脑血管痉挛的相关因素研究[J].临床荟萃,201I,26(1):58-62.
[6]蒋玲,荣阳,蔡国明,等.蛛网膜下腔出血后迟发性脑血管痉挛的临床研究[J].中外医学研究,2010,8(14):47-48.
[7]冯光,钟治军,段继新.颅内动脉瘤介入治疗术后腰池引流和间断腰穿防治脑血管痉挛的临床疗效比较[J].医学临床研究,2011,28(1):89-91.
