适于菌草代料栽培的杂交灵芝菌株选育
2014-12-19金珊珊柯斌榕吴小平汤坤鹏
金珊珊,柯斌榕,吴小平* ,汤坤鹏
(1.福建农林大学菌物研究中心,福州350002;2.福建省农业科学院食用菌研究所,福州350014)
利用菌草栽培食药用菌已经得到了广泛的研究。菌草具有投资少,周期短,成本低的特点,同时也防止水土流失。栽培食用菌后的菌袋废料回收利用可制作生物肥,又可制作成动物饲料,以此形成一个综合的循环利用,减少在栽培食用菌方面消耗的木材。项丽娟[1-2]等人以菌草为主料,高粱、麦麸为辅料栽培银耳,得出子实体出芽早,展片优于棉籽壳。蔡杨星[3]利用菌草栽培猴头菇,和传统木屑配方比较,子实体蛋白质含量是木屑栽培的子实体含量的1.14倍,总氨基酸含量也略高。将菌草作为栽培大球盖菇的原料,具有原基形成时间短,朵型较好,产量高等特点[4]。林占熺利用芒萁、五节芒、巨菌草代替阔叶木栽培食药用菌如鹿角灵芝,王凯[5]等人比较菌草栽培的9种灵芝的生长状况,选出适宜栽培的菌种。但是还未见通过杂交选育菌草栽培专用灵芝菌株的报道。本实验选择以菌草作为培养基质,分析不同杂交菌株的农艺性状及有效成分含量,筛选出适合菌草栽培的灵芝杂交菌株。
1 材料与方法
1.1 实验材料
1.1.1 供试菌种
亲本:1)AL:安岭灵芝基地子实体分离;2)JCL:菌草鹿角灵芝子实体分离。
杂交种:J-7/AL-7,J-15/AL-2,J-16/AL-9,J-29/AL-1,J-1/AL-12,J-6/AL-7,J-6/AL-2保藏于福建农林大学菌物研究中心 (以上菌株通过单孢杂交获得)。
1.1.2 实验试剂
浓硫酸,重蒸酚,冰醋酸,高氯酸,香草醛,98%乙醇 (以上溶剂均为分析纯试剂),甲醇,乙腈(色谱级),熊果酸对照品 (上海源叶生物科技有限公司),灵芝酸A对照品 (大连美仑生物技术有限公司),葡萄糖 (上海源叶生物科技有限公司)。
1.1.3 实验仪器
旋转蒸发仪 (上海申生科技有限公司);分光光度计 (北京北分瑞利仪器公司);超快速分离液相色谱仪 (日本岛津)。
1.2 实验方法:
1.2.1 原种制作
原种配方:木屑76%,麸皮20%,玉米粉3%,石膏1%,加水至含水量60%~65%之间,搅拌约0.5 h至均匀,使原料充分吸水。每个原种瓶装湿料约450 g压实,用自制棉塞塞紧;1.5 Mpa,121℃高压灭菌150 min,灭菌后冷却至30℃以下接种,25℃黑暗条件下培养菌丝并按时通风,保持室内空气相对湿度60%左右。
1.2.2 栽培袋制作
栽培料配方:芒萁30%,五节芒43%,麸皮25%,石膏2%。按比例称料加水拌匀人工拌料,每个处理重复30袋,每个菌袋装湿料约900 g。pH控制在4~6,含水量控制在60%左右。灭菌后接种,菌袋于25℃左右在黑暗条件下培养,隔3天后观察是否有杂菌污染,并及时清理菌袋。
1.2.3 生长速度测定
采用大试管装栽培料测9株菌种的生长速度,每个菌种做5个平行,每隔3天用刻度尺测生长量,一共记录4次,计算平均每天的生长速度,以此速度预测菌袋的生长速度,生长速度快的菌株可以减少菌种生长周期。
1.2.4 出芝管理
菌丝满袋后,将菌袋转移至出菇房,调整出菇温度控制在26~28℃,室内空气相对湿度为90%~95%,适当通风换气使二氧化碳含量不高于0.1%,并给予1 500 lx以上的光照。待灵芝菌盖边缘白色或黄色生长圈消失转为棕褐色,菌盖开始革质化,菌管层出红褐色孢子时,表明子实体成熟,即可采收。采收后称鲜芝总重,将新鲜灵芝放入烘干箱中55~60℃烘干,收集烘干灵芝,密封。
1.2.5 多糖提取及标准曲线的制作
采用苯酚-硫酸法测定灵芝子实体多糖含量[6]。
葡萄糖标准曲线制作:精密称取干燥的葡萄糖50 mg,定容于500 mL容量瓶中。其浓度为0.1 mg/mL,分别吸取0、0.2、0.4、0.6、0.8、1.0 mL葡萄糖标准溶液于具塞试管中,加蒸馏水至1 mL,加入5%苯酚溶液1 mL,摇匀,快速加入硫酸5 mL。摇匀,充分混合,静置10 min后30℃水浴20 min,冷却,490 nm下测定吸光值。
多糖提取方法[7]:精确称取灵芝干燥子实体粉末2 g,加蒸馏水90℃回流提取,料液比为1∶50,回流提取3 h,过滤,用旋转蒸发仪将提取液浓缩,定容至25 mL。吸取10 mL多糖溶液,加入98%以上乙醇80 mL,醇沉过夜 (约12 h),醇沉后,5 000 r/min离心10 min,弃上清液,将沉淀用蒸馏水定容至25 mL。吸取上述定容样品0.5 mL,按照绘制标准曲线的步骤进行操作,在490 nm下检测吸光值,并记录。
1.2.6 总三萜提取及标准液的制备
熊果酸标准曲线的制作:精密称取熊果酸对照品10 mg,定溶于10 mL甲醇中,得到熊果酸标准溶液,稀释到0.5 mg/mL。精密吸取0.6,0.8,1.0,1.2,1.4,1.6 mL标准液,60℃水浴蒸干,加5%香草醛-冰醋酸溶液0.5 mL,再加高氯酸0.8 mL,摇匀后60℃水浴15 min,冰浴冷却后加5 mL冰醋酸,静置30 min后,在548 nm下测吸光度。
总三萜提取方法[8]:精确称取灵芝子实体粉末2 g,加85%乙醇50 mL,超声20 min,反复提取2次,将2次提取液合并过滤,将滤液减压旋蒸蒸干,用甲醇溶出定容于50 mL容量瓶中。按绘制标准曲线步骤进行操作,在548 nm下检测吸光值。
1.2.7 液相指纹图谱比较
精密称取7.6 mg灵芝酸A,用甲醇定容于10 mL容量瓶中,制备成0.76 mg/mL的对照品溶液,再将母液稀释到0.076 mg/mL进样,以灵芝酸A为对照品优化色谱条件,经优化得到色谱条件为:0.1%乙酸 (A)和乙腈 (B)梯度洗脱,洗脱比例为B浓度为0~20 min:30% ~40%;20~25 min:40% ~55%;25~30 min:55% ~65%;30~40 min:65% ~65%。柱温40℃;流速0.8 mL/min;紫外波长为254 nm;色谱柱为InertsustainC18。将上述提取的总三萜提取物过0.45 um的滤膜,进样量为10 uL。
1.3 统计方法
运用DPS7.05软件采用Duncan's新复极差法进行统计检验,表1、表3、表4中小写字母代表在0.05水平下比较,差异显著;大写字母代表在0.01水平下比较,差异极显著。
2 结果与分析
2.1 不同杂交菌株菌丝生长速度比较
JCL,J-6/AL-7,J-16/AL-9,J-16/AL-2,J-15/AL-2无显著差异,J-7/AL-7,J-6/AL-2,J-1/AL-12,AL无显著差异,亲本JCL的生长速度最快,可达0.75 cm/d,另一亲本AL菌株的生长速度最慢0.65 cm/d(表1)。在这些杂交种之中J-6/AL-7,J-16/AL-9菌株的生长速度最快。J-1/AL-12菌株的生长速度最慢。
2.2 灵芝高产杂交菌株筛选
杂交种的菌盖形态各不相同,差异较大,亲本AL和JCL成肾形,J-6/AL-2子实体菌盖褶皱;J-1/AL-12子实体菌柄较长,可能该菌株在同样条件下对二氧化碳浓度较敏感;J-16/AL-9子实体原基较多;菌盖较小,J-15/AL-2子实体较厚,菌盖比较饱满,而且菌柄较短;J-7/AL-7子实体呈肾形,形状较美观 (表2)。J-6/AL-7原基分化较多且菌柄连结在一起,J-29/AL-1原基分化多,菌盖小 (图1)。
各菌株产量和生物转化率见表3。
生物转化率=芝鲜重/栽培袋料干重×100% (1)
由方差分析表得出,各个菌种的差异是显著的,J-1/AL-12,J-6/AL-7的产量均高于亲本AL的产量,且J-1/AL-12的产量和亲本AL和JCL有显著性差异。J-29/AL-1产量最低,低于2个亲本菌种。

表1 菌丝生长速度Table 1 The growth rates of myceliu

表2 子实体形态描述Table 2 The Morphology description of fruiting body

图1 不同菌株灵芝生长形态Figure 1 The morphology of fruiting body in different strains

表3 不同菌株的产量和生物转化率Table 3 The production of fruiting body and biological conversion rates
2.3 灵芝高活性杂交菌株筛选
2.3.1 线性关系考察
以葡萄糖为对照品,得到标准曲线方程:y=8.755x+0.011 1,R2=0.999 3。另外以熊果酸为对照品,线性回归方程为y=5.42x-0.037 6,R2=0.996 9。
2.3.2 多糖、三萜含量测定与比较
按多糖含量从高到低的顺序将灵芝菌株排列成表4结果。菌株间的三萜含量和多糖含量差异较大,其中J-1/AL-12子实体三萜含量最高,可达9.24 mg/g。J-29/AL-1的多糖含量高,最高可达20.05 mg/g。
2.4.3 灵芝三萜液相图谱分析
按照液相色谱条件,进样量10 uL,样品在45 min内色谱峰已全部跑出,根据中药色谱指纹图谱相似度评价系统2004A版进行比较。
对不同杂交种的指纹图谱进行比较与分析,出峰时间集中在14 min到30 min内 (图2)。S9(J-6/AL-7)的指纹图谱与其他图谱的相似性较小仅0.140到0.608。由此可以得出J-6/AL-7的三萜成分与其他菌株相比较存在一定差异。其他菌株间的差异在0.586到0.982之间。除了 J-6/AL-7菌株,其他菌株尽管从图谱相似度上分析存在较大差异,但其特征峰基本一致。

表4 多糖与三萜含量Table 4 The contents of polysaccharides and triterpenoid

图2 杂交灵芝指纹图谱Figure 2 The fingerprint of fruiting body in different strain

表5 不同菌种指纹图谱相似度分析Table 5 The comparison of similarity
2.4 不同栽培配方灵芝三萜指纹图谱分析
如图3所示,以JCL菌株为例分析不同栽培料配方子实体的差异,S1、S2分别为菌草配方和木屑配方灵芝三萜指纹图谱,通过中药色谱指纹图谱评价系统2004A版比较指纹图谱间的差异,得出2个图谱间的相似度为0.843。从图谱上可以看出特征峰的数量及峰形基本一致,说明同一菌株不同配方灵芝子实体的三萜指纹图谱无明显差异。
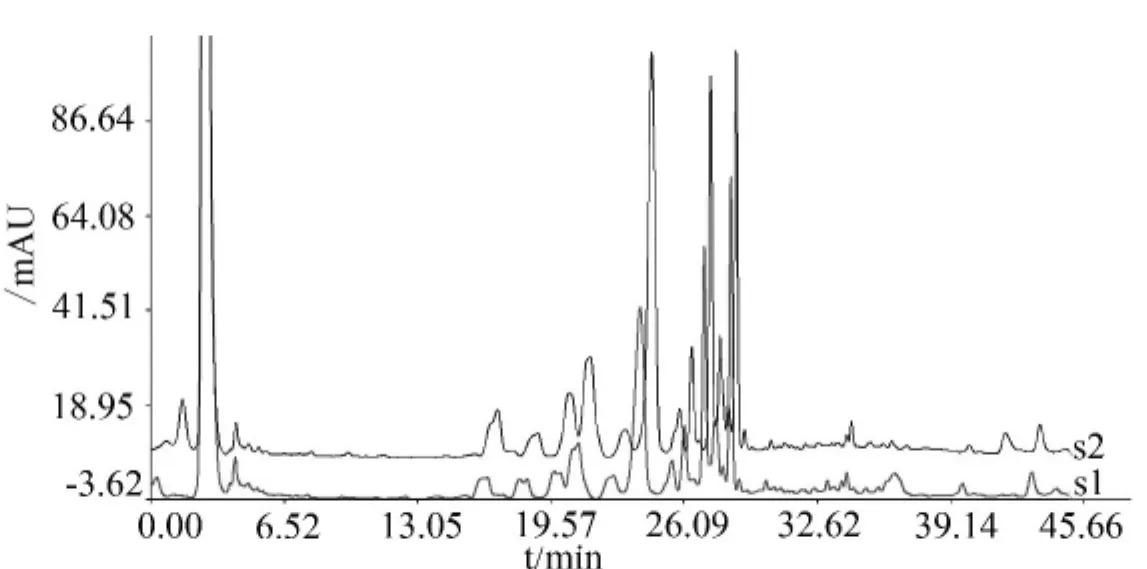
图3 木屑与菌草配方灵芝三萜指纹图谱Figure 3 The fingerprint of fruiting body in two different formulation
3 讨论
在生产上,产量已经作为重要的指标之一,在筛选菌株时菌丝生长速度和产量是2个重要的因素。同时,有效成分是鉴定灵芝品质的重要依据,萜类和多糖类物质是灵芝中含量较多的化合物,因此,可成为筛选菌株的另一个因素。试验中J-1/AL-12的单袋产量和生物转化率均高于2个亲本,分别是46.98 g和11.75%,并且子实体朵形整齐。灵芝的多糖及三萜成分是灵芝质量的重要指标,J-29/AL-1菌株的多糖含量最高,其含量为20.05 mg/g,该菌株的三萜含量也比较高,但其产量很低;J-1/AL-12三萜含量最高,多糖含量也较高,三萜和多糖含量分别是9.24 mg/g和17.30 mg/g;J-6/AL-7的发菌速度最快,产量较高,但是其有效成分含量一般。综合分析,菌株J-1/AL-12的长势较好,产量最高,并且有效成分含量较高,可以作为适合菌草栽培的菌种。建立指纹图谱可以鉴别灵芝三萜成分的差异,建立质量标准[9]。本实验通过液相色谱比较菌株间图谱的差异,发现不同杂交菌株其三萜指纹图谱相似度在0.586到0.982之间,此差异的存在有以下几方面原因:有效物质的含量有差异;可能菌株存在微量的化合物有差异,还有待进一步证实。另有研究表明同一菌株在不同培养基相同培养条件下三萜指纹图谱相似度大于0.96[10],而本实验的木屑配方和菌草配方的灵芝三萜液相图谱及特征峰也均无明显差异,与前人得出的结果较一致。同时也得出可以用菌草代替木屑作为原料栽培灵芝,醇提物几乎无差异。筛选适合菌草栽培的杂交菌株具有可实践性意义。
[1]Xiang Li-juan,Huang Yu-qin,Lin Zhan-xi.Research on bag cultivation technology of tremella with Juncao under natural conditions[J].Edible Fungi of China,2013,32(006):19-20.[项丽娟,黄玉琴,林占熺.温室菌草袋栽银耳技术研究 [J].中国食用菌,2013,32(006):19-20.]
[2]Huang Yu-qin,Xiang Li-juan,Lin Zhan-xi.Medium formulae screening for JUNCAOcultivating Tremella[J].Chinese Agricultural Science Bulletin,2014,30(7):86-89.[黄玉琴,项丽娟,林占熺.菌草栽培银耳培养基配方筛选 [J].中国农学通报,2014,30(7):86-89.]
[3]Cai Yang-xing,Cao Xiu-ming,Lin Dong-mei.Nutrient composition in the fruit body of Hericium erinaceus cultivated with JUNCAO[J].Journal of Fujian Agriculture and Forestry University:Natural Science Edition,2013,42(4):410-413.[蔡杨星,曹秀明,林冬梅.菌草栽培猴头菌子实体的营养成分 [J].福建农林大学学报:自然科学版,2013,42(4):410-413.]
[4]Wang Ai-xian,Liu Fu-yang,Wu Ren-gao.Report on cultivation Stropharia rugoso annulata with JUNCAO [J].Edible,2012(4):28-28.[王爱仙.刘福阳.巫仁高.菌草栽培大球盖菇试验初报[J].食用菌,2012(4):28-28.]
[5]Wang Kai,Lin Zhan-xi,Cao Jian-hong.Comparison of polysaccharides content and growth status of nine ganoderma strains cultivated on JUNCAO[J].Journal of Anhui Agriculture Science,2012,40(21):10849-10852.[王凯,林占熺,曹剑虹.菌草栽培的9种灵芝菌株生长状况和多糖含量比较 [J].安徽农业科学,2012,40(21):10849-10852.]
[6]Wu Xue-qian,Fu Li-zhong,Cheng Jun-wen.Analysis and evaluation of polysaccharides and triterpenes contents of submerged culturing mycelium of strains of Ganoderma Lucidum[J].Forest By-product and Specialty in China,2009,(5):1-4.[吴学谦,付立忠,程俊文.灵芝品种的菌丝体多糖和三萜含量分析评价 [J].中国林副特产,2009, (5):1-4.]
[7]Chen Ling-hua,Cheng Zu-xin,Yang Zhi-jian.Optimization of extraction conditions of Ganoderma lucidum polysaccharide by hot-water[J].Edible Fungi of Zhejiang,2009,17(4):21-23.[陈凌华,程祖锌,杨志坚.灵芝多糖热水提取条件的优化试验 [J],浙江食用菌,2009,17(4):21-23.]
[8]Huang Shu-ming,Yang Xin-lin,Zhang Zi-qiang.Study on ultrasonic circulation technique to extraction of triterpenoids from Ganoderma lucidum[J].Chinese Traditional and Herbal Drugs,2004,35(5):508-510.[黄书铭,杨新林,张自强.超声循环提取灵芝中三萜类化合物的研究 [J].中草药,2004,35(5):508-510.]
[9]Liu Ning.Study on quality standards and fingerprint of Ganoderma lucidum[D].Chengdu:Southwest Jiaotong University,2009.[刘宁.灵芝药材的质量标准及指纹图谱研究[D].成都:西南交通大学,2009.]
[10]Pan Ying-jie.Application of high-performance liquid chromatographic fingerprinting in the study of tissue isolation of Ganoderma lucidum[J].Mycosystema,2008,27(2):277-283.[潘迎捷.HPLC指纹图谱技术在灵芝组织分离试验中的应用 [J].菌物学报,2008.27(2):277-283.]
