抑癌基因DPC4/smad4、P16在食管鳞状细胞癌中的表达及其临床意义
2014-12-19宋文庆陶仪声
宋文庆 俞 岚 陶仪声 吴 强
(1安徽医科大学病理学教研室,合肥230032;2蚌埠医学院病理学教研室,安徽233030)
食管癌是食管粘膜上皮发生的恶性肿瘤,死亡率较高,位居肿瘤死亡的第4位。在食管癌的发生过程中,涉及多种抑癌基因的改变。1996年,由Hanh SA[1]等首先发现的抑癌基因 DPC4,经研究证实,其失活与肺癌[2]、结肠癌[3]、头颈部鳞状细胞癌[4]等的发生具有密切的关系。DPC4的产物Smad4是转移生长因子β(TGF-β)信号传导中的中心“角色”,DPC4是TGF-β受体介导的信号转导环路中的一种转录因子,其基因缺失、突变将导致细胞过度增殖与生长。p16基因是第一个被证明参与细胞周期调控机制的抑癌基因,其编码生成的P16蛋白是细胞增殖的负调节物[5]。通过抑制细胞周期蛋白依赖性激酶(cyclin -dependent kinase,CDK)活性,参与并调节细胞的增生[6]。目前的研究证实,在肺癌[7]、乳腺癌[8]、鼻咽癌[9等恶性肿瘤中均有P16基因的表达缺失。食管鳞状细胞癌中,关于抑癌基因P16与DPC4的表达情况,尤其是P1与DPC4的关系,以及二者的失活与患者生存预后的关系,国内外文献报道较少。本实验通过检测80例食管鳞状细胞癌及30例癌旁组织中DPC4/smad4和P16的表达情况,探讨二者的相关性及其与患者生存预后的关系。
材料和方法
1.标本来源
收集蚌埠医学院第一附属医院2007年1月~2008年6月存档石蜡包埋食管癌病例组织标本80例(所有病例均经病理学证实为食管鳞状细胞癌,且术前均未行放、化疗)和癌旁食管粘膜组织标本30例,所有病例均有完整的临床及病理资料,其中男性63例,女性17例。年龄37~76(60.06±8.57)岁,<60岁37例,≥60岁43例。入选病例随访至患者死亡或截止2011年2月。随访时间为5-56个月。按分化程度分为:高分化24例,中分化36例,低分化20例。按淋巴结有无转移,有转移38例,没有转移42例。肿瘤的最大平均直径3.0cm。根据UICC2002版PTNM病理分期标准进行分期,其中Ⅰ期-Ⅱ期患者40例,Ⅲ期-Ⅳ期患者40例。对照组为正常食管黏膜30例,取自肿块>5.0cm处,病理HE染色证实为正常食管黏膜。
2.试剂
鼠抗人P16单克隆抗体(克隆号:MX007)购自福州迈新生物技术开发公司;鼠抗人DPC4单克隆抗体(克隆号:IMD-89)由北京中杉公司代理,购自Santa Cruz Biotechnology 公 司,为 浓缩型;ElivisionTM plus试剂盒以及DAB显色试剂盒均购自福州迈新生物技术开发公司。
3.实验方法
采用免疫组织化学ElivisionTM plus法,将石蜡标本以4μm厚连续切片、烤干,于二甲苯溶液及不同浓度的乙醇中脱蜡至水洗。免疫组化染色操作步骤按试剂盒说明书进行。采用已知阳性片作对照,以PBS液代替一抗作空白对照。同时,为确定一抗抗原的免疫反应特异性,进行抗体吸收实验作为阴性对照。
4.结果判断
DPC4以细胞膜和细胞浆中出现棕黄色颗粒为阳性。P16基因以细胞核内出现棕黄色颗粒为阳性。采取二次计分法:每例标本随机计数10个高倍视野(×400),每个高倍视野中阳性细胞所占百分比并计分。首先按染色强度计分:0分为无色,1分为淡黄色,2分为棕黄色,3分为棕褐色。再按阳性细胞百分比计分,0分为阴性,1分为阳性细胞为<10%,2分为11% ~50%,3分为51% ~75%,4分为>75%。用染色强度得分和细胞数得分的乘积作为判断表达结果,若积分≤1为阴性,>1为阳性。免疫组化结果由两位高年资病理医生采用独立双盲法判定。
5.统计学方法
DPC4/smad4和P16表达阳性组与阴性组生存分析用 Kaplan-Meier法,组间比较用log-rank检验,多因素分析采用Cox回归多因素模型,DPC4/smad4和P16在食管癌组织、正常食管黏膜组织中的表达及其与各临床及病理因素的相关性采用Fisher exact法检验,P<0.05为差异有统计学意义。
结 果
1.食管鳞状细胞癌中DPC4/Smad4的表达及其与各临床病理指标的关系
DPC4/smad4蛋白主要定位于食管鳞状细胞癌癌细胞的胞膜和胞浆,为黄色或棕黄色颗粒(图1)。在食管鳞状细胞癌中,DPC4/smad4阳性率为43.8%(35/80),对照组正常食管粘膜组织中为 80.0%(24/30)(P<0.01)。DPC4/smad4的表达与患者的性别、年龄、肿块大小等因素无关(P>0.05);随着DPC4/smad4的表达程度的降低,癌组织的分化越差、临床分期越晚、更易出现淋巴结转移(P<0.01,表1)。
2.食管鳞状细胞癌中P16的表达及其与各临床病理指标的关系
P16蛋白主要定位于食管鳞状细胞癌癌细胞的胞核,为黄色或棕黄色颗粒(图2)。在食管鳞状细胞癌中,P16的阳性率为31.1%(35/80),较正常食管粘膜的表达率93.0%(28/30)明显减少(P<0.01,图2B)。P16的表达与患者的性别、年龄、肿块大小等因素均无关(P>0.05),而与食管鳞状细胞癌的组织学分化程度、临床分期及转移与否有关,P16的表达程度的降低,肿瘤组织的分化越差、临床分期越晚、更易出现转移(表1)。
3.食管鳞状细胞癌中DPC4/smad4与P16的关系
Spearman相关分析显示,食管鳞状细胞癌组织DPC4/smad4与P16的表达呈正相关(r=0.898,P<0.01,表2)。
表1 食管鳞状细胞癌中DPC4/Smad4、P16与临床病理因素的关系Table 1 Correlation of the expressions of DPC4/Smad4,P16with clinicopathological characteristics of esophageal squamous cell carcinoma

表2 食管鳞状细胞癌中DPC4/Smad4、P16的表达之间的相互关系Table 2 Expression of DPC4/Smad4、P16,and their relationship in esophageal squamous cell carcinoma
表3 80例食管鳞状细胞癌患者多因素分析Table 3 Multivariate survival analysis of 80patients with Esophageal Cancer
4.生存分析
本组病例总的5年生存率为37.5%。Kaplan-Meier生存分析显示P16阳性组与阴性组5年生存率分别为65.7%和13.0%,差异有统计学意义(P=0.000);DPC4阳性组与阴性组5年生存率分别为68.6%和13.3%,差异有统计学意义(P=0.000)。生存曲线见图3、图4。
5.多因素分析
将病例年龄(分为≤60岁组与>60岁组)、性别(男性组与女性组)、肿瘤直径(分为≤3.0cm组与>3.0cm组)、分化程度(分为高分化组、中分化组与低分化组),PTNM分期(分为Ⅰ、Ⅱ期组与Ⅲ 、Ⅳ期组)、淋巴结转移(分为有转移组与无转移组)、DPC4(分为表达阳性组与阴性组)和P16(分为表达阳性组与阴性组)等因素引入Cox模型进行多因素分析,结果显示:DPC4和P16的表达及PTNM分期和淋巴结转移是影响食管鳞状细胞癌根治术后患者 预后的独立因素(见表4)。
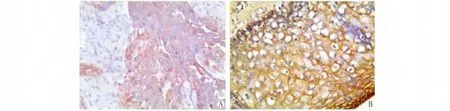
图1 DPC4/Smad4在食管鳞状细胞癌及正常食管粘膜中的表达(ElivisionTM×400)Fig.1Positive staining of DPC4/Smad4in esophageal squamous cell carcinoma (A)and normal esophageal mucosa (B)(ElivisionTM×400)
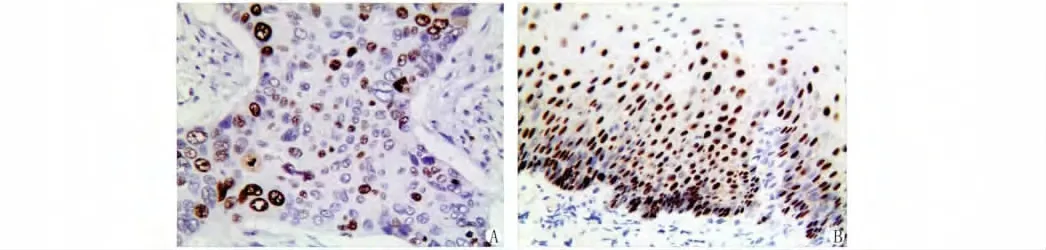
图2 P16在食管鳞状细胞癌及正常食管粘膜中的表达(ElivisionTM×400)Fig.2Negative staining of P16in esophageal squamous cell carcinoma(A)and normal esophageal mucosa(B)(ElivisionTM×400)
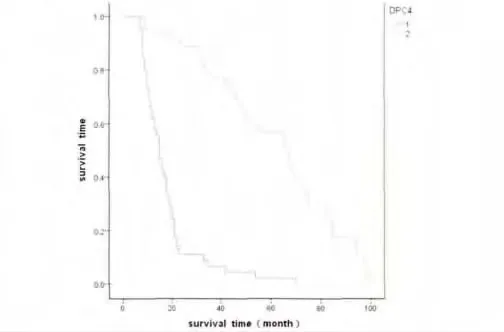
图3 DPC4/Smad4表达阳性组与阴性组食管;鳞状细胞癌生存曲线Fig.3Survival curves of squamous cell carcinoma patient with positive or negative DPC4or expression.
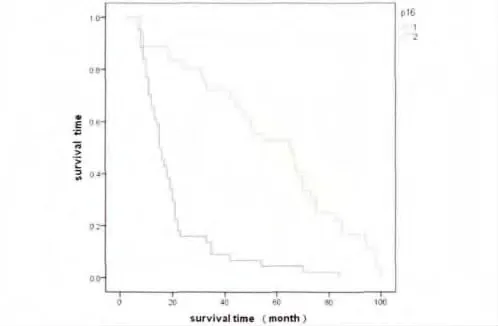
图4 P16表达阳性组与阴性组食管;鳞状细胞癌患者生存曲线Fig.4Survival curves of squamous cell carcinoma patients with positive negative P16expression
讨 论
DPC4基因的蛋白产物Smad4是TGF-β超家族受体的直接底物。而TGF-β是细胞有丝分裂的抑制物,所以凡是参与TGF-β信号传导过程中的元件均被认为是肿瘤抑制物。DPC4基因在TGF-β信号通路中通过其蛋白产物Smad4与不同的Smad蛋白相互作用,编码一个关键的细胞内信使,成为TGF-β信号转导途径的中心环节。DPC4基因的失活将导致Smad-TGF-β信号转导途径的破坏,解除TGF-β信号途径的生长抑制效应,失去对细胞增殖的抑制作用[3,4],细胞过度生长,从而导致肿瘤的发生。本实验结果显示,在食管癌组织中DPC4的阳性率远远低于癌旁组织(P<0.05),而且分化程度越差,临床分期越晚其阳性率越低。同时,淋巴结转移组中DPC4阳性率显著低于无淋巴结转移组(P<0.05)。结果与文献报道一致[10]。这一结果提示我们,DPC4基因的失活可能是导致食管鳞状细胞癌的发生原因之一。
抑癌基因P1 6的表达产物(MTSI)是细胞周期素依赖性激酶(CDK4)的抑制蛋白,而CDK 4是使细胞增殖周期从G1期进入S期的关键因子,是真核细胞增殖分裂的中心。P16蛋白通过与细胞周期素D竞争性的结合细胞周期素依赖性激酶(CDK4),导致CDK4的失活,抑制了细胞的过度分裂,成为细胞增殖过程中的负调控因子。当P16基因发生突变或缺失时,会产生无活性 的P16蛋白或P16蛋白产物缺乏,对CDK4的抑制解除,细胞因此获得无限增殖能力,出现无节制的分裂增殖,导致肿瘤的发生。本实验结果显示,80例食管鳞状细胞癌中,P16的阳性率为31.1%,较正常食管粘膜的表达率93.0%明显减少(P<0.01)。随着P16表达程度的降低,肿瘤组织的分化越差、临床分期越晚、更易出现转移。这与文献报道一致[11]。
既然P16和DPC4都是通过对周期蛋白依赖激酶(CDK)的抑制作用实现对细胞周期的调控的,我们推测二者之间可能存在某种内在的联系。本实验对P16和DPC4在食管鳞状细胞癌中表达的相关性进行了分析,结果表明,DPC4与P16的表达呈正相关性(r=0.898,P<0.01)。但是对于二者的因果关系,尚有不同看法。Hannon[12]等发现 TGF-β可以刺激p16家族中的另一成员P15的表达,从而控制细胞增生。在对大肠癌研究中也发现TGF-β与P 16表达呈正相关。我们据此推测,DPC4作为TGF-β信号转导途径中的重要基因,其失活以后,Smad-TGF-β信号转导途径受阻,使得P16表达下降,因此对细胞周期的抑制作用消除,细胞大量增殖,从而导致肿瘤的发生。但是 MikiYamano[13]等研究显示,在胰腺癌中无P16基因改变的标本,P53、DPC4基因不发生改变,因此认为P16基因的改变是P53基因和DPC4基因失活的必要阶段。按照这一结果,虽然DPC4与P16的表达存在相关性,但是P16基因的失活不是DPC4基因失活的结果,而是导致DPC4失活的原因。郭树彬等[14]应用基因芯片对16例胰腺癌组织的研究显示,7例出现DPC4基因改变的标本,也同时出现p16基因改变,。简而言之,P16基因失活以后导致了DPC4基因的失活,对细胞增殖的抑制作用解除,导致了肿瘤的发生。
本实验提示,P16和DPC4在食管鳞状细胞癌中的表达确实存在正相关性,这说明DPC4基因和P16基因在食管鳞状细胞癌的发生中有着协同作用,与花瞻等[15]在胰腺癌中的研究结果一致。但二者表达的内在因果关系以及对细胞周期调控的协同作用机制,尚不清楚,需进一步的研究探讨。。
本研究多因素分析显示,P16和DPC4的表达、PTNM分期以及淋巴结转移是影响食管鳞状细胞癌患者的独立预后因素。P16及DPC4阳性组患者5年生存率分别为65.7%和68.6%,均明显高于阴性组患者13.0%和13.3%(均为P<0.05)。这一结果提示,P16与DPC4的表达对于食管癌患者的生存率及生存期的估计可能有一定的指导意义。
综上所述,P16与DPC4基因的失活是导致食管鳞状细胞癌发生的重要原因。同时,由于P16与DPC4基因均是通过对细胞周期依赖激酶的抑制来调控细胞周期的,二者有明显的相关性。二者的表达与食管鳞状细胞癌的组织分化、临床分期、生存率均有相关性。因此,在食管鳞状细胞癌中检测P16和DPC4的表达情况可以帮助临床分期评估预后。
[1]Hahn SA,Schutte M,Hoque AT,et al.DPC4,a candidate tumor suppressor gene at human chromosome 18q21.1.Science,1996,271(5247):350-353
[2]曹超,曹勇,曾大雄等.联合检测支气管肺泡灌洗液中DPC4和LKB1突变诊断肺部孤立块影的价值.华中科技大学学报(医学版),2010,39(6):825-828
[3]谢忠士,宋燕,刘志毅等.抑癌基因DPC4在结肠癌蛋白的表达及临床意义.中国实验诊断学,2008,12(2):245-246
[4]Baez A,Cantor A,Fonseca S,et al.Differences in Smad4 expression in human papillomavirus type 16-positive and human papillomavirus type 16-negative head and neck squamous cell carcinoma.Clin Cancer Res,2005,11(9):3191-3197
[5]Rocco JW,Sidransky D.p16 (MTS-1/ CDKN 2/INK4a)in cancer progression.Exp Cell Res,2001,264(1):42-55
[6]Endo T,Abe S,Seidlar HB,et al.Expression of IAP family proteins in colon cancers from patients with dif-ferent age groups.Cancer Immunol Immunother,2004,53(9):770-776
[7]UliviP,Zoli W,Calistri D,et al.p16INK4Aand CDH13hyper-methylation in tumor and serum of nonsmall cell lung cancer patients .J Cell Physiol,2006,206(3):611-615
[8]吴美华,冯震博.乳腺癌中HER-2、P16和P53的表达及预后意义.当代医学,2011,17(9):15-17
[9]Makitie AA,MacMillan C,Ho J,et al.Loss of p16expression has prognostic significance in human nasopharyngeal carcinoma.Clin Cancer Res,2003,Jun9 (6):2177-2184
[10]周海渡,颜云,李国庆等.食管癌组织中DPC4基因的失活.世界华人消化杂志,2002,10(1):102-103
[11]张红,牛韵韵,胡曼平等.食管癌中P53、P21、P16、cyclin D1、CDK4免疫组化检测.免疫学杂志,2003,19(4):312-314
[12]Hannon GJ,Beach D.p15INK4Bis a potential effector of TGF-β-induced cell cycle arrest.Nature ,1994,Sep;15(371):257-261
[13]Yamano M,Fujii H,Takagaki T,et al.Genetic Progression and Divergence in Pancreatic Carcinoma .A-merican Journal of Pathology,2000Jun;156(6):2123-2133
[14]郭树彬,杨红,陆星华等.胰腺癌抑癌基因p16、DPCA寡核苷酸芯片点突变及缺失的应用.临床内科杂志,2007,24(6):419-422
[15]花瞻,张远春,贾振庚等.Her-2/neu、DPC4和p16在胰腺癌中的表达及其意义.基础医学与临床,2008,28(1):48-52
