Hes1在高温致神经管畸形上皮细胞中的表达变化
2014-12-19刘文静张天亮李锋杰洪2
闫 雪 刘文静 张天亮 赵 会 李锋杰 于 丽 江 洪2
(潍坊医学院组织学与胚胎学教研室;1潍坊医学院临床学院,山东261053;2潍坊市人民医院妇产科 山东261041)
神经管畸形(neural tube defect,NTD)是人类在胚胎早期发育过程中由于神经管闭合不全而引起的一类先天缺陷,也是胚胎和围产儿致残的主要原因,包括无脑、露脑、脊柱裂、脑积水等多种临床表型。NTD是人类出生缺陷中较为常见的一种出生缺陷,影响1‰的胎儿存活率[1]。目前引起孕产妇NTD的原因有很多,尤其是高热、糖尿病、高胰岛素血症、肥胖、各种社会生理和心理因素[2]。其中高温是最为常见的物理致畸因素之一。人类约10%的神经管畸形为孕早期高热所致,但高温诱发NTD确切的分子机制仍不清楚[3]。转录抑制因子(Hairy and enhancer of split homolog-1,Hes1)属于bHLH碱性-螺 旋-环-螺旋 (basic-helix-loop-helix)转 录 因子超家族HES/HEY成员之一,是Notch信号通路的下游靶基因,下传Notch信号,可使多种不成熟细胞维持在未分化状态,调节细胞对分化诱导因子的反应,维持未分化细胞数量上的稳定,使干细胞处于增殖状态。本实验在高温致NTD模型上,通过Western blot技术和免疫荧光染色技术观察Hes1在胎鼠神经上皮细胞的表达变化,探讨Hes1与神经管发育和高温致畸发生之间的关系,为防治NTD的发生提供理论依据。
材料和方法
1.实验动物及标本制备
成年未经产雌性金黄地鼠50只,购自北京维通利华实验动物技术有限公司,体重100±10g,鼠颗粒饲料喂养,常规饮水。于晚7-9时与雄鼠1∶1合笼,次日查有精子者定为孕第1d(E1)。将孕鼠随机分为对照组和实验组,实验组于E8下午3-4时,置42℃水浴,持续20min,水浴后16h、24h、36h、48h(相当于E8.5、E9、E9.5、E10)将孕鼠处死,剖腹取鼠胚,制备高温致NTD动物模型;对照组置37℃水浴,持续20min,在相同的时间点取材。分别用4%多聚甲醛固定,常规石蜡包埋,连续切片,厚5μm,裱片后备染。
2.Western blot技术
解剖显微镜下分离神经管组织,将神经管组织置于冰上,4℃12000r/min离心15min,提取上清,用BCA法测定蛋白浓度。将20μg蛋白样品进行10%SDS-PADE电泳,恒压90V将蛋白转自PVDF膜(Millipore),转膜时间1h。将PVDF膜置于5%脱脂奶粉室温摇床封闭抗原2h后放入TBST稀释一抗兔抗 Hes1(1∶1000,Abcam)中4℃冰箱孵育过夜,用TBST稀释羊抗兔IgG(1∶2500,Cell Signaling )室温摇床2h,ECL 发光液(Thermo)反应15min,在暗室中进行曝光显影定影。β-actin(1∶500,北京中杉金桥生物技术公司)作为对照,内参检测方法相同。利用凝胶成像仪灰度分析软件进行灰度值分析。
3.免疫荧光染色
切片常规脱蜡入水,0.01mol/L枸橼酸盐缓冲液(pH 6.0)微波抗原修复,冷却后用 PBS冲洗;滴加正常山羊血清,37℃孵育30min,分别滴加兔抗Hes1(1∶200,Abcam),4 ℃冰箱过夜;分别滴加TRITC标记的山羊抗兔IgG(1∶100,北京中杉金桥生物技术公司),避光条件下37℃孵育50min;滴加 Hoechst(1∶800,Molecular Probes),37℃避光孵育30min,PBS冲洗;以防淬灭封片剂封片,4℃冰箱避光保存;荧光显微镜观察、拍照。用PBS代替一抗作为阴性对照,以检查免疫荧光反应的特异性。
4.统计学处理
每组取免疫荧光切片10张,经正置荧光显微镜(LEICADM1000)观察拍片,将所得图片在IPP6.0图像分析软件中进行图像分析,经剪除背景,屏分割和选择删除后,测量各组阳性表达细胞的平均光密度(OD值)。每组取5张Western blot显影胶片置于扫描仪扫描,用Quntity one图像分析软件测定Western blot显示条带的光密度值,进行目的条带与内参条带光密度比值计算、分析。应用SPSS17.0统计分析,将实验组和对照组相应部位的OD值(平均光密度±标准差)作t检验分析。P<0.05为差异有统计学意义,P<0.01差异具有显著性。
结 果
1.Western blot检测结果
E8.5-E10,对照组金黄地鼠胚胎神经管组织中Hes1稳定表达,且无明显量的变化(P>0.05)。与对照组相比,高温组各时间点(E8.5,E9,E9.5,E10)Hes1蛋白的表达呈不同程度的降低,尤其是E8.5和E9.5差异明显(*P<0.05)(图1)。
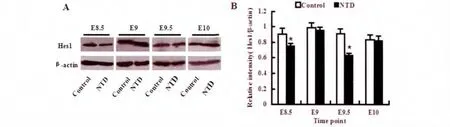
图1 不同时间点对照组和NTD组金黄地鼠神经管组织中Hes1蛋白水平。A.E8.5-E10,对照组和NTD组金黄地鼠Hes1蛋白水平;B.E8.5-E10,对照组和NTD金黄地鼠Hes1蛋白水平的统计学分析(*P<0.05)Fig.1Hes1protein level of neural tube tissue in the control and NTD golden hamster at different points.A.E8.5-E10,Western blot detection of Hes1protein level in the control and NTD golden hamster at different points.B.E8.5-E10,Statistical analysis of Hes1protein level in the control and NTD golden hamster at different points(*P<0.05).
2.Hes1免疫荧光染色结果
E8.5-E10,Hes1在鼠胚神经管上皮细胞和周围间充质细胞的胞浆广泛表达;E9.5、E10,Hes1阳性表达主要分布于腹侧和腹外侧上皮细胞中。E8.5-E10,高温组胚胎神经上皮细胞内的Hes1表达量较对照组均有不同程度的减弱,其中E8.5、E9.5差异显著(P<0.05)(图2)。
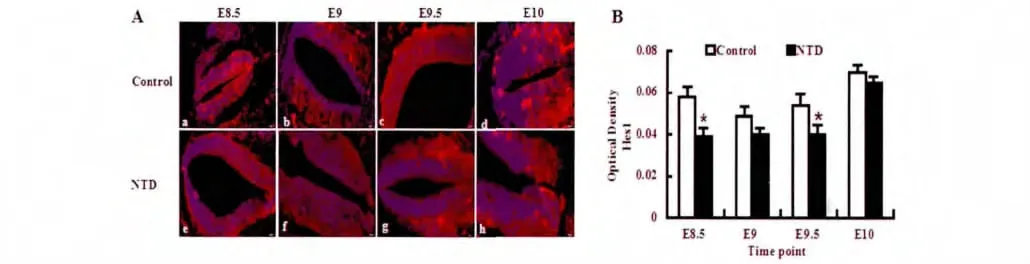
图2 免疫荧光染色示各时间点Hes1在胚胎神经上皮细胞中的表达。A:Hes1免疫荧光染色结果:a-d.分别代表对照组E8.5,E9,E9.5,E10;e-h分别代表高温组E8.5,E9,E9.5,E10。bar=50μm。B:OD值的统计结果(*P<0.05)。红色代表Hes1,蓝色代表Hoechst。Fig.2Hes1immunofluorescent staining of embryonic neuroepithelial cells in different time.A:Hes1immunofluorescent staining results:a-d.control groups E8.5-E10;e-h.NTD groups E8.5-E10.bar=50μm.B:The statistical result of OD.(*P<0.05).Red represents Hes1,blue represent Hoechst.
讨 论
胚胎发育是一个受基因严密调控的过程,致畸原可通过直接或间接作用干扰已知或未知发育关键基因的表达,如发育基因、受体基因、生理因子基因以及原癌基因等[4]。NTD是一组受多因素影响,涉及多个基因的复杂畸形,是遗传因素和环境因素共同作用的结果[5]。其中高温因素包括孕产妇流感、普通感冒、发热和高热等。在小鼠中大约有200个基因突变可以导致NTD,在人类则表现为一个多因子的多基因或寡基因的病因学发生模式,说明NTD中基因-基因之间,基因-环境之间相互作用的重要性[6]。研究发现,高温可使与细胞增殖分化密切相关的蛋白特别是酶蛋白和信息蛋白表达异常,从而干扰细胞分化;高温可使细胞周期阻滞,细胞分裂减少,细胞凋亡增加[7]。
Hes基因家族包括 Hes1-7,其中 Hes1是Notch信号通路的下游基因,大量表达于哺乳动物胚胎发育过程中上皮细胞及神经干细胞[8]。在人类,此基因定位于3q28-q29,转录的mRNA由1471个碱基对组成,共包含有4个外显子,其编码的Hes1蛋白是由280个氨基酸组成,相对分子质量为29400。研究显示胚胎脑组织中的神经前体细胞保持未分化状态需要Hes1的适当表达,但Hes1的持续高表达会抑制细胞的分裂和增殖,因此Hes1在控制神经前体细胞的数量以及神经细胞的分化和增殖中具有十分重要的作用[9]。基因靶向作用研究显示,Hesl基因敲除的小鼠Mashl表达量上调,新生神经细胞过早成熟,最终出现神经管发育缺陷甚至是胚胎的死亡[10]。
实验显示神经管发育过程中Hes1蛋白稳定表达;但高温后,NTD组Hes1表达降低,说明高温抑制了Hes1的表达。Taeko等[11]研究显示Hes1对维持神经干细胞状态发挥重要作用,缺乏Hes1神经干细胞将会过早分化。Hes1可以诱导胚胎干细胞向中胚层分化,但在胚胎干细胞中胚层早期阶段分化停止,说明Hes1表达下调促进神经干细胞中胚层分化,进一步说明Hes1抑制神经干细胞的分化。郇林春[12]等研究发现在神经系统发育过程中,Hes1蛋白功能的缺失可能会造成胚胎的无脑畸形,其过高表达可能会抑制神经祖细胞的增殖和分化,使神经祖细胞保持在未分化状态。在神经干细胞中,Notch信号通路在维持神经干细胞的增殖分化过程中起关键作用,Notch诱导Hes1/5的表达,抑制原始基因表达从而抑制神经细胞的分化[13-14]。以上均说明Hes1抑制神经干细胞的增殖分化,从而维持神经干细胞的原始状态。可见,高温致NTD过程中,高温抑制Hes1的表达,从而影响了神经管的正常发育。由此说明Hes1表达降低在高温致NTD的过程中发挥了重要作用,这为进一步阐明高温致NTD的机制提供了理论依据。
[1]Mitchell LE.Epidemiology of neural tube defects.Am J Med Genet C Semin Med Genet,2005,135(1):88-94
[2]De Marco P.Human neural tube defects:genetic causes and prevention.Biofactors,2011,37(4):261-268
[3]Moretti ME.Maternal hyperthermia and the risk for neural tube defects in offspring:systematic review and meta-analysis.Epidemiology,2005,16(2):216-219
[4]Naha N.Ethanol inhibited apoptosis-related RNA binding protein,Napor-3gene expression in the prenatal rat brain.Med Sci Monit,2009,15(1):BR6-12
[5]Parker SE.Updated National Birth Prevalence estimates for selected birth defects in the United States,2004-2006.Birth Defects Res A Clin Mol Teratol,2010,88(12):1008-1016
[6]Copp AJ ,Greene ND.Genetics and development of neural tube defects.J Pathol,2010,220(2):217-230
[7]Omori H.Effects of heat shock on survival,proliferation and differentiation of mouse neural stem cells.Neurosci Res,2013,25(3):134-142
[8]Ohtsuka.Roles of the basic helix-loop-helix genes Hes1 and Hes5in expansion of neural stem cells of the developing brain.J Biol Chem,2001,276(32):30467-30474
[9]Hatakeyama J,Kageyallla R.Notch1expression is spatiotemporally correlated with neurogenesis and negatively regulated by Notch1independent Hes genes in the devveloping nervous systerm.J Cerb Cortex,2006,16(Suppl 1):132-137
[10]Hammerle B,Tejedor FJ.A Novel function of DELTA-NOTCH signalling mediates the transition from proliferation toneurogenesis in neural progenitor cells J.PLoS ONE,2007,2(11):1169-1173
[11]Taeko Kobayashi.Hes1regulates embryonic stem cell differentiation by suppressing Notch signaling.Genes to Cells,2010,15,689-698
[12]郇林春,赵旺淼,杨新宇等.Hes1蛋白在神经细胞生成中的作用,国际神经病学神经外科学杂志 ,2008,35(5):438-441
[13]Nishimoto Y,Okano H.New insight into cancer therapeutics:induction of differentiation by regulating the Musashi/Numb/Notch pathway.Cell Res,2010,20:1083-1085
[14]Imayoshi I,Sakamoto M,Yamaguchi M,et al.Essential roles of Notch signaling in maintenance of neural stem cells in developing and adult brains.J Neurosci,2010,30:3489-3498
