不同品种猪背最长肌肌苷酸含量及相关基因表达的比较*
2014-12-16张淑静刘力源殷宗俊丁月云王菊花周杰
张淑静,刘力源,殷宗俊,丁月云,王菊花,周杰
(安徽农业大学动物科技学院,安徽 合肥,230036)
研究控制肉质相关性状的遗传基础表明[1-3],在鸡的第1号染色体94cM处、牛的第5号染色体119.7cM处以及1~1.78(cM)处存在与肉多汁性、剪切力、大理石花纹等相关的数量性状位点(QTLs)。因此,根据 Animal QTLdb[4]提供的这些 QTLs信息,在猪的基因组中比对出了相应的染色体位置。其中,腺苷酸琥珀酸裂解酶(adenylosuccinate lyase,ADSL)以及甘氨酰胺核苷酸合成酶(glycinamide ribonucleotide synthetase,GARS)、5-氨基咪唑核苷酸合成酶(aminoimidazole ribonucleotide synthetase,AIRS)和甘氨酰胺核苷酸转甲基酶(glycinamide ribonucleotide transformylase,GART)基因分别位于猪第5号染色体7.19~7.23(cM)和第13号染色体119.4~119.5(cM)处。而文献表明[5],ADSL 和 GARS-AIRSGART是肌苷酸(inosine monophosphate,IMP)合成相关的2个关键酶基因。
长期以来,研究猪的重点主要集中在提高生长速度和增加瘦肉率方面,在肉品质改善和提高以及肉质性状遗传基础等方面缺少关注,这样导致了商品猪猪肉口感下降严重[6-7]。许多学者认为猪肉的香味和适口性可能与肉中的肌内脂肪、肌苷酸、游离脂肪酸组分等呈味物质有关[8-10]。其中IMP鲜味最强,是肉质鲜味的重要成分[5]。IMP在北京油鸡中的遗传力为0.23,属中等遗传力[11],目前国际上已把 IMP含量作为一个影响鸡肉风味的重要指标。然而国内外有关猪IMP含量以及与IMP相关基因的研究较少,且结果不一[12-16]。本实验选取背最长肌IMP含量为肉质性状指标,研究影响IMP含量的基因ADSL与GARS-AIRS-GART在2种安徽地方猪种圩猪、六白猪以及外来猪种长白猪肝脏、心脏、背最长肌组织中的表达,以检测这些基因在肝脏、心脏中转录水平以及在背最长肌组织中转录水平与IMP含量的关系。
1 材料和方法
1.1 试验动物及样品采集
各试验用猪分别从安徽省安泰农业开发有限公司圩猪保种场选取待宰商品猪圩猪21头,望江县现代良种养殖有限公司选取六白猪13头,安徽长风农牧科技有限公司选取长白猪6头,常规饲养管理。(出栏日期地方猪10个月 ,长白猪6个月)屠宰前禁食12 h,正常饮水。屠宰前禁喂24 h称重,按“瘦肉型猪胴体性状测定技术规范(NY/T825-2004)”方法屠宰,屠宰时取腰椎处背最长肌,测定肌苷酸含量,分别取圩猪,六白猪,长白猪的心脏、肝脏、背最长肌新鲜组织100 mg,液氮冷冻,后转移至 -80℃ 冰箱保存。
1.2 主要仪器、试剂
仪器:高速冷冻离心机(Sigma,德国),PCR仪(伯乐,美国),紫外分光光度计(岛津,日本),Rotorgene 6000荧光定量 PCR仪(Corbett,澳大利亚),SMA1000超微量紫外分光光度计(Merinton,中国),高效液相色谱仪Aiglent1100、ZORBAX色谱柱SB-C18(5 μm,4.6 mm ×250 mm)、自动进样器 G1313A(100 μL)、四元泵 G1311A(Agilent,美国),圆周振荡器 MS3基本型(IKA,德国),离心机 Eppendor FAG22331(Hamburg,德国),超纯水器原子Ⅱ型(成都康林科技有限公司),组织匀浆机AM-6(经济制作所,日本),超声波清洗机KQ-300DE(昆山市超声仪器有限公司),pH测定仪HI-9025(Hanna,意大利)。
试剂:Trizol Reagent、cDNA反转录试剂盒、Premix TaqTMVersion 2.0、SYBR○RPremix Ex TaqTMⅡ(大连宝生物),肌苷酸标准品(HPLC级,Sigma,美国),高氯酸(GR,含量70% ~72%)上海金鹿化工技术有限公司,甲醇、乙腈(Fisher,美国)。
1.3 肌苷酸含量测定[17]
肌苷酸:高效液相色谱法测定肌肉中肌苷酸的含量,色谱柱:3.9 mm ×30 cm,C18柱。
1.3.1 样品前处理
于屠宰后1.5 h内迅速采集背最长肌,当冷藏时间达到24 h时,取出肉样制备肌苷酸测定样,使用绞肉机绞碎肌肉样品,称取5g,准确至0.000 1 g,置于50 mL塑料离心管中,分次加入共20 mL 6%HClO4,用高速组织匀浆机匀浆。匀浆液以8 000 r/min离心13 min,过滤于100 mL三角瓶中。将沉淀物用15 mL 6%HClO4再次匀浆、离心,合并2次上清液,用5.0 mol/L和0.5 mol/L NaOH调 pH值至6.5,转移至100 mL容量瓶中,定容摇匀。测定前用0.45 μm滤膜过滤后用于HPLC分析。
1.3.2 色谱条件
色谱柱:Agilent 1 100 d C18柱(5 μm,Φ4.6 mm ×150 mm);流动相:50 mmol/L pH 6.5甲酸铵缓冲溶液(含5%甲醇);流速:1 mL/min;柱温:25℃;进样量:5μl;紫外检测波长:254 nm;运行时间:标准工作液运行4 min,样品提取液运行11 min。
1.4 组织RNA提取及反转录[18]
分别取圩猪,六白猪,长白猪的心脏、肝脏、背最长肌新鲜组织100 mg,液氮冷冻,按Trizol Reagent试剂盒使用说明提取各组织总RNA。测定RNA的浓度和纯度,甲醛变性凝胶电泳检测RNA的完整性。RNA样品于-80℃ 冰箱中保存。利用反转录试剂盒合成cDNA。
按Trizol Reagent试剂盒要求提总RNA。紫外分光光度计测定OD260/OD280值在1.8~2.0为合格,根据OD260值计算RNA的产量。甲醛变性凝胶电泳检测RNA的质量;用反转录试剂盒对RNA进行反转录。
1.5 背最长肌中ADSL和GARS-AIRS-GART基因表达量的Q-PCR检测
根据Genbank中猪 ADSL、GARS-AIRS-GART和内标β-Actin cDNA序列,利用Primer 5.0软件设计引物序列,由上海生工生物公司合成引物。引物序列和PCR参数见表1。
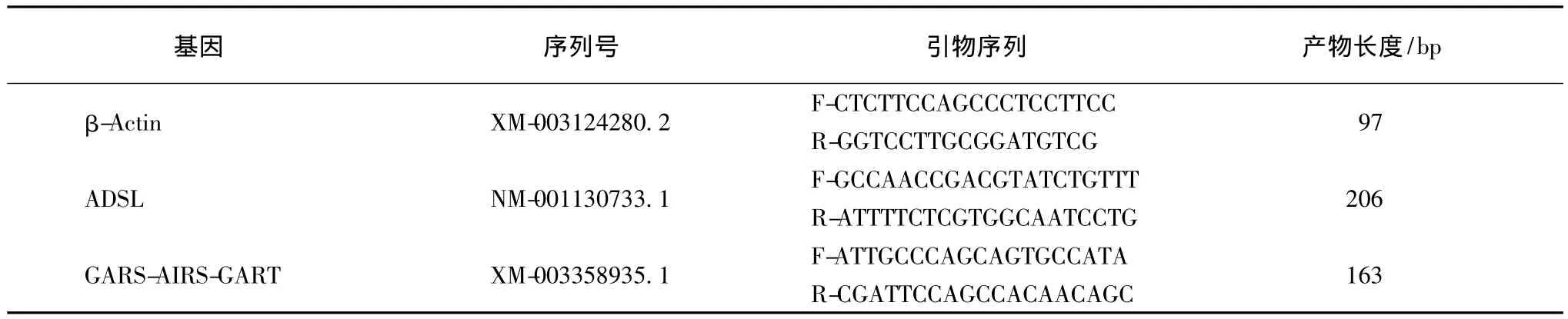
表1 用于Real-time quantitative PCR的引物序列及PCR参数Table 1 Primer sequences and parameter used for real-time quantitative PCR
普通PCR检测cDNA纯度,相关参数:95℃预变性5 min,95 ℃变性 30 s、58 ℃ 退火 30 s、72 ℃ 延伸30 s、30个循环,最后72℃延伸10 min。取产物5 μL在1%的琼脂凝胶上电泳,凝胶成像系统下观察结果。荧光实时定量 PCR扩增,反应体系 25 μL:SYBR○RPremix Ex TaqTMⅡ12.5 μL,上、下游引物(10 μmol/L)各 1 μL,cDNA 2 μL,ddH2O(高压)8.5 μL。95℃预变性5 min,95℃变性10 s、57.4℃退火20 s、72℃延伸15 s,45个循环。于72℃ 15 s时收集荧光值,从而得出每一个循环结束后cDNA扩增后的量。
2 统计分析
用 2-ΔΔCT法对有效性数据进行统计分析[20]。目的基因的相对表达量为 2-ΔΔCT,ΔΔCT =(CT.Target gene-CT.β-actin)x-(CT.Target gene-CT.β-actin)control。数据用平均值±标准误(M±SE)表示,使用SPSS16.0软件对结果中的数据进行分析,均值差异显著性采用One-Way ANOVA统计。显著性差异水平为P<0.05,极显著性差异水平为 P<0.01。采用Bivariate correlation分析进行相关性分析。
3 结果分析
3.1 圩猪,六白猪,长白猪肌肉中肌苷酸含量比较
长白猪背最长肌中肌苷酸极显著高于六白猪与圩猪(P<0.01),而圩猪肌肉中肌苷酸和六白猪肌肉中肌苷酸含量无显著差异(图1)。

图1 不同品种猪肌苷酸含量差异Fig.1 Comparison of IMP content between different breeds of pigs
3.2 圩猪,六白猪和长白猪肝脏,心脏和背最长肌组织中ADSL mRNA表达情况
3个猪种ADSL基因在相同组织的表达模式不尽相同,圩猪肝脏组织中ADSL mRNA表达量分别显著和极显著高于六白猪(P<0.05)和长白猪(P<0.01);圩猪和长白猪心脏ADSLmRNA表达量显著高于六白猪(P<0.05);圩猪背最长肌组织ADSL mRNA表达量显著高于六白猪(P<0.05),而六白猪与长白猪无显著差异。不同组织ADSL基因表达模式在3个猪种基本相同,均表现为背最长肌中最高,心脏次之,肝脏最低的趋势。其中在圩猪背最长肌的表达量显著高于肝脏(P<0.05)(表2)。
3.3 圩猪,六白猪和长白猪心脏,背最长肌和肝脏组织中GARS-AIRS-GART mRNA表达情况
3个猪种GARS-AIRS-GART基因在相同组织的表达模式不尽相同,除长白猪在背最长肌组织中显著高于六白猪(P<0.05)外,其他均无明显差异。GARS-AIRS-GART基因在3种猪的肝脏,心脏,背最长肌的表达模式基本相同,即均表现为背最长肌最高,肝脏次之,心脏最低的趋势(表3)。
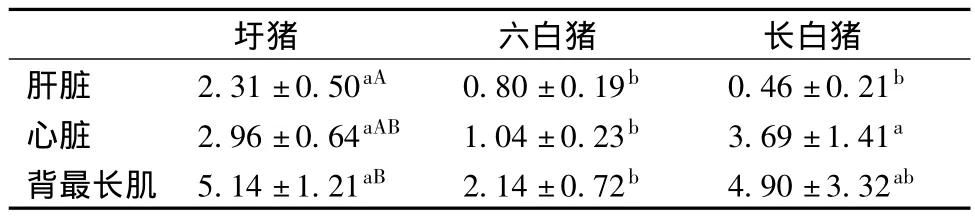
表2 圩猪,六白猪和长白猪肝脏,心脏和背最长肌组织中ADSL mRNA的表达情况Table 2 Expression levels of ADSL mRNA of liver,heart and longissimus dorsi muscle in Wei Pig,Liubai pig and Landraces

表3 圩猪,六白猪和长白猪心脏,背最长肌和肝脏组织中GARS-AIRS-GART mRNA的表达Table 3 Expression levels of GARS-AIRS-GART mRNA of liver,heart and longissimus dorsi muscle in Wei pig,Liubai pig and Landraces
3.4 基因表达量与IMP含量的相关性分析
ADSL基因在长白猪肝脏的表达量与长白猪背最长肌的IMP含量显著负相关(P<0.05)。GARSAIRS-GART基因在圩猪肝脏和六白猪心脏的表达量分别与圩猪背最长肌和六白猪背最长肌的IMP含量呈极显著负相关(P<0.01)(表4)。
4 讨论
肌苷酸是影响肌肉鲜味的主要成分之一,屠宰后动物机体正常的生理代谢功能遭到破坏,细胞内糖原有氧代谢转化为无氧酵解,生成乳酸使pH值下降,同时肌肉中ATP减少使肌质网功能失常,ATP酶活化,剩余ATP在ATP酶的作用下分解生成ADP,ADP在多种酶的作用下生成肌苷酸,并进一步水解生成次黄嘌呤和核糖。肌肉中次黄嘌呤核苷酸及其他分解产物的积累可增加肉的鲜味[16]。呼红梅等的研究表明肉质优良的地方品种猪肌肉IMP含量高于外来瘦肉型品种及杂交猪[16]。而刘家忠等报道梅山猪与杜洛克猪肌肉IMP含量无显著差异[12];陶勇等报道地方品种猪与外来品种及杂交猪肌肉IMP含量没有明显差异[13];郭建凤报道长白猪、大约克及杜洛克猪肌肉IMP含量差异不显著[15];张克英等发现荣昌猪与长白猪IMP无品种差异,但均高于大约克猪[14]。本实验中发现长白猪背最长肌肌肉中肌苷酸显著高于六白猪与圩猪。由于肌苷酸的含量受动物的品种、饲料、饲养环境、屠宰时间、肌肉酸碱度、屠宰后处理等因素的影响[21-24],具体原因还有待进一步研究。

表4 ADSL和GARS-AIRS-GART基因表达量与IMP含量的相关性分析Table 4 Correlation analysis between the expression level of ADSL and GARS-AIRS-GART gene and the IMP content
IMP在体内的合成代谢过程十分复杂,涉及10种关键酶,由ADSL基因所编码的腺苷酸琥珀酸裂解酶是嘌呤核苷酸合成过程中的关键酶之一。ADSL主要催化AMP生化合成的2个反应:(1)由SAC IAR生成AICAR的反应;(2)由腺苷酸琥珀酸生成腺苷酸单磷酸的反应[25]。而 GARS、GART和 AIRS分别催化次黄嘌呤核苷酸合成的第二、三和五步反应,从而加速次黄嘌呤和黄嘌呤的分解,而肌肉中次黄嘌呤核苷酸及其他分解产物的积累可增加肉的鲜味[26,27]。Ye等对北京油鸡的研究结果得出以下结论,ADSL和GARS-AIRS-GART基因可能是影响肌肉中IMP含量的主效基因或与主效基因密切相关,由于IMP是最重要的风味物质之一,在ADSL和GARSAIRS-GART 2个基因中发现的标记以及相关基因型都可以看作提高鸡肉肉质的潜在分子标记[10]。Shu等运用PCR-SSCP技术对鸡GARS-AIRS-GART基因和肌肉IMP含量之间的关系进行研究,发现某些位点的突变对肌肉IMP的含量有一定的影响[21]。
现有的研究多集中于对禽类ADSL和GARSAIRS-GART基因多态性与IMP含量相关性的研究,对于猪ADSL和GARS-AIRS-GART基因组织表达量的研究很少,仅见刘基伟报道的成年通城猪 ADSL mRNA表达水平由高到低依次为背最长肌,肾脏,肝脏和心脏[28]。在本实验中,ADSL基因在3种猪表达模式基本相同,均表现出背最长肌中最高,心脏次之,肝脏表达量最低的趋势。Tian等对草鱼的研究表明,ADSL基因在肌肉组织中表达量最高,剩下的依次为心脏、脑、肝脏、肠、肾脏和鳃[29]。刘长青等发现寿光鸡ADSL表达最多的是胸肌,其次是肝脏、脾、肾和腿肌,在心、肺和脑中表达量较低[30],这些结果均表明肌肉中ADSL基因的表达量最高,与本实验的结果一致。目前尚未见GARS-AIRS-GART基因在组织中表达量的研究报道,本研究发现GARS-AIRS-GART基因在背最长肌中的表达量最高,肝脏次之,心脏较低,3种猪的表达模式基本相同。
徐善金等发现,鸭ADSL基因的CDS序列与鸡的同源性极高,在肌肉组织中的表达量与对应 IMP含量表现为不同品种、同一品种不同性别、同一性别不同部位间极显著或显著差异,相关性分析表明,ADSL基因表达量与IMP含量呈对数函数关系,两者显现出显著正相关[31]。
而本实验结果表明,长白猪的背最长肌肌苷酸含量高于圩猪和六白猪。ADSL和GARS-AIRS-GART mRNA表达量均表现为在背最长肌中高于心脏和肝脏的趋势。此外,相关性分析表明,ADSL基因和GARS-AIRS-GART基因表达量与IMP含量负相关,与在禽类的结果不同,这可能与畜禽的种属差异有关,其具体的作用机制还有待进一步研究。
[1] Gill J L,Bishop S C,McCorquodale C,et al.Associations between single nucleotide polymorphisms in multiple candidate genes and carcass and meat quality traits in a commercial Angus-cross population[J].Meat Sci,2010,86(4):985-93.
[2] Atzmon G,Blum S,Feldman M,et al.QTLs detected in a multigenerational resource chicken population[J]J Hered,2008,99(5):528-38.
[3] McClure M C,Morsci N S,Schnabel R D,et al.A genome scan for quantitative trait loci influencing carcass,post-na-tal growth and reproductive traits in commercial Angus cattle[J].Anim Genet,2010 ,41(6):597-607.
[4] http://cn.animalgenome.org/cgi-bin/QTLdb/index.
[5] Ye M H,Chen J L,Zhao G P,et al.Correlation between polymorphisms in ADSL and GARS-AIRS-GART genes with inosine 5'-monophosphate(IMP)contents in Beijingyou chickens[J].British Poultry Science,2010,51(5):609-613.
[6] 潘刚.影响猪肌肉生长及肉质相关四个候选基因的分离、鉴定[D].武汉:华中农业大学,2008.
[7] 王珺,尚永彪,李洪军.PSE猪肉的鉴别与控制[J].食品工业科技,2012,14:380-384.
[8] 孟令军.荣昌乳猪理化特性及主体风味物质的研究[D].重庆:西南大学,2008.
[9] 郭辽朴.荣昌乳猪与PIC乳猪不同部位肌肉理化特性及主体风味物质研究[D].重庆:西南大学,2008.
[10] 王薇.山猪肉质性状主要相关基因的遗传特性及其对肉质的作用和影响[D].南京:南京师范大学,2012.
[11] Chen J L,Zhao G P,Zheng M Q,et al.Estimationof genetic parameters for contents of intramuscular fat andinosine-5'-monophosp-hate and carcass traits in Chinese Beijing-You chickens[J].Poult Sci,2008,87:1 098-1 010.
[12] 刘家忠,陈润生.猪肉中肌苷酸含量及其在冷藏和加热过程中变化规律的研究[J].养猪,1991(3):10-12.
[13] 陶勇,刘宗华,张牧,等.不同组合猪肌肉肌苷酸含量的分析[J].黑龙江畜牧兽医,2001(10):17.
[14] 张克英,陈代文,胡祖禹.次黄嘌呤核苷酸和胶原蛋白与猪肉品质的关系研究[J].四川农业大学学报,2002,20(1):56-59.
[15] 郭建凤,呼红梅,武英,等.长白猪、大约克及杜洛克肌肉品质研究[J].家畜生态学报,2009,30(1):34-39.
[16] 呼红梅,郭建凤,朱荣生,等.不同品种猪背最长肌肌苷酸和肌内脂肪含量的比较[J].扬州大学学报:农业与生命科学版,2011,32(3):34-36.
[17] 吴莹莹,李文英,谢明,等.高效液相色谱法测定肌肉中肌苷酸的含量[J].食品科学,2005,26(12):191-192.
[18] 李国喜,宁小敏,李新建,等.猪组织中miR-10 3实时定量PCR分析时合适内参的确定[J].中国生物化学与分子生物学报,2009,25(12):1 149-1 154.
[19] 付永,魏雅萍,孟茹,等.黄牛牦牛和犏牛睾丸组织DAZL基因实时荧光定量PCR检测方法的建立[J].西北农业学报2013,22(1):12-18.
[20] Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J].Methods,2001,25(4):402-408.
[21] 孙玉民,罗明.畜禽肉品学[M].济 南:山东科技出版社,1993.
[22] Tikk M,Tikk K,Tørngren MA,et al.Development of inosine monophosphate and its degradation products during aging of pork of different qualities in relation to basic taste and retronasal flavor perception of the meat[J].J Agric Food Chem,2006,54(20):7 769-7 777.
[23] 汪以真,许梓荣,冯杰.甜菜碱对猪肉品质的影响及机理探讨[J].中国农业科学2000,33(1):94-99.
[24] 陈国宏,侯水生,吴信生,等.中国部分地方鸡肌肉肌苷酸含量研究[J].畜牧兽医学报,2000,31(3),211-215.
[25] SHU J T,BAO W B,ZHAN X Y,et al.Combined effect of mutations in ADSL and GARS-AIRS-GART genes on IMP content in chickens[J].British Poultry Science,2009,50:680-686.
[26] Julie L C,Richard G M.Analysis of a mouse gene encoding three steps of purine synthesis reveals use of an intronic polyadenylation signal without alternative exon usage[J].The Journal of Biological Chemistry,1995,270(27):1 823-1 832.
[27] Disha B,Krishnadas N.Potential interaction between the GARS-AIRS-GART Gene and CP2/LBP-1c/LSF transcription factor in down syndrome-related alzheimer disease[J].Cell Mol Neurobiol,2007,27:1117-1126.
[28] 刘基伟,徐日福,李奎,等.猪ADSL基因克隆及其在部分组织中的 mRNA定量表达[J].畜牧与兽医,2010,42(6):22-27.
[29] YUAN T,GU J R,GU W B,et al.Molecular cloning,characterization and expression analysisof adenylosuccinate lyase gene in grass carp(Ctenopharyngodon idella)[J].Mol Biol Rep,2011,38:2 059-2 065.
[30] 刘长青,张洪海,文杰,等.寿光鸡腺苷酸琥珀酸裂解酶ADSL基因的表达与克隆化细胞株的筛选[J].畜牧兽医学报,2009,40(7):982-991.
[31] 徐善金,虞德兵,汪峰,等.鸭腺苷琥珀酸裂解酶基因序列特征及表达与肌肉肌苷酸含量的相关性分析[J].中国农业科学,2012,45(4):774-785.
