不同储藏条件下玉米中霉菌对黄曲霉毒素B1的影响*
2014-12-16李听听陈伟李广富卢中一刘锦绣
李听听,陈伟,李广富,卢中一,刘锦绣
(山东农业大学食品科学与工程学院,山东泰安,271018)
我国是储粮大国,玉米是我国三大主要粮食品种之一,产量约为全国粮食总产量的1/4[1]。玉米属于不耐储品种,在储藏期间会受到各种微生物特别是霉菌的危害,霉菌感染粮谷作物,能引起食物发生腐败变质,尤其在高湿高温的环境下,霉菌生长旺盛,同时其分泌的毒素对人体有很强的致癌作用,因此,防止真菌污染和真菌毒素是粮食储藏过程中最关键的问题[2-3]。
在各类霉菌产生的毒素中,黄曲霉毒素B1最为常见,且毒性最大[4]。高效液相色谱法测定黄曲霉毒素B1是目前国内使用最多、最为权威的方法,具有高效、准确性好、灵敏度高、检测限低等特点[5]。
早在20世纪50年代,Lichtwardt等对储粮真菌进行了调查和分类,得出危害玉米的主要微生物是霉菌,发现灰绿曲霉和白曲霉是引起储粮劣变主要真菌;随后,Pitt和Magan等对储粮真菌生长及产毒所需最低水分活度做了研究[6-7],表明小麦水分含量在13.0%以下,就可以阻止大部分微生物的生长;Ayerst等研究了主要储粮真菌的生长条件[8],得出多数霉菌生长的最适温度是25~30℃,繁殖所需最低含水量一般为13%~18%。
本实验设定不同的相对湿度和水分含量,对储藏玉米中的霉菌和黄曲霉毒素B1进行测定,并分析粮食储藏过程中黄曲霉毒素B1与霉菌的关系,探讨不同相对湿度储藏环境下,优势真霉菌活动差异性、黄曲霉毒素B1产量差异性及相关性。
1 材料与方法
1.1 仪器与试剂
1.1.1 玉米原料
岱玉D4收获于2013年10月份,购买于泰安市农贸市场。
1.1.2 设备与仪器
Agilent 1260高效液相色谱仪,杭州瑞析科技技术有限公司;Agilent 1260荧光检测器,杭州瑞析科技技术有限公司;BIBBY RE200旋转蒸发仪,宁波金晟杰机电有限公司;IKA涡旋振荡器,常州冠军仪器制造有限公司;N-EVAPTM112氮吹仪,美国Organomation Associates公司;JFSD-70实验室粉碎磨,上海市嘉定粮仪器厂;微型高速离心机,上海安亭科学仪器厂。
1.1.3 主要试剂
黄曲霉毒素B1标准溶液:美国02si;乙腈(色谱纯):天津市凯通化学有限;甲醇、正己烷及氯仿(分析纯):天津市凯通化学有限;三氟乙酸(分析纯):宏欣精细化工;氯霉素:Solarbio。
1.2 实验方法
1.2.1 玉米的水分调节[9]
将水分调节至 12.41%、14.30%、15.89%、17.62%、19.88% 五个梯度。将清理的玉米分5等份,每份约5 kg,置于塑料容器中,采用喷雾方法,加入不同量的无菌水,按其含水量计算调节至目标含水量所需的理论添加无菌水量,用喷雾器分3次将理论添加无菌水量的蒸馏水喷到粮食表面,边喷边搅拌,以保证着水的均匀。着水后的玉米放置塑料袋内,排出袋中空气,密封于冰箱4℃冷藏保存,平衡24 h。
1.2.2 模拟储藏
干燥器(180 mm)内放置不同饱和盐溶液,以形成不同相对湿度的密闭环境件。分别以NaCl、KNO3和KCl的饱和盐溶液配置在30℃形成75%、84%、92%不同的相对湿度。将称取的玉米样品500 g分别放在无菌透气保鲜袋内,将保鲜袋放在装有不同饱和盐溶液的干燥器内,置于30℃恒温培养箱中培养。
1.2.3 水分的测定
玉米样品含水率的测定按照(GB5497-1985粮食、油料检验水分测定法)[10]执行。
1.2.4 玉米霉菌菌落计数及分离与鉴定
参照国标食品卫生微生物学检验霉菌和酵母计数(GB 4789.15-2010)[11]。玉米中霉菌的分离及鉴定参照(GB/T 4789.16)[12]、中国真菌志第五卷“曲霉属及相关有性型”和(齐祖同,1997)执行[13]。
1.2.5 玉米黄曲霉毒素B1的提取和净化
本实验参照谢刚[14]等人的方法并加以改进。将储藏35 d玉米样品粉碎后取5 g于150 mL的锥形瓶中分别加入25 mL的甲醇水(55∶45),用保鲜膜封口,放在超声波清洗器中超声20 min后取出,将溶液全部倒入离心管中,离心5 min(转速为3 500 r/min)。离心结束后,取上层清液4 mL于另一离心管中,加入4 mL CHCl3,涡旋后静置分层,然后用移液枪吸取下层液体于试管中,再加4 mL CHCl3重复上述操作,合并CHCl38 mL,60℃水浴氮吹干,注意避免液体鼓泡、飞溅。
1.2.6 玉米黄曲霉毒素B1的衍生
向剩余物中加入200 μL正己烷和100 μL三氟乙酸,塞上塞子,放在40℃的水浴锅中衍生20 min,60℃水浴氮吹干,用15%的乙腈定容至1 mL,置于注射器中,用0.22 μm的滤膜过滤于进样瓶中,供测定用[4]。
1.2.7 标准工作液的衍生
吸取黄曲霉毒素标准溶液200 μL,在60℃水浴下氮气吹干,衍生化方法同1.2.6。
1.2.8 液相色谱条件
色谱柱:Diamonsil C18(2)(250 mm×4.6 mm i.d,5 μm 粒度)。流动相∶乙腈∶水(15∶85);流速:1 mL/min;进样量:20 μL;柱温:30℃。荧光检测器:激发波长360 nm,发射波长440 nm。注:宜在色谱柱前加保护柱(或预柱),以延长色谱柱使用寿命。
1.2.9 黄曲霉毒素B1的换算公式
y=(0.402 9x-0.564 7)×25/4/5
式中:y,每kg玉米中所含黄曲霉毒素B1的量,μg/kg;x,峰面积;25,制备的毒素提取液的总量是25 mL;4,从25 mL中取了4 mL进行检测;5,样品中玉米的质量(5 g)。
1.3 数据统计方法
数据处理和分析采用SAS v9.0软件。
2 结果与分析
2.1 储藏期间玉米水分变化
在温度30℃,相对湿度75%的环境中(如图1),玉米前14 d储藏过程中,5个水分梯度呈现上升趋势。可能是由于在低的相对湿度环境下,玉米解吸率大于回收率。随着储藏时间延长,玉米微生物开始大量繁殖,尤其是霉菌,大量分解着玉米中的淀粉等有机质产生大量水分,通过湿热交换,玉米中的水分大量挥发,因此余下21 d的储藏时间内,小麦水分会呈现微下降趋势[15]。

图1 RH 75%的环境中玉米水分含量的变化Fig.1 The corn moisture changes under relative humidity 75%environment
在温度30℃,相对湿度84%和92%的环境(如图2、图3),玉米在整个35 d的储藏时间,两个环境下含水量不同的玉米整体呈现上升趋势,且环境湿度较高的RH 92%的玉米水分上升趋势较明显。这是因为中、高湿度环境下的基质食的解吸率小于回收率,直至基质含量与环境湿度相平衡为止[16]。经单因素方差分析,低、中、高三个环境下不同含水量的玉米,在储藏35 d的过程中,水分含量无显著性差异(P>0.05)。
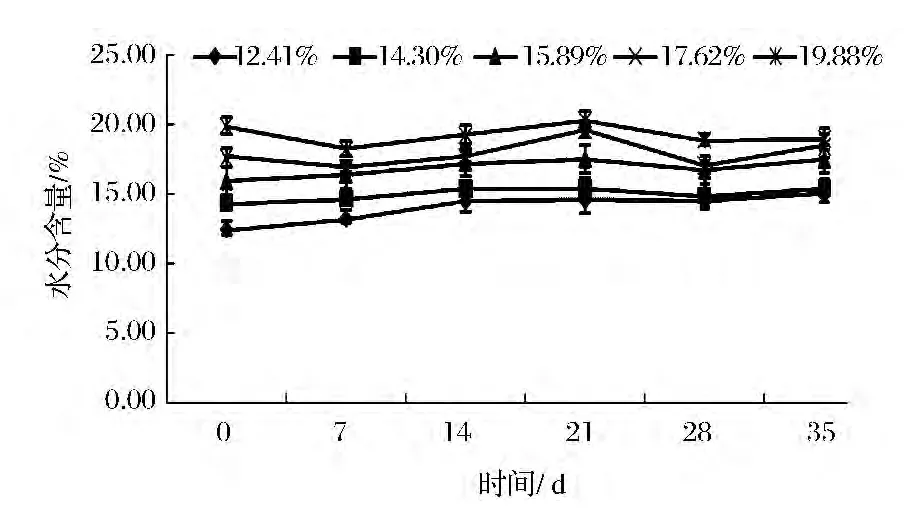
图2 RH 84%的环境中玉米水分含量的变化Fig.2 The corn moisture changes under relative humidity 84%environment
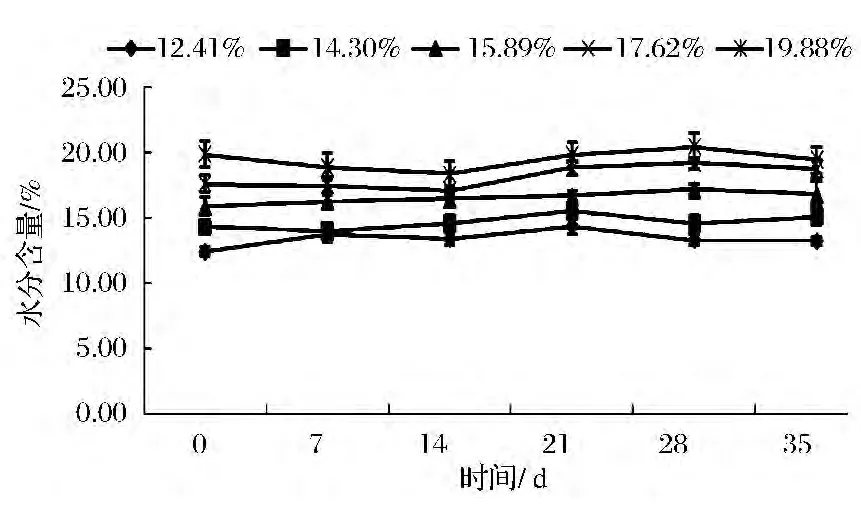
图3 RH 92%的环境中玉米水分含量的变化Fig.3 The corn moisture changes under relative humidity 92%environment
2.2 黄曲霉毒素B1标准曲线方程
黄曲霉毒素B1浓度与峰面积呈现良好的线性回归方程y=0.402 9x-0.564 7,相关系数0.999 5。其中,y:浓度(mg/mL);x:峰面积。
2.3 不同储藏环境下霉菌、木霉、黑曲霉、黄曲霉与黄曲霉毒素B1的量间关系
从表1可以看出在温度30℃,相对湿度75%的环境中霉菌和木霉的总量随玉米中水分含量的增加而呈现上升趋势,而此环境中黑曲霉、黄曲霉的量及黄曲霉毒素B1积累量随水分增加均呈现先增加后下降的趋势,两种菌均在初始含水量为15.89%处取得最大菌落数,且黄曲霉毒素B1在水分含量处有最大毒素积累量,是初始毒素量的29.88倍。当玉米中的水分含量超出15.89%,通过营养竞争,整个储藏过程中木霉成为第一优势菌,使得黄曲霉的数量大量锐减,从菌源就抑制了AFTB1量。在相对湿度75%的环境下,玉米的黄曲霉毒素的B1量随黄曲霉的增多而增多,且最佳的产毒基质为初始含水量15.89%。
在温度30℃相对湿度84%的环境不同含水量的玉米经过35 d的储藏后(如表2),随着玉米初始含水量增加,玉米的霉菌总量、黑曲霉、木霉、黄曲霉总量及黄曲霉毒素B1的积累量均有相同的变化趋势,都在初始含水量14.30%取得最大值,且AFTB1的量是初始值的11.25倍。当玉米含水量大于14.30%时,虽然黄曲霉数量随水分含量增加,但木霉量增加幅度更大,而AFTB1确呈减少趋势,这可能因为木霉不仅通过营养竞争抑制黄曲霉数量,还能够降解或吸附 AFB1[17]。

表1 RH 75%水分含量霉菌、木霉、黑曲霉、黄曲霉与AFTB1的量Table 1 The number of mould,Trichoderma viride,Aspergillus niger,Aspergillus flavus and the amount of aflatoxin B1 under the relative humidity 75%environment

表2 RH 84%水分含量霉菌、木霉、黑曲霉、黄曲霉与AFTB1的量Table 2 The number of mould,Trichoderma viride,Aspergillus niger,Aspergillus flavus and the amount of aflatoxin B1 under the relative humidity 84%environment
在相对湿度92%,温度30℃的环境中(如表3),经过35 d的储藏五组不同水分含量的玉米霉变比较严重,说明高湿环境更适合霉菌的生长,并且初始水分含量较大的17.62%、19.88%的两组玉米中黄曲霉的量明显高于初始含水量为15.89%的玉米,但是黄曲霉毒素B1的量却远远小于初始含水量为15.89%的玉米。这可能因为,黑曲霉[18-19]和木霉[20]均能通过细胞壁吸附、产生某种降解AFTB1的物质和营养竞争作用等多种方式抑制了黄曲霉生长、产毒及增强了玉米上毒素的降解能力;也有可能,此环境条件不适合黄曲霉产毒。再者也进一步说明了,并不是黄曲霉的数量越多,产生毒素的量就越多,黄曲霉产毒是多种因素共同作用的结果。经单因素方差分析,各环境条件下不同含水量玉米,储藏35 d后,微生物各指标与黄曲霉毒素B1均有显著性差异(P <0.05)。

表3 RH 92%水分含量霉菌、木霉、黑曲霉、黄曲霉与AFTB1的量Table 3 The number of mould,Trichoderma viride,Aspergillus niger,Aspergillus flavus and the amount of aflatoxin B1 under the relative humidity 92%environmen
2.4 相关性分析
相关性分析表明,经温度30℃,相对湿度75%环境储藏35 d的玉米,玉米上黄曲霉和黑曲霉总数均与黄曲霉毒素B1呈极显著正相关性(P<0.001,k≥0.997);霉菌总数和木霉总数与黄曲霉毒素B1呈负相关性。在温度30℃相对湿度84%环境下储藏35 d的玉米,其黑曲霉总数与黄曲霉毒素B1呈显著正相关性(P<0.05,k=0.921);霉菌总数、黄曲霉总数和木霉总数均与黄曲霉毒素B1呈正相关性,而玉米上的水分含量与黄曲霉毒素B1积累量呈明显负相关性。经温度30℃相对湿度92%环境下储藏35 d后的玉米,其上黄曲霉总数和水分含量与黄曲霉毒素B1的积累量呈负相关性;霉菌总数、木霉总数和黑曲霉总数与黄曲霉毒素呈正相关性。
综上3个不同的储藏环境相关性的分析,在中、高湿度的环境,玉米上的黄曲霉毒素B1与黄曲霉间的相关性越来越不明显,即受其他霉菌的影响越来越显著。
3 结论
(1)不同储藏环境下,玉米中霉菌的生长受环境湿度和玉米本身水分含量的双重影响,随着环境湿度和水分含量的增加,霉菌的数量也增加,但玉米本身水分含量对霉菌生长影响更显著;玉米含水量变化不仅与玉米储藏环境有关,还与微生物的量有一定的关系,玉米含水量最终表现形式是环境因素和生物因素综合作用的结果。
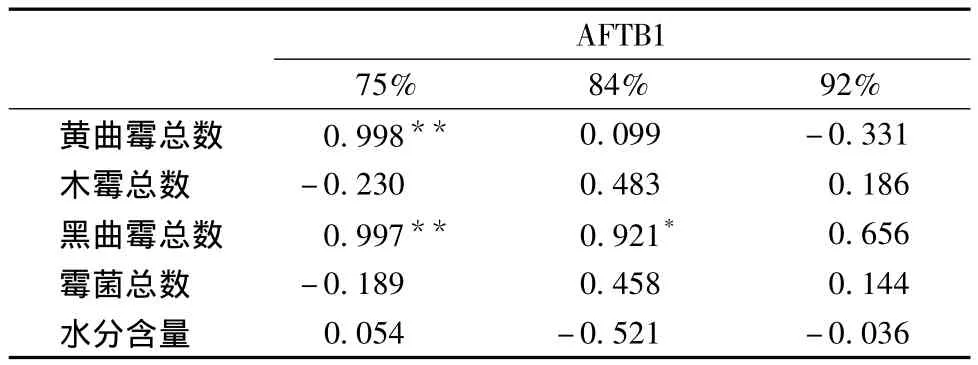
表4 AFTB1与黄曲霉、木霉、黑曲霉、霉菌及水分间相关性Table 4 The correlation among the aspergillusflavus、trichodermaviride、aspergillus Niger、mould、moisture andaflatoxin B1
(2)温度30℃,相对湿度75%、84%、92%的条件下,玉米中最适黄曲霉的产毒的初始含水量分别是15.89%、14.30%、15.89%;整个储藏过程中,木霉和黑曲霉都是优势菌,通过协同抑制黄曲霉的生长并降解了部分黄曲霉毒素B1。
(3)相关性分析表明,在温度30℃,相对湿度75%环境下,玉米上黄曲霉和黑曲霉总数均与黄曲霉毒素B1呈极显著正相关性(P<0.001,k≥0.997),玉米上的木霉总数和霉菌总数与黄曲霉毒素B1量呈负相关;在温度30℃相对湿度84%环境下,玉米上黑曲霉总数与黄曲霉毒素B1呈显著正相关性(P<0.05,k=0.921);在温度30℃,相对湿度92%环境下,玉米上黄曲霉数量和水分含量与AFTB1呈负相关性;在中、高湿度的环境,玉米上的黄曲霉毒素B1与黄曲霉间的相关性越来越不明显,即受其他霉菌的影响越来越显著。
[1] 刘笑然.中国玉米主产近况及近期走势分析[J].饲料广角,2001,17(17):8-13.
[2] 刘峰良,赵志辉,谢晶.谷物中真菌毒素的研究进展[J].广东农业科学,2012,39(19):115-119.
[3] 蔡静平,黄淑霞,张晓云,等.仪器法快速检测储粮霉菌的可靠性研究[J].粮食储藏,2003,32(4):33-36.
[4] GB/T5009.23-2006.食品中黄曲霉毒素 B1、B2、G1、G2的测定[S].
[5] 刘岚.粮油食品中黄曲霉毒素检测方法[J].农产品加工·学刊,2010,9(4):66-67.
[6] Pitt J I,Christian J H.Water relations in xerophilic fungi isolated from prunes[J].Applied Microbiology,1968,16(12):1 853-1 858.
[7] Magan N,Lacey J.The effect of temperature and pH on water relations of field and storage fungi[J].Transactions of the British Mycological Society,1984,82(1):71-81.
[8] Ayerst G.The effects of moisture and temperature on growth and spore germination in some fungi[J].Journal of Stored Products Research,1969,5(6):127-141.
[9] 黄淑霞,蔡静平,田海娟.主要粮食品种储藏期间霉菌活动特性研究[J].中国粮油学报,2010,25(1):99-102.
[10] GB5497-1985.粮食、油料检验水分测定法[S].
[11] GB 4789.15-2010.食品安全国家标准食品微生物学检验霉菌和酵母计数[S].
[12] GB/T 4789.16-2003.食品卫生微生物学检验常见产毒霉菌的鉴定[S].
[13] 齐祖同.中国真菌志第五卷曲霉属及相关有性型[M].上海:科学出版社,1997:76-80.
[14] 谢刚,王松雪,张艳.超高效液相色谱法快速检测粮食中黄曲霉毒素的含量[J].分析化学,2013,41(2):223-228.
[15] 束旭强.粮食储藏期间水分变化的探讨[J].粮油仓储科技通讯,2004,20(5):52-54.
[16] 魏金涛,齐德生.饲料水分活度及其对霉菌生长和产毒的影响[J].饲料工业,2005,26(19):53-55.
[17] Petchkongkaew A,Tailandier P,Gasaluck P,et al.Isolation of Bacillus spp.from Thai fermented soybean(Thuanao):screening foraflatoxin B1 and ochratoxin A detoxification[J].Journal of Applied Microbiology,2008,104(5):1 495-1 502.
[18] 李冰,董征英,常维山.黑曲霉对黄曲霉毒素B1的降解与应用研究[J].饲料博览,2012,25(11):6-10.
[19] 徐丹,秀兰,永仙,等.黑曲霉对黄曲霉生长、产毒及黄曲霉毒素B1的影响[J].中国微生态学杂志,2011,23(6):490-496.
[20] 宋晓妍,孙彩云,陈秀兰,等.木霉生防作用机制的研究进展[J].中国农业科技导报,2006,8(6):20-25.
