3种弱有机酸结合NaCl腌制对牛肉结缔组织滤渣胶原蛋白特性的影响*
2014-12-16常海军周文斌朱建飞唐春红
常海军,周文斌,朱建飞,唐春红
(重庆工商大学环境与生物工程学院,重庆高校催化理论与应用技术市级重点实验室,重庆,400067)
肉的腌制处理,包括酸腌渍处理是肉常见的一种腌制嫩化方法[1]。肉的酸渍腌制过程可通过将肉浸泡在乳酸、醋酸和果汁酸等一些酸液中进行[2]。研究认为,酸腌制对肉的嫩化可能是由于肌原纤维的膨胀对肌肉结构的弱化[3]以及酸渍过程对肌束膜等结缔组织胶原蛋白的直接弱化所致[4]。
胶原蛋白是构成肌内结缔组织的主要结构蛋白,是一种具有一定韧性和剪切性的纤维状蛋白[5]。肌肉的韧性在一定程度上与肌肉内胶原蛋白的含量成正比,肌内结缔组织胶原蛋白被认为是影响肉嫩度的第二种主要蛋白成分[6]。研究发现,在肉制品加工过程中胶原蛋白热力学特性变化对其品质起到一定的影响作用[7]。结缔组织滤渣胶原蛋白是肌肉结缔组织的提取物,其主要成分为肌束膜和肌内膜结缔组织胶原蛋白[8]。研究表明,畜禽肌肉品质在一定程度上受到结缔组织滤渣胶原蛋白特性的影响,包括其含量、溶解性以及热收缩温度等[4-5]。
本研究以牛半腱肌肉为材料,乳酸、醋酸、柠檬酸和NaCl为腌制剂,探讨不同腌制对牛肉结缔组织滤渣胶原蛋白特性的影响。
1 材料与方法
1.1 材料与试剂
牛半腱肌,选择来自同一育肥场、品种和饲养管理相同的土种黄牛的改良后代(西门塔尔×南阳黄牛)公牛5头,屠宰后牛半胴体在4℃冷库中成熟48h后进行取样,从半胴体上取下整条半腱肌,所选胴体其大理石花纹、生理成熟度和背膘厚度等指标基本相似,然后分割成2.5cm厚肉块若干个。
Ⅰ型胶原蛋白标准品(牛跟腱),美国Sigma公司;标准蛋白样品 Marker(次高分子质量:43~200kDa),北京索莱宝科技有限公司(Solarbio);乳酸、醋酸、柠檬酸和NaCl,均为食品级(国产)。其他所用化学试剂均为国产分析纯。
1.2 仪器与设备
MC-DSC差示扫描量热仪,美国TA Instrument公司;AllegraTM64R Centrifuge台式高速冷冻离心机,美国Beckman-Coulter公司;Alpha2-1.2冷冻干燥机,德国Christ;Ultra-Turrax T25 BASIC高速匀浆器,德国Ika-Werke公司;直插式pH计,英国Thermo Scientific公司;ZKSY-600智能恒温水箱,南京科尔仪器设备有限公司;Shimadzu AUY120电子天平,日本岛津公司;GBF-C-321型雪皇冷藏柜,杭州伟龙制冷设备有限公司;DY602S稳流稳压电泳仪,南京大学;Universal HoodⅡ凝胶成像仪,美国BIO-RAD公司;TY-80B脱色摇床,南京大学;78-1型磁力搅拌器,金坛市杰瑞尔电器有限公司。
1.3 实验方法
1.3.1 腌制处理
将牛半腱肌肉(pH值在5.6~5.8)分割成2.5 cm×5.0 cm×5.0 cm大小的肉块[约(100 ±5)g]若干,随即分组并称重,置于下列弱有机酸和NaCl的不同组合腌制剂中,于4℃条件下浸泡腌制24h,其中不经腌制处理的作为对照组。腌制处理组分别为:(1)2%NaCl,(2)1.5%乳酸,(3)1.5%乳酸 +2%NaCl,(4)1.5% 醋酸,(5)1.5% 醋酸 +2%NaCl,(6)1.5%柠檬酸,(7)1.5%柠檬酸 +2%NaCl。每组腌制共6小块肉样,肉样与腌制液之比为1∶5(g∶mL)。腌制完成后,用吸水纸吸干肉块表面水分,称重后进行真空包装,于4℃贮藏待分析。
1.3.2 结缔组织滤渣胶原蛋白提取
腌制处理前后肉样结缔组织滤渣胶原蛋白的提取参照 Li等[8]和 Chang 等[9]方法,并作了部分修改。具体方法如下:取50 g肉样(湿重),切成约为1 cm3的肉丁,加入50 mL预冷的CaCl2(50 mmol/L),用高速匀浆器在3 000 r/min绞碎30 s,经尼龙网(100目)过滤,滤渣用40 mL预冷的50 mmol/L CaCl23 000 r/min绞碎20 s,再过滤,上述过程再重复2次。最终得到的滤渣称为结缔组织滤渣胶原蛋白。最后经真空冷冻干燥后称重,其含量以占样品湿重的百分比计算。
1.3.3 结缔组织滤渣胶原蛋白SDS-PAGE电泳
精确称取0.5 g胶原蛋白样品,加入35 mL 0.5 mol/L的醋酸溶液于4℃振荡溶解48 h。采用不连续SDS-PAGE电泳系统,参照陆应林等[10]和汪家政等[11]文献,部分操作条件进行了改进。分离胶浓度为7.5%,浓缩胶浓度为5%。将结缔组织滤渣胶原蛋白溶液(稀释到浓度约为1 mg/mL)与样品缓冲液(60 mmol/L Tris-HCl,25% 甘油,2%SDS,14.4 mmol/L2-琉基乙醇,0.1%溴酚兰,pH 6.8)以体积比 4∶1混匀,在沸水中水浴3~5 min,离心2~3 min,取出冷却,上样量为30 μL,次高分子质量蛋白质Marker上样量为5 μL。在电压为80 V下恒压电泳3h。电泳结束之后,用考马斯亮蓝R-250染色液(0.1%考马斯亮蓝R-250,5%甲醇,45%乙酸)染色1 h,在摇床上用考马斯亮蓝脱色液(10%甲醇,10%乙酸)脱色直至背景清晰。用生物电泳图像分析系统照相,分析。
1.3.4 结缔组织滤渣胶原蛋白DSC分析
经分离提取后的结缔组织滤渣胶原蛋白用差示扫描量热仪(DSC)分析其热量变化(用量5.0 mg),温度扫描为20~100℃,升温速率2℃/min,用TA instrument自带分析软件(universal analysis 2000)对热流变化曲线进行分析,计算样品热变性温度。
1.4 数据分析处理
运用SPSS16.0一般线性模型(GLM)对实验所得数据进行单因素方差(ANOVA)分析、LSD多重比较以及相关性分析。各实验指标值测定重复3次,结果以平均值±标准差表示。
2 结果与分析
2.1 牛肉腌制处理过程中结缔组织滤渣胶原蛋白含量的变化
由图1可见,除乳酸腌制之外,其他腌制处理组牛肉结缔组织滤渣胶原蛋白含量与对照组相比均升高,且乳酸腌制组与对照组之间无显著差异(P>0.05)。另外,各弱有机酸与NaCl结合腌制处理组牛肉结缔组织滤渣胶原蛋白含量较有机酸单独腌制处理极显著增高(P<0.01)。结缔组织滤渣主要成分为肌束膜和肌内膜,以及含有部分的肌纤维成分,牛肉中肌束膜成分占胶原蛋白总量的90%以上[12],是构成结缔组织的主要成分,也是决定肉“背景嫩度”的关键成分[6],本研究结果显示,不同腌制剂的结合处理在一定程度上增加了结缔组织滤渣胶原蛋白含量,其原因可能与不同腌液的pH值以及离子强度引起的肌束膜和肌内膜胶原蛋白发生变性以及凝胶化转化程度有关,另外,酸与NaCl结合处理时,腌制液pH值较酸单独处理时更低,腌制液整个系统具有较低的pH值和较高的离子强度,可能对溶解结缔组织胶原蛋白以及基质多糖起作用的β-半乳糖苷酶和β-葡糖醛酸酶的释放和活性受到抑制,因而可提取的结缔组织滤渣胶原蛋白含量有所增加。

图1 三种弱有机酸和NaCl结合腌制过程中牛肉结缔组织滤渣胶原蛋白含量的变化Fig.1 Changes in contents of connective tissue filtering residue collagen from beef muscle following marination treatment
2.2 腌制处理过程中牛肉结缔组织滤渣胶原蛋白SDS-PAGE电泳
3种弱有机酸和NaCl结合腌制过程中牛肉结缔组织滤渣胶原蛋白SDS-PAGE电泳如图2所示。
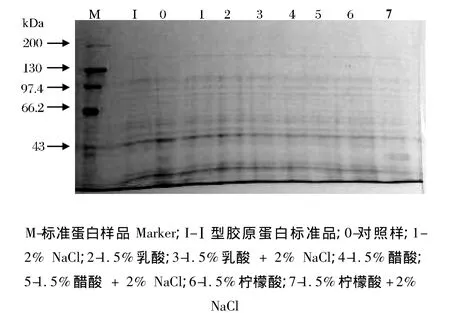
图2 腌制后牛肉结缔组织滤渣胶原蛋白SDS-PAGE电泳图谱Fig.2 SDS-PAGE of connective tissue filtering residue collagen from beef muscle following marination treatment
由图2可知,结合Ⅰ型胶原蛋白标准品和对照组(未经腌制处理组),牛肉经不同腌制处理对结缔组织滤渣胶原蛋白不同分子量蛋白浓度的影响不显著,尤其对40 kDa附近的低分子质量蛋白无显著降解作用。而前期研究发现,弱有机酸与NaCl结合腌制对牛肉全肌肉蛋白的降解变化较为显著[13],由此可见,这种变化主要源于肌纤维蛋白成分的变化所致。
2.3 腌制处理过程中牛肉结缔组织滤渣胶原蛋白热力特性的变化
弱有机酸结合NaCl不同腌制剂处理过程中牛肉结缔组织滤渣胶原蛋白热力特性的变化见图3。
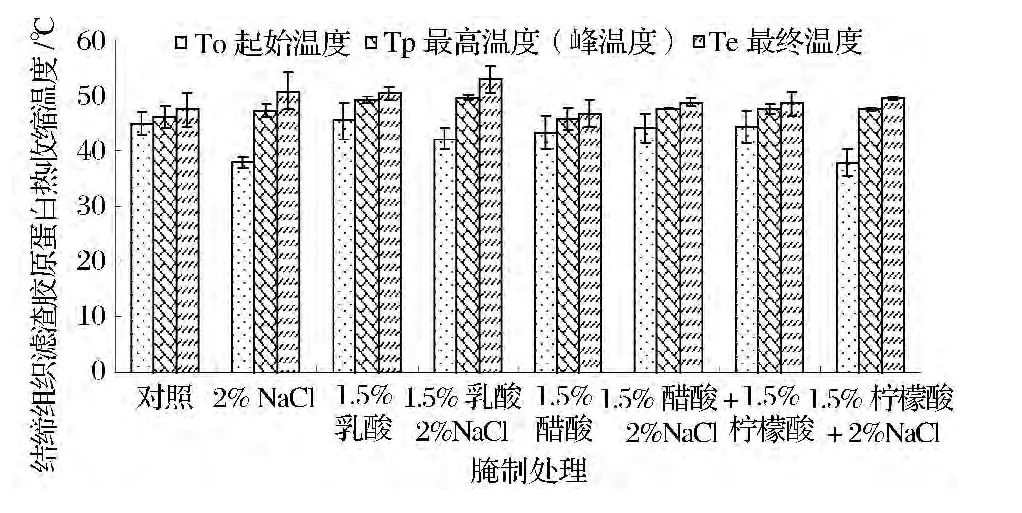
图3 经腌制处理后牛肉结缔组织滤渣胶原蛋白热力特性的变化Fig.3 Changes in thermal shrinkage temperatures of connective tissue filtering residue collagen of beef muscle following marination treatment
由图3可见,经腌制处理后牛肉结缔组织滤渣胶原蛋白Te温度较对照组相比变化不大,To和Tp温度有较大变化。各弱有机酸与NaCl结合腌制处理组牛肉结缔组织滤渣胶原蛋白变性峰温度(Tp温度)较有机酸单独腌制处理增高,可见,弱有机酸与NaCl结合腌制处理增强了牛肉结缔组织滤渣胶原蛋白的热稳定性。
To为结缔组织胶原蛋白热变性起始温度,反映胶原蛋白的最低热稳定性,Tp为最大热变性温度,反映胶原蛋白的一般热稳定性,通常用最大热变性温度来反映胶原蛋白的热稳定特性[4,14]。Bailey 等[15]报道哺乳动物胶原蛋白的最大热变性温度为65℃左右,但对不同的动物属种和肌肉类型有也差别。
本研究中,牛肉结缔组织滤渣胶原蛋白虽经纯化分离,但由于腌制处理过程中,由于不同腌制液pH值以及离子强度的影响,部分处理组肌原纤维和胶原纤维发生变性,导致分离纯化过程中可能还含有极少量的肌原纤维成分,另外,肌束膜和肌内膜耐受腌制处理影响程度表现不一致,即受破坏程度不同,二者共同决定了肌肉结缔组织滤渣胶原蛋白的热力特性。
2.4 相关性分析
在牛肉腌制处理过程中,对牛肉结缔组织滤渣胶原蛋白含量以及热力特性之间的相关性分析见表1。

表1 经腌制处理后牛肉结缔组织滤渣胶原蛋白特性变化相关性分析Table 1 Correlation analysis among the characteristic changes of beef connective tissue filtering residue collagen following marination treatment(n=24)
由表1相关性分析可知,牛肉结缔组织滤渣胶原蛋白含量与其热稳定性之间相关性不显著,而结缔组织滤渣胶原蛋白最大变性温度(Tp峰温度)与最终变性温度(Te温度)之间呈极显著相关,相关系数为0.844。
3 结论
牛肉经3种弱有机酸(乳酸、醋酸和柠檬酸)以及和NaCl的结合腌制处理使得结缔组织滤渣胶原蛋白含量和热力特性发生了一定程度的变化。与对照组相比,NaCl以及3种不同腌制剂的结合处理在一定程度上增加了结缔组织滤渣胶原蛋白含量。牛肉经不同腌制处理对结缔组织滤渣胶原蛋白不同分子质量蛋白浓度的影响不显著。3种弱有机酸与NaCl结合腌制处理增加了牛肉结缔组织滤渣胶原蛋白热变性峰温度,表明其热稳定性更加趋于稳定。
[1] Burke R M,Monahan F J.The tenderization of shin beef using a citrus juice marinade[J].Meat Science,2003,63(1):161-168.
[2] Toohey E S,Kerr M J,Vandeven R,et al.The effect of kiwi fruit based solution on meat traits in beef m.semimembranosus(topside)[J].Meat Science,2011,88(3):468-471.
[3] Serdaroglu M,Abdraimov K,Onenc A.The effects of marination with citric acid solution and grapefruit juice on cooking and eating quality of Turkey breast[J].Journal of Muscle Foods,2007,18(3):162-172.
[4] CHANG H J,WANG Q,ZHOU G H,et al.Influence of weak organic acids and sodium chloride marination on characteristics of connective tissue collagen and textural properties of beef semitendinosus muscle[J].Journal of Texture Studies,2010,41(3):279-301.
[5] Aktas N.The effects of pH,NaCl and CaCl2on thermal denaturation characteristics of intramuscular connective tissue[J].Thermochimica Acta,2003,407:105-112.
[6] 周光宏主编.肉品加工学[M].北京:中国农业出版社,2008,28.
[7] King N L.Thermal transition of collagen in ovine connective tissues[J].Meat Science,1987,20:25-37.
[8] LI C B,ZHOU G H,XU X L.Changes of meat quality characteristics and intramuscular connective tissue of beef semitendinosus muscle during postmortem aging for Chinese Yellow bulls[J].International Journal of Food Science and Technology,2008,43(5):838-845.
[9] CHANG H J,XU X L,ZHOU G H,et al.Effects of characteristics changes of collagen on meat physicochemical properties of beef semitendinosus muscle during ultrasonic processing[J].Food and Bioprocess Technology,2012,5(1):285-297.
[10] 陆应林,周光宏,徐幸莲,等.南京板鸭加工过程中肌肉蛋白降解的研究[J].食品科学,2006,27(7):44-47.
[11] 汪家政,范明.蛋白质技术手册[M].北京:科学出版社,2001:77-110.
[12] 常海军,王强,徐幸莲,等.肌内胶原蛋白与肉品质关系研究进展[J].食品科学,2011,32(1):286-290.
[13] 常海军,朱建飞,周文斌.3种弱有机酸结合NaCI腌制对牛肉肌内胶原蛋白的影响[J].食品与发酵工业,2012,38(8):211-214.
[14] Aktaᶊ N,Kaya M.Influence of weak organic acids and salts on the denaturation characteristics of intramuscular connective tissue. A differential scanning calorimetry study[J].Meat Science,2001,58(4):413-419.
[15] Bailey A J,Light N D.Elsevier Applied Science[M].London:1989:114.
