茶树菇软罐头加速贮藏过程中的品质变化规律*
2014-12-16邵平彭继腾马新孙培龙
邵平,彭继腾,马新,孙培龙
(浙江工业大学食品科学与工程系,浙江 杭州,310014)
茶树菇又名杨树菇,柱状田头菇等,属担子菌亚门,富含真菌多糖,是一种高蛋白低脂,矿物质含量相对较高的营养食用菌[1]。由于包装材料的阻氧性,茶树菇罐头产品通常的保质期在常温下可达9~12个月[2-3],在贮藏过程中,产品内部液体的氧化降解直接影响了产品的品质,包括风味、颜色、气味、质地以及营养价值。传统的贮藏实验周期至少为3个月,为了减少分析的周期,首先需对其进行加速贮藏。加速贮藏技术作为一个非常有效的工具应用于产品开发,很大程度上用来研究食品的特性,也用于研究果蔬罐头产品的新鲜度指数[4-6]。
本研究在37℃恒温贮藏条件下,采用顶空固相微萃取及色差、硬度测定的方法,综合评价茶树菇加速贮藏过程中挥发性物质、硬度、色泽的变化程度,比较了不同时间段茶树菇品质的影响,为茶树菇罐头产品质量控制提供技术支持,也为进一步研究茶树菇软罐头挥发性风味成分形成机理及改进加工工艺做基础工作。
1 材料与方法
1.1 材料
茶树菇,由浙江某食品有限公司提供;柠檬酸;抗坏血酸;L-半胱氨酸;醋酸锌;NaCl;CaCl2,均为食品级。
1.2 试验仪器
质地分析仪(XA-XTplus),英国Stable Micro Systems公司;色差仪(HunterLab ColorQ),美国Hunter-Lab公司;手动 SPME 进样器,75 μm CAR/PDMS萃取头,美国Supelco公司;6890N/5975气相色谱-质谱联用仪,美国Agilent公司。
1.3 茶树菇软罐头的制作
挑选无杂质的茶树菇干,剪除菇柄过老部分,修剪成2~3 cm均匀长度的菇体,整理放入清水中浸泡30 min,再浸入护色剂(0.15%柠檬酸+0.015%抗坏血酸+0.015%L-半胱氨酸+50 min+0.03%醋酸锌)和保脆剂(0.25%CaCl2)中浸泡30 min,稳定后清水冲洗10 min,随后将茶树菇放入真空抽水装置中抽出部分水分。将真空抽水后的茶树菇装入PE包装袋中,装袋时擦干袋口处的水分,保持平整,以防止皱褶而漏气。用真空包装机进行真空包装,抽真空时间20~30 s,加热时间 2~5 s,真空度 0.08~0.15 MPa。将真空包装好的茶树菇放入高温高压杀菌锅中,迅速升温到121℃,保温30 min,然后进行反压冷却,迅速降温至40℃以下;最后将茶树菇包装袋外的水分擦干,贴上标签,贮藏于37℃恒温恒湿箱中,即为茶树菇软罐头样品。
1.4 茶树菇罐头样品采集
茶树菇罐头生产1批次,约100包,每包5 g,置于37℃恒温培养箱,于0、14、28 d的9∶00准时取出3包随机样品,测定挥发性物质;于 0、7、14、21、28 d 的9∶00准时取出5包随机样品,测定色差和硬度。
1.5 化学分析挥发性成分
1.5.1 顶部空间抽样
取待测的茶树菇罐头样品混合剪碎,称取3 g放置于20 mL萃取瓶中密封,静置20 min,环境温度为(55±3)℃。用75 μm SPME纤维头通过聚四氟乙烯瓶垫插入到萃取瓶中,置于茶树菇样品正上方0.5 cm,顶空萃取40 min,然后将纤维头插入GC进样口,解吸10 min。每次收集设置3次重复,吸附空萃取瓶中的气体作为空白对照。利用6890N/5975气相色谱-质谱联用仪进行挥发性有机物成分测定分析。
1.5.2 色谱条件
HP-5MS弹性石英毛细管柱色谱柱,长30 m,内径0.25 mm,液膜厚0.25 μm,载气为高纯氦气,不分流进样,恒流流速1.0 mL/min,进样口温度230℃,接口温度280℃,柱温初始温度60℃,保持1 min,以5℃/min升至200℃,保持5 min,然后以20℃/min升至250℃。质谱条件:电子轰击(EI)离子源,电子能量70 eV,离子源温度为230℃,四级杆温度为150℃,质量扫描范围m/z 45~400。
1.5.3 数据分析
通过GC-MS的NIST、Willey谱图库对茶树菇软罐头挥发性成分进行解析,利用谱图库工作站数据处理系统按峰面积归一化法进行定量分析,求得各化学成分在挥发性风味物质中的相对含量。
1.6 品质指标分析
1.6.1 色差分析
采用 ColorQuest XE色差仪的 L*、a*、b*模式[7]。平行测定6 次。
1.6.2 硬度分析
茶树菇菌柄统一切成2 cm的试样,置于质构仪P/6探头下做TPA测试。质构仪参数如下:测前速率,2 mm/s;测试速率,1 mm/s;测后速率,5 mm/s;应变,75%;停留间隔,5 s;数据采集速率,400 pps;触发值,5 g。每包样品测试重复10次。
2 结果
2.1 茶树菇不同贮藏阶段的挥发性有机成分
从茶树菇罐头挥发性有机物中共鉴定出79种化合物(表1)。其中醛类化合物17种、酮类化合物16种、醇类化合物11种、烷类化合物6种、酸类和烯烃类化合物各5种,以及少量酯类、硫类和其他化合物,主要成分为异戊醛、苯甲醛、4-羟基5-甲基三丙基-2-己酮等。茶树菇罐头挥发性成分在不同贮藏阶段的变化情况:3-甲基-2-丁烯醛、壬醛、2-庚酮、1-辛烯-3-醇、环丁烷、2-戊基呋喃、正己酸等芳香物质的总体变化趋势是先上升后下降,正戊醛、正己醛、仲辛酮、香叶基丙酮、邻苯二甲酸二乙酯、2-丁基呋喃、乙酸、二甲基二硫等物质的变化趋势是持续上升,而异戊醛、呋喃甲醛、苯乙醛、3-甲基-3-环己烯酮的变化趋势是持续下降。其中,有些挥发性的芳香成分仅在某一个阶段出现,如乙醛、异丁醛、甲基庚烯酮、2-甲基戊醛、2-庚醇、2-乙酰基呋喃、二甲基三硫、2-氨基,5-溴吡啶等挥发性有机物仅在第0天检测到,异戊酸异戊酯、1-甲基(1-甲基乙烯基)环己烯、壬烷、2-甲基-3-炔-壬烯只在第14天被检测到,可卡醛、2-戊酮、苯乙酮、L-薄荷醇、2,6-二叔丁基对甲酚仅出现在贮藏28 d。

表1 加速贮藏阶段茶树菇软罐头的挥发性成分的组成及相对含量Table 1 Relative percentage of volatile compounds in agrocybecylindracea soft can during accelerated storage

续表1

续表1
2.2 挥发性有机成分的含量变化
17种醛类化合物(见表1)分别包括7种来自类脂物氧化的产物:乙醛、正戊醛、正己醛、正庚醛、正辛醛和反-2-壬烯醛;5种经氨基酸Strecker降解生成的产物:异丁醛、2-甲基丁醛、2-甲基戊醛、异戊醛、3-甲硫基丙醛、苯乙醛;以及Maillard反应的产物[8-11]糠醛。随着贮藏时间的增加,贮藏的后期产生了(Z)-2-庚烯醛和可卡醛2种新的物质,此类化合物因其风味阈值较低,可能是亚油酸过氧化氢的一种降解产物。以0 d茶树菇的挥发成分作为对照,14、28 d的茶树菇其挥发成分的种类逐渐发生变化,从图1中可以看出,醛类在0 d时含量最高,随着贮藏时间的延长,则逐渐减少。检测结果表明,采用本方法所检测的样品中,各醛类化合物的含量都随贮存时间的延长而有不同程度的降低。含量降低程度最大的是5-甲基呋喃醛,相对含量从1.42%降至0.34%,降低了76.05%。其次是糠醛、异戊醛,分别降低至60.71%和42.18%。在贮藏的后期,乙醛、2-甲基戊醛、异丁醛都未检测到。
酮类可能是由于不饱和脂肪酸的热降解、脂肪氧化、氨基酸降解和美拉德反应而产生的,呈桉叶味、脂肪味和焦燃味,通常随着C链的增长而呈现出更强的风味特征[12],如 2-戊酮、2-己酮、5-甲基-2-庚酮对草菇的风味都有贡献。酮类在第0、14、28天检测时发现,随着时间的延长是逐渐增加的,在贮藏14 d后,其含量则达到最高,而后随着茶树菇新鲜度的降低,逐渐减少。在第28天形成的新产物2-戊酮的含量为1.06%。在加速氧化的过程中,这些酮类成分对腐败味物质起增强作用。
含硫化合物通常能影响菇体整体的气味,是菇类中重要的香味来源,在茶树菇罐头中鉴定出2种,分别是二甲基二硫醚(DMDS)、二甲基三硫醚(DMTS)。DMDS和DMTS的香味阈值分别为12和3 ng/kg[13],均具有鲜洋葱的气味,而高浓度的含硫化合物,会给食品带来不愉快的嗅感。在贮藏过程中有所增加,以DMDS为例,总含量增加了2.3倍。
胺类化合物是蛋白质的分解物。茶树菇在贮藏第28天产生了n-戊基-癸酰胺等物质,胺类物质与茶树菇的腐败味有关;贮藏的中期和后期分别检测到了2种吡啶,分别为吡啶和2-氨基,5-溴吡啶。这可能是在酸的催化作用下,醛可以通过缩合作用发生反应,生成的杂环化合物。
腐败味的关键物质二甲基硫、苯酚、3-甲基-2-丁烯醛、n-戊基-癸酰胺[14-15]的相对含量升高,感官比较0、14、28 d的气味,发现差异明显,0 d的味道很淡,14 d有微弱的腐败味道,28d腐败的味道明显。
2.3 茶树菇软罐头色泽和硬度分析
在加速贮藏过程中茶树菇菇肉色泽的变化主要包括变黄和变暗。杀菌后茶树菇菇体呈亮黄色的原因在于茶树菇细胞间的气体受热排出,改变了其表面的反射特性[16-17]。随着时间的延长,亮度值(L*)由最初的47.37±1.62a降低至第28d的40.35±1.60c;黄色度增加相对较明显,从开始的6.04±1.72c升至15.41±0.76b;在贮藏后期,茶树菇色泽呈暗黄色,甚至暗褐色。变色的严重程度与贮藏的时间相关,贮藏时间越久,褐变越严重。
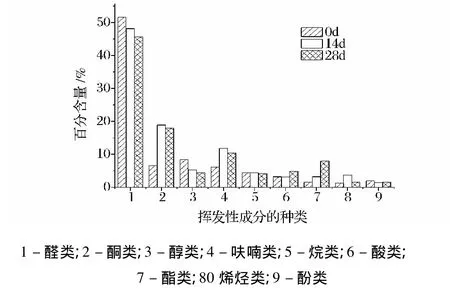
图1 不同时间段茶树菇软罐头挥发性有机成分种类的变化Fig.1 Changes of different kinds of components of VOCs at different periods of ofagrocybe cylindracea soft can
在加速贮藏过程中茶树菇的硬度呈先上升后下降的变化趋势。0~7 d期间,茶树菇菇肉硬度在第7天时为1 865.120±16.441b,与第0天(1664.83±29.37a,b)相比呈上升趋势,可能与贮藏初期菇体组织与护脆剂的结合有关;之后,茶树菇菇肉的硬度随着贮藏时间的延长(第28天为996.38±10.523c)呈下降趋势,这可能与菇肉组织随贮藏时间的延长发生降解有关。如表2所示,第0天的硬度是第28天的1.67倍,长时间高温下,细胞壁的分解和处于胞间薄层的果胶物质变化而引起细胞破裂,使茶树菇对外界的应力下降[18]。而根据果蔬质构变化的底物理论,果蔬质构的变化是由于一类物质发生分解所致[19]。
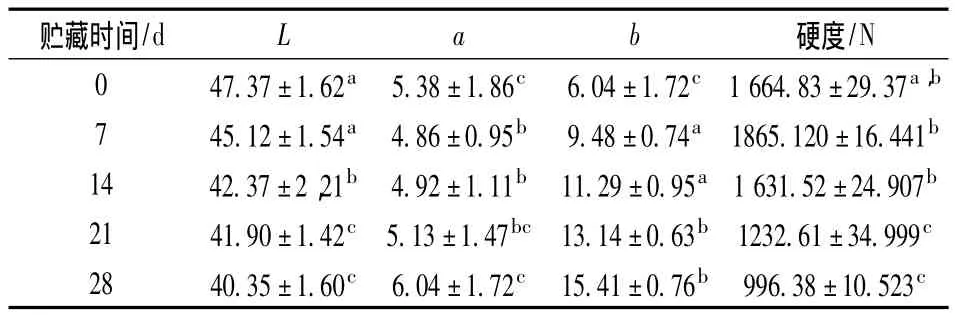
表2 茶树菇罐头贮藏过程中的色泽、硬度的变化Table 2 Color and hardness changes of agrocybe cylindracea soft can during accelerated storage
3 结论
利用顶空固相微萃取法,经GC-MS分析茶树菇软罐头贮藏过程共鉴定出79种化合物,醛类化合物均为主要挥发性成分,其相对含量由第0天的51.63%降至第28天的45.65%;酮类作为第二大类挥发性物质由6.54%升至17.96%;腐败味物质二甲基硫、苯酚、3-甲基-2-丁烯醛在28 d时检出。茶树菇在加速贮藏阶段释放挥发性有机成分及其相对含量不同。醛类化合物含量虽然有所下降,仍是最主要的挥发性有机成分;由于不饱和脂肪酸的热降解、脂肪氧化、氨基酸降解和美拉德反应等可能性而产生的酮类含量呈上升趋势;脂肪氧化产生的醇和游离脂肪酸相互作用导致酯类物质的升高;由腐败产生的胺类物质和含硫化合物在贮藏后期被测出。各种挥发性有机物由于产生和释放的机理不同,呈现多样性的释放规律,其原因也有待进一步研究。贮藏时间对茶树菇的品质影响显著,由于菇肉组织随贮藏时间的延长发生降解,茶树菇菇肉的硬度呈先上升后下降的趋势,茶树菇的色泽有变褐色的趋势。总之,加速贮藏后茶树菇罐头的氧化变质及起协同作用的物质都有所升高,为罐头产品的保质期测定提供一定的参考。
[1] Tsai,Shu Yao,Tsai,et al.Antioxidant properties of Agaricus blazei,Agrocybe cylindracea,and Boletus edulis[J].Lwt-Food Science and Technology,2007,40(8):1 392-1 402.
[2] 林启训,毛延妮,杜曦妍,等.茶树菇的采后护色及热空气干燥方式研究[J].中国食品学报,2009,9(5)141-145.
[3] 姜天甲.主要食用菌采后品质劣变机理及调控技术研究[D].杭州:浙江大学,2010.
[4] Onitilo M O,Sanni L O,Oyewole O B,et al.Physicochemical and functional properties of sour starches from different cassava varieties[J].International Journal of Food Properties,2007,10(3),607-620.
[5] Yim,Hip Seng,Chye,et al.Antioxidant potential of pleurotus porrigens extract and application in sunflower oil during accelerated storage[J].Chiang and Mai Journal of Science,2013,40(12):34-48.
[6] Yim,Hip Seng,Chye,et al.Antioxidant potential of pleurotus porrigens extract and application in sunflower oil during accelerated storage[J].Chiang and Mai Journal of Science,2013,40(12):34-48.
[7] Esaiassen M,Dahl R,EilertsenG,et al.Pre-rigor filleting and brining of farmed cod:Influence on quality and storage stability[J].LWT-Food Science and Technology,2008,41(4):724-729.
[8] Cheng K W,Chen F,Wang M.Heterocyclic amines:chemistry and health[J].Molecular nutrition& Food Research,2006,50(12):1 150-1 170.
[9] Martins S,Jongen W M F,van Boekel M.A review of Maillard reaction in food and implications to kinetic modelling[J].Trends in Food Science & Technology,2000,11(9/10):364-373.
[10] Park,Hye Jung,Lee,Sang,et al.Characterization of volatile components in makgeolli,a traditional korean rice wine,with or without pasteurization,during storage[J].Molecules,2013,18(5):5 317-5 325.
[11] Riha W E,Ho C T.Flavor generation during extrusion cooking[J].Process-Induced Chemical Changes in Food,1998,434:297-306.
[12] 王丽莉,刘黄刚.酮类化合物的研究进展[J].中草药,2010,41(7):7.
[13] 宋江峰,李大婧,刘春泉.贮藏过程中京甜紫花糯2号玉米软罐头的主要挥发性风味成分的变化[J].核农学报,2011,25(5):980-987.
[14] Diego L,Garcia G,Noelia T,et al.Relationship between sensory attributes and volatile compounds qualifying drycuredhams[J].Meat Science,2008,80(2):315-325.
[15] 蒋冬月,沈鑫,李永红,等.黄兰(Michelia champaca L.)花开放和衰败过程中生理生化指标的变化[J].中国农学通报,2012,45(6):1 215-1 225.
[16] Woofle M L.Pigments[M].London:Applied Science Publisher,1979:77-119.
[17] 余恺,陈文文,胡卓炎,等.荔枝罐头微波杀菌的温度及其贮藏期质构和颜色的变化[J].中国食品学报,2008,8(3):94-100.
[18] Zhao Fangfang, Liu Jingkun, Wang Xiupin, et al.Detection of adulteration of sesame and peanut oils via volatiles by GC x GC-TOF/MS coupled with principal components analysis and cluster analysis[J].European Journal of Lipid Science and Technology,2013,115(3):337-347.
[19] Ghoreishi S M,Shahrestani R G.Innovative strategies for engineering mannitol production[J].Trends in Food Science & Technology,2009,20(6/7):263-270.
