椰子种皮油提取物对氧化损伤的保护作用*
2014-12-16张玉锋段岢君赵晓莉陈卫军赵松林
张玉锋,段岢君,赵晓莉,陈卫军,赵松林
1(中国热带农业科学院椰子研究所,海南文昌,571339)
2(海南大学食品学院,海南海口,570228)
3(国家重要热带作物工程技术研究中心,海南海口,571101)
椰子(Cocosnucifera L.)为棕榈科椰子属多年生常绿乔木,是热带地区的一种重要水果和油料作物,除了用于生产食品外,还可作为椰壳活性炭、椰衣纤维、汽车坐垫等工业产品的原料,应用范围广泛,被称为“生命之树”[1]。据报道,干燥后的成熟椰肉中脂肪含量高达70%,以其为原料生产的椰子油富含中短链饱和脂肪酸,具有杀菌、抗病毒、抗癌和减少心血管疾病发生危险等多种功效[2]。因此,椰子油等相关产品的消费量日益增加,这也意味着椰子种皮等副产物的大量产生,对这些副产物的加工利用已成为椰子加工业的重要课题,其高值化利用具有明显的经济和社会效益。
椰子种皮是成熟椰肉上附着的一层黑褐色薄皮,每个椰果可得种皮约100 g。在椰肉榨油时,如果附有种皮,会对所得油脂的色泽和性质产生负面影响,不利于市场销售,所以在榨油前将种皮削除。据统计,海南省每年可产椰子种皮2.37万t,而这些种皮多被直接丢弃,或作为培养基质和动物饲料使用,附加值和利用率均较低[3]。因此,本文以椰子种皮为原料,提取种皮油,制备提取物,并探讨该提取物对氧化损伤的保护作用。
1 材料与方法
1.1 椰子种皮油(coconutendocarp oil,CEO)的制备[4]
成熟的椰子,从中间剖开,取出椰肉,将附着于椰肉上的一层棕色椰子种皮削下收集,50℃烘干,粉碎,得种皮粉末。取粉末50 g,加入200 mL异丙醇,60℃超声波辅助提取3h,真空抽滤,收集滤液;再向滤渣中加入200 mL异丙醇,重复提取3次,合并滤液,45℃旋蒸,除去溶剂,得椰子种皮油。4℃保存备用。
1.2 椰子种皮油提取物(coconut endocarp oil extract,CEOE)的制备
参考Seneviratne等[5]的方法,取椰子种皮油50 g,按照5∶1(mL∶g)的料液比,加入10 mL 体积分数80%的甲醇,超声波辅助提取10 min,然后于2 000 r/min离心30 min,收集上层清液,再加入10 mL体积分数80%的甲醇,如此反复提取3次,合并上清液,于40℃旋转蒸发除去甲醇,而后冷冻干燥除去水分,得到椰子种皮油提取物。将提取物贮存于4℃冰箱中,用时取出用80%的甲醇溶解,并配制成一定浓度的溶液。
1.3 CEOE对人血清蛋白氧化损伤的保护作用
1.3.1 人血清蛋白(human serum albumin,HSA)的氧化处理[6]
10 mg/mL的人血清蛋白中分别加入等量的提取物甲醇溶液,Trolox,超纯水,混匀,然后分别加入10 mmol的 H2O2,在37℃水浴中反应 2 h。样品与Trolox 的浓度梯度均为 0.5、1.0、1.5、2.0 和 2.5 mg/mL。
1.3.2 对蛋白质羰基形成的抑制作用
参考Levine等人[7]的方法,并稍作修改:分别取上述混合液400 μL,加入400 μL浓度为 10 mmol/L的 2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH),空白以2 mol/L HCl代替,混匀,室温下于暗处反应1 h,每隔10 min漩涡1次。然后加入400 μL TCA(20%)蛋白质腙衍生物。于4℃、16 000 r/min、离心5 min,弃去上清液。沉淀用1 mL乙醇/乙酸乙酯(体积比为1∶1)洗涤3次,每次洗完于16 000 r/min、4℃离心5 min,弃去上清液。最后沉淀用1.25 mL浓度为6 mol/L的盐酸胍溶解,离心取上清液于370 nm测吸光值。每个样品做3个平行。
蛋白质羰基氧化抑制率/%=(1-A样品/A空白)×100
1.3.3 蛋白质氢过氧化物含量的测定
本实验采用二甲酚橙法[8]测定氢过氧化物含量。取0.1 mL氧化后的蛋白质溶液,分别加入1 mL硫酸亚铁铵(0.5 mmol),1 mL 二甲酚橙(0.2 mmol),室温下反应30 min,于560 nm处测试吸光值。
1.4 过氧化氢清除能力的测定[9]
1 mL的提取物/Trolox中依次加入1.0 mL的10 mmol/L H2O2,1.0 mL 硫酸亚铁铵,0.3 mL 二甲酚橙,及1 mL 25 mmol/L的H2SO4,用PBS补充体积至5 mL,充分混匀,暗处反应30 min,于560 nm处测试吸光值。对照组以水代替样品,样品对照组不添加H2O2,每个样品做3个平行。
过氧化氢清除率/%=[1-(A样品-A对照)/A对照]×100
1.5 CECO对羟基自由基诱导的DNA氧化损伤的保护作用
羟基自由基诱导DNA损伤,DNA结构由超螺旋结构断裂成环状或者线性结构。参照Wei等[10]的方法,略加改动:准确称取琼脂糖0.25 g,放入锥形瓶中,加入25 mL的1×TAE缓冲液,加热使琼脂糖完全溶解,待冷却至60℃,加入2 μL EB(溴化乙锭)染色液,混匀,倒入胶板铺板。室温下(约30 min后)待凝胶完全凝固,拔出梳齿,将胶板放入盛有1×TAE缓冲液的电泳槽中。终体积为25 μL的反应液中,分别含有 50 ng/μL 的 pBR 322 DNA 2 μL,5 mmol/L的 FeSO45 μL,3%的 H2O22 μL,100 mmol/L pH 7.4的PBS,浓度为0.1 mg/mL的提取物甲醇溶液1、2、3、4和5 μL,以同浓度同体积的Trolox作对照,以超纯水代替样品做空白。37℃水浴反应1h,加入5 μL上样缓冲液,点入1%的琼脂糖凝胶中,90V电泳30 min,凝胶成像系统拍照。
1.6 数据处理
所有数据均用平均值±SD表示;使用Origin 8.0和Excel制作图表,并用SPSS 17.0进行方差分析和显著性检验(P<0.05)。
2 结果与讨论
2.1 椰子种皮油提取物对人血清蛋白氧化的保护作用
2.1.1 提取物对蛋白质羰基氧化的抑制作用
机体内的蛋白质氧化会影响多种细胞功能,涉及受体、信号传导机制、运输系统和各种酶类,并可导致其他生物分子的二次损伤,如DNA修复酶失活等。有报道称羰基生成是由活性氧攻击氨基酸分子中自由氨基或亚氨基,经反应最终生成NH3和相应的羰基衍生物[11],可见蛋白质羰基的产生是蛋白质分子被自由基氧化修饰的一个重要标记,因此可通过测定羰基的含量来判断蛋白质被氧化损伤的情况。
图1显示的是不同浓度的提取物对蛋白质羰基氧化的抑制效果。可以看出,虽然CEOE的抑制效果均低于同浓度的Trolox,但是该提取物也表现出了抑制蛋白质羰基生成的潜能,且随着CEOE浓度的增加,其抑制作用呈现逐渐增强的趋势,即具有明显的剂量效应。此外,浓度为 1.5、2.0 和 2.5 mg/mL 的CEOE 的抑制效果分别与 0.5、1.0 和 2.0 mg/mL 的Trolox的作用相当。这就说明在一定程度上,椰子种皮油提取物可以作为一种抗氧化添加组分来降低由H2O2诱导的蛋白质羰基增多的氧化损伤。

图1 CEOE/Trolox对蛋白质羰基氧化的抑制作用Fig.1 Inhibiting effect of CEOE/Trolox on the oxidation of protein carbonyl
2.1.2 提取物对蛋白质氢过氧化物含量的影响
Gieseg等人[12]的研究表明,人工培养的U973细胞在暴露于H2O2的情况下会诱发蛋白质氢过氧化物的生成,并且该过氧化物会作为新的自由基源与细胞内的抗氧化剂发生反应,从而导致谷胱甘肽还原酶失活和DNA交联等机体损伤。因此抑制蛋白质氢过氧化物的形成也是抗氧化剂发挥其抗氧化作用的一种途径。如图2所示,与空白组(浓度为0 mg/mL组)相比,添加了CEOE与Trolox实验组的吸光值明显降低,即CEOE与Trolox均可以有效降低蛋白质氢过氧化物的含量;并且随着浓度的增加,吸光值越来越小,表明高浓度的CEOE及Trolox更能抑制蛋白质氢过氧化物的生成,从而降低氧化损伤。
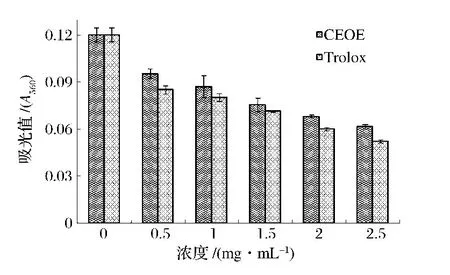
图2 CEOE/Trolox对蛋白质氢过氧化物含量的影响Fig.2 Impaction effect of CEOE/Trolox on protein hydroperoxides
2.2 提取物对过氧化氢的清除能力
图3显示的是CEOE和Trolox对过氧化氢的清除能力。
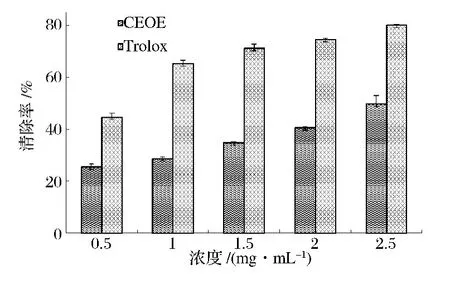
图3 CEOE/Trolox对过氧化氢的清除能力Fig.3 Scavenging activity of CEOE/Trolox on hydrogen peroxide
可以看出,随着浓度的增加CEOE对H2O2的清除能力逐渐增强,在浓度为2.5 mg/mL时,清除率达(49.81±3.10)%,且其清除能力与自身浓度呈现正相关(R2=0.974)。有研究表明,机体内的过氧化物和氢过氧化物一般是机体细胞组分与自由基或活性氧发生相互作用时的最初产物,当机体细胞处在过氧化氢中时,糖酵解反应中的ADP磷酸化过程会被抑制,从而造成机体供能不足[13]。因此,可将CEOE开发成一种抗氧化组分添加到食品中去,以清除机体内的过氧化氢,保证机体供能。
2.3 椰子种皮油提取物对DNA损伤的保护作用
在Fe2+的催化作用下,过氧化氢可产生羟基自由基,从而引发自由基链式反应。而超螺旋(SC)质粒DNA在Fenton反应体系中极易因氧化而使双链断裂形成开环(OC)或线性(L)结构。在同一浓度的琼脂糖凝胶中,超螺旋DNA分子迁移率比线性DNA分子快,线性DNA分子比开环DNA分子快[14]。由图4可以看出,未加提取物的反应组(Lane 2)在羟基自由基的作用下,DNA超螺旋结构发生了严重的解螺旋现象,双链断裂形成了开环和线性结构。而同Lane 2相比,加入100 ng CEOE的Lane 3的DNA超螺旋结构仅发生部分断裂,形成少许开环结构,且未发现线性DNA。此外,随着CEOE浓度的增加,该保护作用呈现逐渐增强的趋势:当提取物添加量达到300ng(Lane 5)时,已不会出现解螺旋现象。这就说明该提取物可有效预防或者修复羟自由基诱导的DNA损伤。

图4 CEOE/Trolox对羟基自由基诱导的DNA损伤的保护作用Fig.4 Protective effect of CEOE/Trolox on hydroxyl radical-induced DNA damage
3 展望
本研究结果表明,椰子种皮油提取物(CEOE)可有效抑制因自由基或活性氧引发的蛋白质羰基和氢过氧化物的增多,并具有一定的过氧化氢清除能力;同时该提取物还可以显著预防和修复羟自由基诱导的DNA损伤;表现出了较好的抗氧化潜能,是一种值得开发的抗氧化剂资源。但是,提取物的主要成分以及其中发挥抗氧化作用的主要物质组成和其抗氧化机理还有待进一步研究。
[1] Guartea R C,Mühlbauerb W,Kellertc M.Drying characteristics of copra and quality of copra and coconut oil[J].Postharvest Biology and Technology.1996 9(3):361-372.
[2] Assa R R,Konan Konan J L,Prades A,et al.Physicochemical characteristics of kernel during fruit maturation of four coconut cultivars(Cocosnucifera L.)[J].African Journal of Biotechnology,2010,9(14):2 136-2 144.
[3] 段岢君,张玉锋,王威,等.脱脂椰子种皮的蛋白质功能性质研究[J].热带作物学报2014,35(1):172-175.
[4] 王秀菊,王丽娟.异丙醇提取大豆油脂的研究[J].粮油加工,2008(6):48-50.
[5] Seneviratnea K N,HapuarachchIa C D,Ekanayakeb S.Comparison of the phenolic-dependent antioxidant properties of coconut oil extracted under cold and hot conditions[J].Food Chemistry,2009,114(4):1 444-1 449.
[6] CHENG F F,CHEN W J,HUANG Y L,et al.Protective effect of areca in orescence extract on hydrogen peroxideinduced oxidative damage to human serum albumin[J].Food Research International,2011,44(1):98-102.
[7] Levine R L,Wehr N,Williams J A,et al.Determination of carbonyl groups in oxidized proteins[J].Methods in Molecular Biology,2000,99:15-24.
[8] Gay C A,Gebicki J M.Perchloric acid enhances sensitivity and reproducibility of the ferric-xylenolorange peroxide assay[J].Analytical Biochemistry,2002,304(1):42-46.
[9] Gay C,Collins J,Gebicki J M.Hydroperoxide assay with the ferric-xylenol orange complex[J].Analytical Biochemistry,1999,273(2):149-155.
[10] WEI Q Y,ZHOU B,CAI Y J,et al.Synergistic effect of green tea polyphenols with trolox on free radical induced oxidative DNA damage[J].Food Chemistry,2006,96(1):90-95.
[11] Stadtman E R.Oxidation of free amino acids and residues in proteins by radiolysis and by metal-catalyzed reaction[J].Annual Review of Biochemistry,1993,62:797-821.
[12] Gieseg S,Duggan S,Gebichi J M.Peroxidation of proteins before lipids in U937 cells exposed to peroxyl radicals[J].Biochemical Journal,2000,350:215-218.
[13] Hyslop P A,Hinshaw D B,Halsey W A.et al.Mechanisms of oxidant-mediated cell injury.The glycolytic and mitochondrial pathways of ADP phosphorylation are major intracellular targets inactivated by hydrogen peroxide[J].The Journal of Biological Chemistry,1988,263:1 665-1 675.
[14] Henle E S,Han Z X,Tang N,et al.Sequence-specific DNA Cleavage by Fe2+-mediated Fenton reactions has possible biological implications[J].The Journal of Biological Chemistry,1999,274:962-971.
