鲜切生菜贮藏过程中优势腐败细菌的多样性分析*
2014-12-16崔慧玲陈安均罗婵夏姣董维孙梦远
崔慧玲,陈安均,罗婵,夏姣,董维,孙梦远
(四川农业大学食品学院,四川雅安,625014)
鲜切蔬菜(fresh-cut vegetables)是以新鲜蔬菜为原料,经过严格的挑选、分级、清洗、修整、去皮、切分、修整、包装等工序处理,再经过低温运输进入冷柜销售的即食或即用蔬菜制品,也称为“最小加工”(minimally processed)、“轻度加工”(lightly processed)等,具有品质新鲜、食用方便、营养卫生和经济价值等优点。由于鲜切蔬菜人为地使蔬菜组织结构受到机械性损伤,容易造成微生物污染[1],引发一些不良的生理反应,破坏正常的组织代谢,加速组织衰老与腐败,影响食用安全性,降低鲜切蔬菜的商品价值[2]。
目前,生活节奏的加快和消费者购买力的增强,鲜切蔬菜的消费市场需求促进了鲜切蔬菜产品行业的迅速发展。其中,鲜切蔬菜的微生物污染是直接限制产品流通和货架期的重要因素之一,可能直接影响到消费者的购买欲望。在生产、运输和贮藏过程中因为微生物的生长繁殖导致鲜切产品的腐败,一直是困扰生产者的一个重要问题。
鲜切果蔬大都是从生理生化[3]、品质[4]、清洗方式[5]、清洗(杀菌)剂[6]、褐变[7]和保鲜[8]等方面进行研究,对微生物,尤其是腐败菌的研究较少[9]。目前人们主要针对引起食源性疾病的一些致病菌,如沙门氏菌(Salmonella)[10]、大肠埃希氏菌(E.coil O157∶H7)[10-11]和单增李斯特菌(L.monocytogenes)[10,12]做了相关的控菌技术研究。但是一般情况下无条件致病菌的存在,大都是腐败菌,因此进行腐败菌相关的研究是很有必要的。
关于鲜切生菜中优势腐败菌的分离鉴定,国内外报道较少且结论不一,仍需要继续深入研究:Randazzo等[13]研究报道生菜原料表面存在大量的假单胞菌、肠杆菌和欧文氏菌,鲜切生菜的优势腐败细菌是荧光假单胞杆菌、成团泛菌和水生拉恩氏菌。Jacxsens等[14]从腐败的鲜切生菜中分离鉴定得到成团泛菌、水生拉恩氏菌和荧光假单胞菌均是革兰氏阴性菌,但是没有对原料表面的细菌作相关分析研究;Oliveira等[15]分析了西班牙18个农场的新鲜生菜原料表面的细菌,主要是假单胞菌、肠杆菌和一些嗜冷细菌。Eni等[16]发现新鲜生菜表面存在大量的微球菌和克雷伯氏菌,初始细菌总数为7.23 CFU/g。采用分子生物学的方法进行分析研究,对鲜切生菜中的优势腐败细菌予以识别,这将为下一步进行腐败细菌的溯源分析提供依据,从而进行加工过程中的重点工艺及过程控制,为研究防腐保鲜技术奠定基础,从而延长鲜切生菜的货架期。
1 材料和方法
1.1 材料与试剂
新鲜生菜 购买于当地农贸市场,迅速运回实验室后置于4℃冰箱备用。
1.2 供试培养基
营养肉汤:营养肉汤:蛋白胨10 g,牛肉膏3 g,NaCl 5 g,蒸馏水1 000 mL,pH(7.2 ±0.2),供菌株活化用。
营养琼脂培养基:蛋白胨10 g,牛肉膏3 g,NaCl 5 g,琼脂 15 g,蒸馏水 1000 mL,pH(7.0 ±0.2)。菌株编号以N1、N2……计。
MRS(乳酸菌琼脂培养基):蛋白胨10g,酵母粉4 g,葡萄糖20 g,吐温80 1.0 mL,K2HPO42 g,乙酸钠5 g,柠檬酸三铵 2 g,MgSO40.2 g,牛肉粉 5 g,MnSO40.05 g,琼脂 15 g,蒸馏水 1 000 mL,pH6.2 左右。菌株编号以M1、M2……计。
VRBDA(肠杆菌科琼脂培养基):酵母粉10 g,蛋白胨 7 g,NaCl 5 g,葡萄糖 10 g,3 号胆盐 1.5 g,结晶紫0.002 g,中性红0.03 g,琼脂15 g,蒸馏水1 000 mL,pH(7.3±0.2)。菌株编号以V1、V2……计。
PSA(假单胞菌琼脂培养基):蛋白胨16 g,酸水解酪蛋白 10 g,K2SO410 g,MgCl214 g,琼脂 11 g,甘油10 mL,蒸馏水1 000 mL,pH(7.1±0.2)。菌株编号以P1、P2……计。
MSA(葡萄球菌琼脂培养基):牛肉浸膏1 g,多价胨 10 g,D-甘露醇 10 g,NaCl 15 g,琼脂 15 g,酚红0.025 g,蒸馏水 1 000 mL,pH(7.4 ±0.2)。菌株编号以M1-1、M1-2……计。
上述培养基均在121℃灭菌15 min,供实验所用。
1.3 仪器与设备
BT124S型电子天平,北京赛多利斯仪器系统有限公司;V-1200型可见分光光度计,上海美谱达仪器有限公司;SYQ-DSX-280B型手提式不锈钢压力蒸汽灭菌锅,上海申安医疗器械厂;BCD-216TXN型海尔冰箱,青岛海尔股份有限公司;SW-CJ-1F型单人双面净化工作台,浙江苏净净化设备有限公司;BPC-250F型生化培养箱,上海一恒科科学仪器有限公司;DNP-9162型电热型恒温鼓风干燥箱,上海精宏实验设备有限公司;PTC-200型PCR仪,BIO-RAD公司;DY-A型电泳仪,上海康达仪器厂;Gel Doc XR型凝胶成像仪,BIO-RAD公司;SORVALL型离心机,美国科骏仪器有限公司。
1.4 实验方法
1.4.1 鲜切生菜的制作工艺流程
原料→挑选、整理→冲洗(除去生菜表面的泥土等杂质)→人工切割(块、丝、丁等)→清洗→沥干→包装→贮藏。
分装50 g/袋,标号1~10,平行3组,置于4℃贮藏。
1.4.2 感官变化与微生物分析
感官变化:判断鲜切生菜的颜色、气味与质地,进而评价鲜切生菜的腐败程度,腐败程度用无异味和无软腐现象、略有腐臭味和软腐现象、强烈的腐臭味和软腐现象来衡量。紧密饱满,色泽鲜亮,无褐变和菜斑。鲜切生菜呼吸和蒸腾作用均较强,由于各种生化反应速率较快,褐变和萎缩现象明显,松散,成褐黄色,菜斑点,外观纤维感强,达到感官拒绝点。
目前,鲜切生菜还没有相应的食用品评标准,参照李会合等[17]的品评指标,采用系统评分法对样品品质的诸方面进行鉴别,根据各自的经验评分,对各因素在品质评价中所起的作用给予不同的加权系数,经评定后使结果数量化,再经统计分析,使结果比较客观地反映样品间的差异。鲜切生菜的品质评价指标有脆度、多汁度、色泽、气味及质地5项,其中脆度、气味的加权系数为0.2,多汁度和色泽的加权系数为0.25,质地的加权系数为0.1,参考标准的各项指标均为10分,通过数学处理制定量化标准,5项指标总分为20分定为合格,40分以上者为优。
从食品专业老师和研究生中选出10人组成评委,分别对产品的脆度、多汁度、色泽、气味及质地5项进行评定,进而评价鲜切生菜的腐败程度,感官评定指标见表1。
在已经灭菌20 min的超净工作台中,将剪刀用75%的酒精作表面消毒后,无菌操作从鲜切生菜的不同组织剪取10 g,放入90 mL的无菌生理盐水的三角瓶中,充分振荡,制成1∶10的菌悬液。
取1 mL上述稀释的菌悬液,10倍梯度稀释,加至9 mL的无菌生理盐水中,选取合适的稀释梯度,吸取0.1 mL的菌液,置于5种备用固体培养基平板中,涂布平板,重复3组,均在37℃下培养48 h,观察并记录结果。计数方法参照GB/T4789.2-2010[18]。

表1 鲜切生菜的感官评定指标Table 1 Sensory indicators of fresh-cut lettuce during storage
1.4.3 腐败菌的分离纯化
从营养琼脂固体培养基中选取典型生长的单一菌落,平板划线法反复分离纯化,镜检,得到纯菌株。把纯菌株转移接种至斜面培养基,作为鉴定用菌株。
1.5 优势腐败菌的确定
1.5.1 形态学观察
菌落形态观察:观察单菌落的大小、形状、质地、颜色、透明度、边缘结构、表面状态等。
菌体形态观察:挑取细菌18h培养物制成载片标本,观察细胞形态、排列方式等。
1.5.2 回接实验
新鲜生菜弃去外层受损叶片,用流动自来水冲洗表面的泥土,用95%的酒精灭菌的小刀把生菜分割成约5 cm×1 cm(长×宽)的组织条,置于50 mg/L的ClO2溶液中杀菌2 min,无菌蒸馏水漂洗,捞出后于无菌超净工作台中自然晾干。
在37℃条件下活化菌株,摇床培养18~24 h,得到菌悬液。无菌操作使接种菌液的OD600nm约为0.2,取10 mL溶于990 mL的生理盐水中,按照料液比1∶10,把处理的鲜切生菜组织条悬浮于其中15 s接种,使初始接种量为 104~105CFU/g[19]。常温静置15 min以去掉多余的水分,然后放置于4℃的冰箱中贮藏。
综合感官指标,判断感官拒绝点,初步确定可能的优势腐败菌。
1.5.3 生理生化鉴定
生理生化实验主要包括氧化酶实验、淀粉水解实验、明胶液化实验、糖类发酵实验等,实验方法参考《伯杰细菌简单手册》[20]。
1.5.4 分子生物学鉴定
菌株总DNA的提取:将菌株在培养基中活化培养后,收集菌体。按照TIANGEN细菌DNA提取试剂盒说明书进行总DNA的提取。PCR扩增:16S rRNA的扩增引物采用细菌通用引物,27f:5'-AGAGTTTGATCCTGGCTCAG-3';1492r:5'-ACGGCTACCTTGTTACGACTT-3',由北京六合华大基因科技股份有限公司合成。PCR反应体系(25 μL),其中:上下游引物各 1 μL(10 pmol/μL),模板 DNA(100 ng/μL)1 μL,dNTP MIX 12.5 μL,超纯水9.5 μL。PCR 扩增程序:95℃预变性5 min;94℃变性45 s,56℃退火45 s,72℃延伸1 min 30 s,循环30次;72℃延伸10 min,4℃保藏。PCR产物检测及测序:PCR产物检测后,片段长度约为1 500 bp后的阳性产物直接送北京华大技术有限公司进行测序。琼脂糖凝胶电泳,采用凝胶成像系统拍照保存。
2 结果与分析
2.1 感官变化与微生物计数相关性分析
分别对新鲜状态和4℃贮藏1~10 d的试验样品进行感官评定和微生物计数,结果如图1和表2所示。
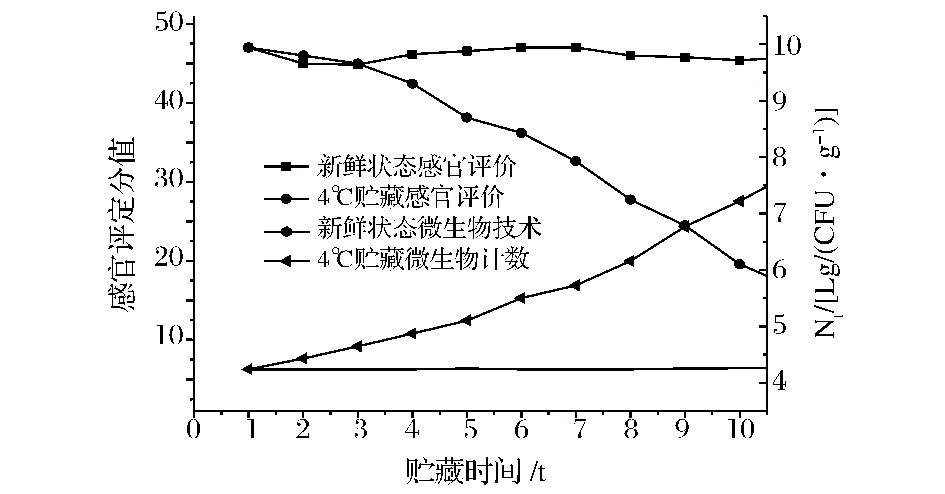
图1 鲜切生菜在不同贮藏条件下1~10 d的感官评定分值和微生物计数Fig.1 Sensory evaluation and microbial counts at different temperature about 1~10 d of the fresh-cut lettuce sample
新鲜状态的样品作为对照,感官指标在45分以上,微生物计数结果在4.27 CFU以下,均处于较好的水平,达到优良标准。4℃贮藏条件下的感官评定分值和微生物计数结果表明:随着贮藏时间的延长,两者呈负相关;4℃贮藏条件下的试验样品在第9天之后感官评定分值在20分以下,即不合格,菌落总数在7 CFU/g左右。由表2可得:新鲜状态下的感官分值与4℃贮藏条件下的感官分值标准偏差S分别为0.824、9.618,新鲜状态下的微生物数量与4℃贮藏条件下的微生物数量标准偏差 S分别为0.009、1.004,很明显看出新鲜状态下的数据离散程度远低于4℃贮藏条件。
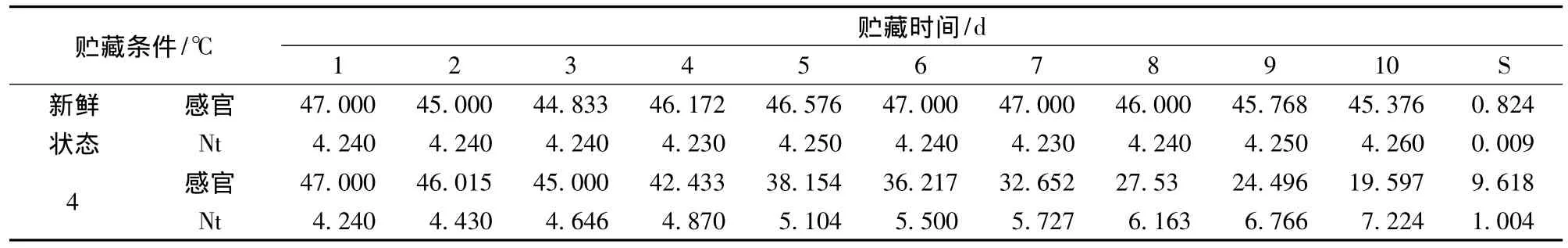
表2 鲜切生菜样品部分感官评定和微生物计数结果汇总Table 2 Sensory evaluation and microbial count results summary of fresh-cut lettuce sample
将鲜切生菜感官评定部分指标与微生物计数指标作为独立因素进行相关性分析,感官评定部分指标与微生物计数指标相关性分析如图2所示。感官评定指标与微生物计数测定结果的相关性分析呈现明显的负相关,相关性系数R为0.918;试验样品感官评定分值越高,菌落总数越处于较低的水平,反之,则处于较高水平,感官评定不合格,试验样品腐败严重。本实验确定20分为产品不能接收的感官分值,根据回归方程可以推出:4℃贮藏条件下,菌落总数为7.663 CFU/g,此时达到感官不可接受。

图2 鲜切生菜感官评定指标与微生物计数测定结果的相关性分析Fig.2 Correlation analysis between sensory evaluation and microbial count results of fresh-cut lettuce sample
2.2 优势腐败菌的初步确定
2.2.1 菌株的形态学观察
新鲜生菜初始细菌总数为4.27 CFU/g,取样涂布平板,待培养48 h后从5种不同的固体培养基表面初步挑取了18株,分离纯化后结合菌落特征和个体形态,筛选了5株为 P1、M1-1、M1-4、M3和 V4。以新鲜生菜为原料,实验室自制鲜切生菜,分装后置于4℃贮藏,第10天时细菌总数为7.224 CFU/g。取样涂布平板,待培养48h后从5种不同的固体培养基表面初步挑取了15株菌,分离纯化后进行回接实验,初始接种量为4.24 CFU/g,置于4℃下贮藏,每天观察并记录结果,结合菌落特征和个体形态,筛选出7株腐败细菌为 P2、M1-1、M1-2、M1-3、V2、V3 和 N1。菌株的形态学特征如表3。

表3 菌株的形态学特征Table 3 Morphological characteristics of strains
2.2.2 菌株的生理生化实验 菌株的部分生理生化实验如表4。
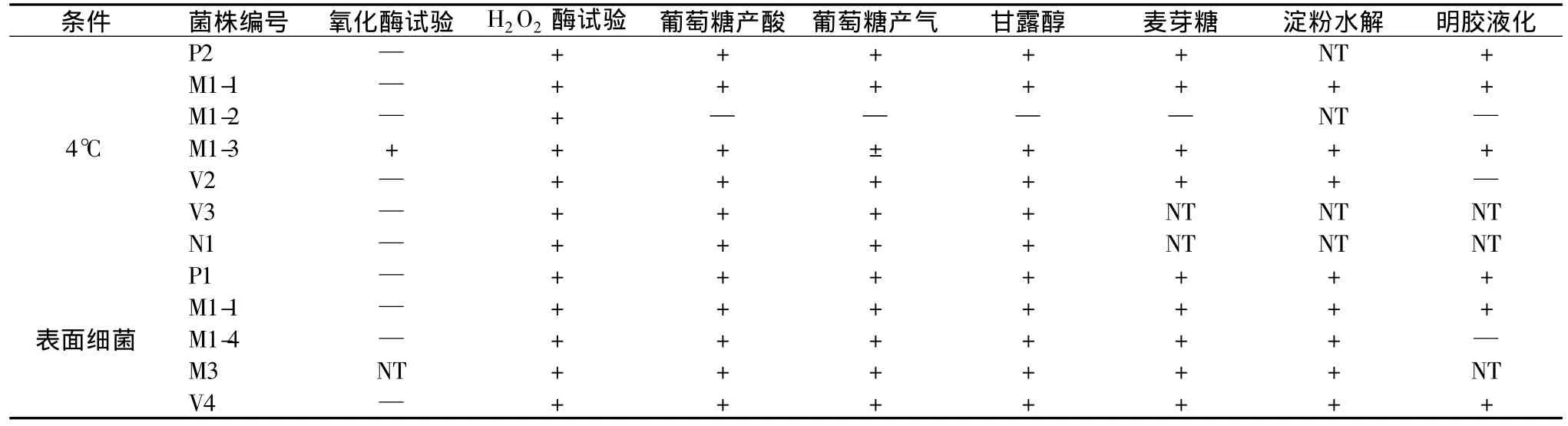
表4 菌株的部分生理生化实验Table 4 A part of physiological and biochemical experiments of strains
2.2.3 分子生物学鉴定
将筛选得到的12个菌株以总DNA为模板,PCR扩增后经电泳检测,均得到了1 500 bp左右的条带,如图3所示。图中1为2 000 bp的Marker,鲜切生菜优势腐败细菌2~8,对应菌株编号为:P2、M1-1、M1-2、M1-3、V2、V3 和 N1,生菜原料表面细菌 9 ~13,对应的菌株编号为:P1、M1-1、M1-4、M3 和 V4。
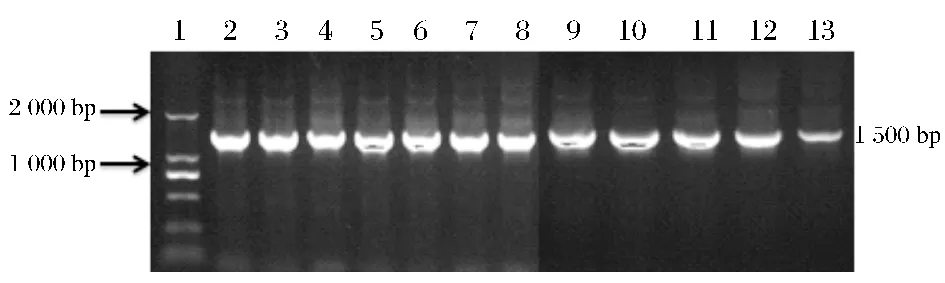
图3 菌株的PCR产物电泳图Fig.3 Electrophoresis profiles of PCR produces of strains
将PCR扩增产物送至北京华大技术有限公司进行测序,测得它们的16S rRNA序列(0M1-1与4M1-1的基因序列完全相同,是同一种菌,文中全部以0M1-1表示)并与GenBank数据库已有的序列比对,选取同源性在99%以上的模式菌株序列构建系统发育树,如图4所示,菌株编号前面的0和4分别表示生菜原料和贮藏在4℃下的鲜切生菜。4N1是泛菌属(Pantoea)的一个亚种,同源性为57%,鉴定结果为菠萝泛菌(Pantoea ananatis);0M1-1与 Exiguobacterium sp.F30的同源性为59%,可知0M1-1是微小杆菌属(Exiguobacterium)的一个亚种,0P1鉴定结果为乙酰微小杆菌(Exiguobacterium acetylicum),与0M1-1和Exiguobacterium sp.F30的同源性为55%,同为微小杆菌属(Exiguobacterium);其他编号菌株均与模式菌株同源性在100%,鉴定结果可靠。另外,0V4和4V2亲缘关系最近,由近到远为 4V3、0M1-4、4N1、4P2、4M1-2和4M1-3,4V3和4N1亲缘关系较近,它们均与0M1-1的亲缘关系最远,其次为0P1和0M3。
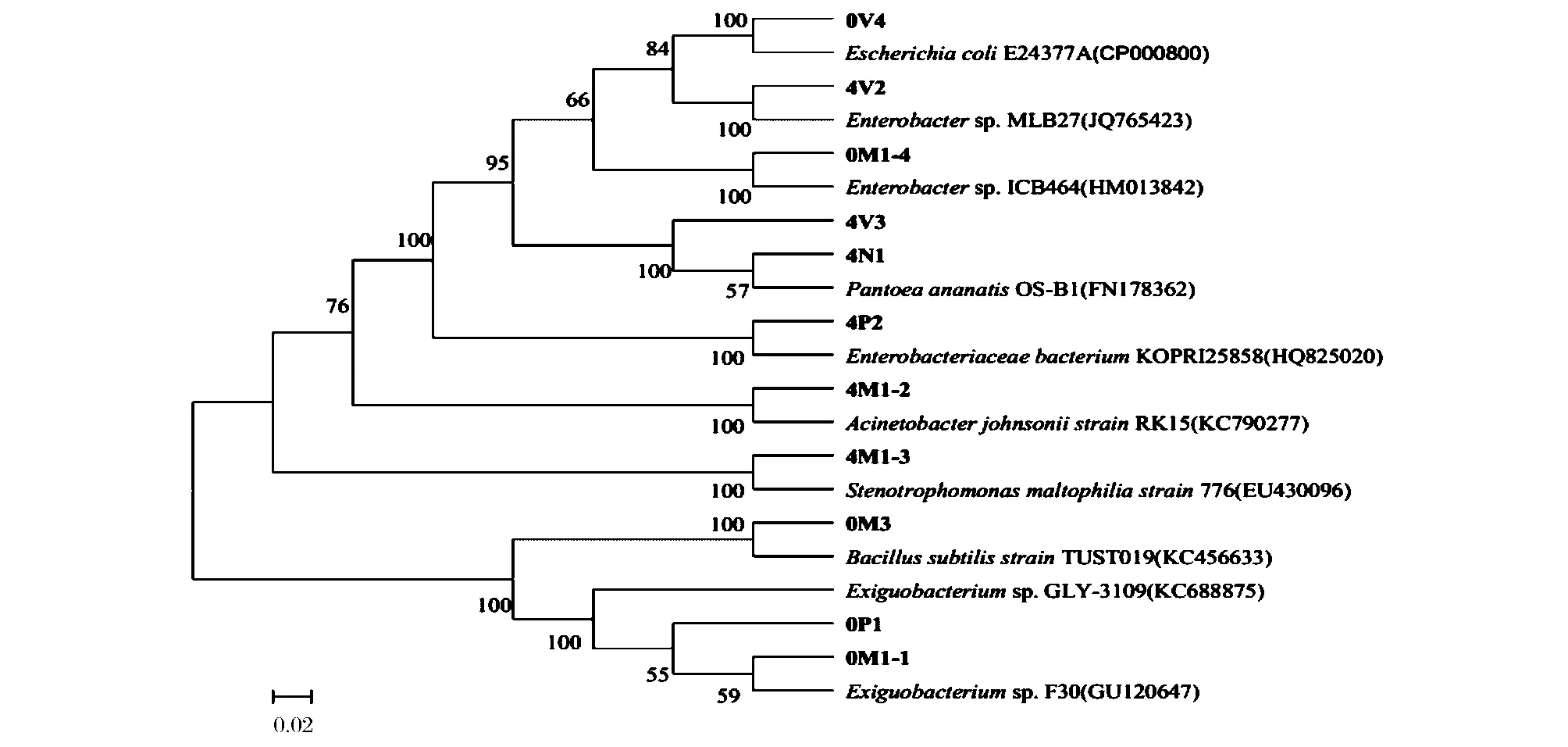
图4 生菜表面细菌和贮藏在4℃的鲜切生菜优势腐败细菌用邻接法构建的系统发育树Fig.4 Neighbor-joining phylogenetic tree showing the relationship between sequences of bacteria on the surface of lettuce and dominant spoilage bacteria of fresh-cut lettuce storage at 4℃
用节点和树枝来表示菌株不同种群之间的亲缘关系,分支离根部越远,说明亲缘关系越远,且越是近种,做UPGMA系统发育树,如图5所示。4V3和4N1亲缘关系最近,且与0V4和4P2比较近,0P1和0M1-1亲缘关系最近,均与0M1-4和4V2亲缘关系最远,其次为0M3。
3 结论与讨论
(1)鲜切卷心菜中贮藏过程中感官指标及微生物计数测定的相关性分析结果表明:感官指标在45分以上,微生物计数结果在4.24CFU以下,均处于较好的水平,达到优良标准;随着贮藏时间的延长,两者呈显著负相关,感官评定分值在20分以下为不及格,即产品腐败,此时菌落总数达到7.224 CFU。
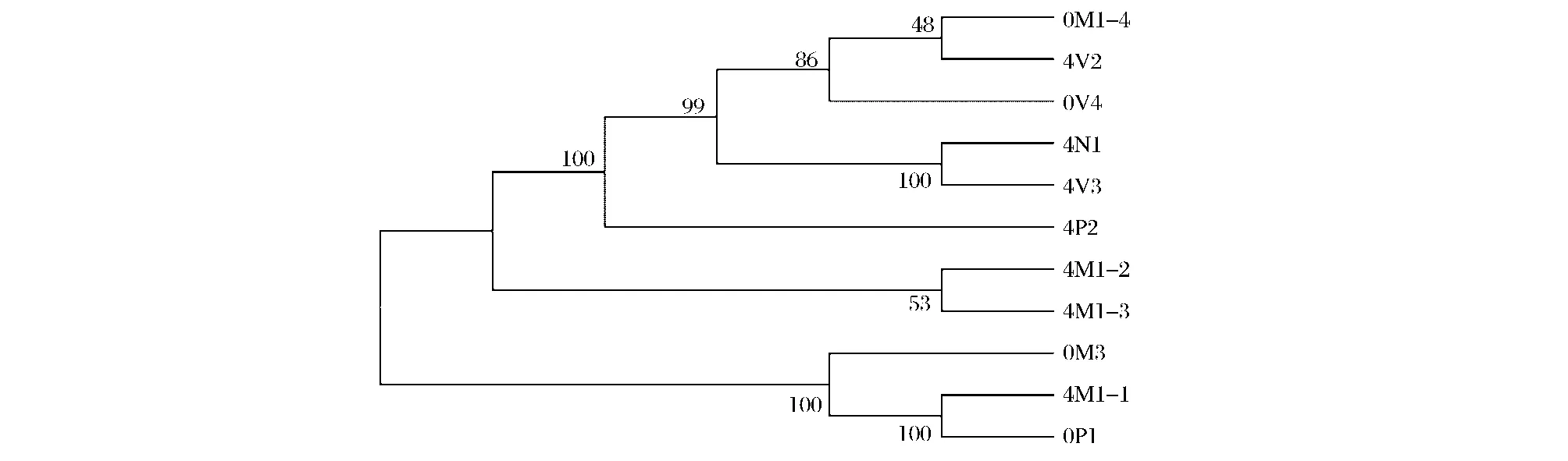
图5 生菜表面细菌和贮藏在4℃的鲜切生菜优势腐败细菌的UPGMA系统发育树Fig.5 UPGMA dendrogram generated from of bacteria on the surface of lettuce and dominant spoilage bacteria of fresh-cut lettuce storage at 4℃
(2)从生菜原料和鲜切生菜中分别得到5个和7个菌株,通过生理生化特性、形态学观察等传统检测方法结合16S rRNA序列分析,结果表明:生菜原料中M1-1是微小杆菌的某一种(Exiguobacterium sp.M1-1)、P1是乙酰微小杆菌(Exiguobacterium acetylicum),V4是肠埃希氏菌(E.coli)、M1-4阿斯布肠杆菌(Enterobacter asburiae),M3枯草芽孢杆菌(Bacillus tequilensis)。
(3)在4℃下的鲜切生菜的优势腐败细菌为M1-1微小杆菌属的某一种(Exiguobacterium sp.M1-1),M1-2约氏不动杆菌(Acinetobacter johnsonii)、P2不动杆菌属的某一种(Acinetobacter sp.P2),M1-3单胞菌的某一种(Stenotrophomonas sp.M1-3),N1菠萝泛菌(Pantoea ananatis)、V3泛菌属的某一种(Pantoea sp.V3),V2肠杆菌属的某一种(Enterobacter sp.V2)。
(4)生菜原料中的M1-1与鲜切生菜中的腐败菌M1-1是同一种,说明该菌是鲜切生菜特有的优势腐败细菌,贮藏鲜切生菜中枯草芽孢杆菌没有检测到,肠杆菌与生菜原料中为不同种,另外,还鉴定得到不动杆菌、单胞菌和泛菌。已有大量研究表明:假单胞菌是引起鲜切生菜腐败的特定腐败菌,但是生菜原料表面细菌并没有发现假单胞菌、微球菌、克雷伯氏菌和欧文氏菌,腐败细菌也未检测到水生拉恩氏菌和荧光假单胞菌,可能是由于贮存条件及生产环境的不同导致鲜切生菜中腐败细菌有所不同,对于鲜切生菜中腐败细菌的来源,目前还没有一致的定论。除微小杆菌外,初步推断出其他优势腐败细菌来源于加工操作,因此下一步将从加工操作过程中取样验证这些腐败细菌的来源,以期为提高鲜切生菜生产安全性提供指导。
[1] Tournas,V H.Spoilage of vegetable crops by bacteria and fungi and related health hazards[J].Critical Review of Microbiology,2005,31(1):33-44.
[2] 郑林彦,韩涛,李丽萍.国内切割果蔬的保鲜研究现状[J].食品科学,2005,26(z1):125-127.
[3] Deza-Durand K M,Petersen M A.The effect of cutting direction on aroma compounds and respiration rate of freshcut iceberg lettuce(Lactuca satviva L.)[J].Postharvest Biology and Technology,2011,61(1):83-90.
[4] 鲁莉莎,乔勇进,王海宏.热处理对鲜切生菜品质的影响[J].四川农业大学学报,2010,28(3):333-338.
[5] 欧阳杰,程裕东,吴绪敏,等.不同清洗方法对鲜切豇豆贮藏期间品质和安全性的影响[J].食品科学,2007,28(10):548-550.
[6] 燕平梅,樊文菊,王青,等.不同清洗剂对鲜切豇豆品质的影响[J].食品工程,2010(1):40-44.
[7] CHEN Z,ZHU C,ZHANG Y,et al.Effect of aqueous chlorine dioxide treatment on enzymatic browning and shelflife of fresh-cut asparagus lettuce(Lactuca sativa L.)[J].Postharvest Biology and Technology,2010,58(3):232-238.
[8] 林永艳,谢晶,朱军伟,等.清洗方式对鲜切生菜保鲜效果的影响[J].食品与机械,2012,28(1):211-213.
[9] 金长娟,弭道彬.我国果品蔬菜贮藏保鲜的现状与发展对策[J].中国园艺文摘,2010(1):51-52.
[10] Oliveira M,Usall J.Microbiological quality of fresh lettuce from organic and conventional production[J].Food Microbiology,2010,27(5):679-684.
[11] Guiomar D,Posada-Izquierdo,Fernando Pérez-Rodríguez,et al.Modelling growth of Escherichia coli O157:H7 in fresh-cut lettuce submitted to commercial process conditions:Chlorine washing and modified atmosphere packaging[J].Food Microbiology,2013,33(2):131-138.
[12] Ozturk I.Application of non-linear models to predict inhibition effects of various plant hydrosols on Listeria monocytogenes inoculated on fresh-cut apples[J].Foodborne Pathogens and Disease,2012,9(7):607-616.
[13] Randazzo C L,Scifò G O,Tomaselli F,et al.Polyphasic characterization of bacterial community in fresh cut salads[J].International Journal of Food Microbiology,2009,128(3):484-490.
[14] Jacxsens L,Devlieghere F,Ragaert P,et al.Relation between microbiological quality,metabolite production and sensory quality of equilibrium modified atmosphere packaged fresh-cut produce[J].International Journal of Food Microbiology,2003,83(3):263-280.
[15] Oliveira M,Usall J,Viñas I,et al.Microbiological quality of fresh lettuce from organic and conventional production[J].Food Microbiology,2010,27(5):679-684.
[16] Eni AO.Microbial quality of fruits and vegetables sold in Sango Ota,Nigeria[J].African Journal of Food Science,2010,4(5):291-296.
[17] 李会合,田秀英,季天聋.蔬菜品质评价方法研究进展[J].安徽农业科学,2009,37(13):5 920-5 922.
[18] GB/T4789.2-2010.食品卫生微生物学检验菌落总数测定[S].
[19] 李苗云,张建威,樊静,等.生鲜鸡肉货架期预测模型的建立与评价[J].食品科学,2012,33(23):60-63.
[20] 布坎南,吉本斯(中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组,译).伯杰细菌鉴定手册[M].北京:科学出版社,1984:667-758.
