采用SPE-HPLC测定啤酒中15种酚酸化合物
2014-12-16王莉娜胡雪莲
王莉娜,胡雪莲
1(北京燕京啤酒集团公司技术中心,北京,101300)
2(燕京啤酒啤集团酒酿造技术北京市重点实验室,北京,101300)
酚酸类化合物广泛分布于各种植物体中,它是植物体重要的次生代谢产物。酚酸类化合物中的酚羟基是优良的氢给予体,对过氧自由基(·OOH)、羟基自由基(·OH)等具有明显的清除作用。由此,植物中的酚酸类化合物成为一种非常优良的天然抗氧化剂。有研究表明,酚酸对人体具有抗氧化、抗自由基、抗炎、抗癌等一系列保健药效功能。啤酒是以麦芽和啤酒花为酿造原料的低酒精类饮料,其中含有较丰富的酚酸类物质。众所周知,啤酒一经灌装,即开始了风味逐渐恶化的过程,随着储存时间的延长,啤酒会逐渐出现令人不愉快的氧化味,目前国际上对氧化味的形成已基本达成共识:认为啤酒氧化味形成主要有6种途径,包括啤酒中类黑精、不饱和脂肪酸等物质的自氧化过程等。酚酸作为一类具有抗氧化功效的物质,能够延缓,甚至阻止氧化过程的发生[1-3]。因此对啤酒中酚酸类物质进行准确测定在啤酒风味稳定性的研究中具有十分重要的意义。
对于酚酸的测定,已报道的分析方法主要有液相色谱法、液相色谱-质谱法、毛细管电泳法等,高效液相色谱法是目前较为常用的酚酸分析方法。但由于啤酒中酚酸含量较低,啤酒基体又十分复杂,因此准确测定啤酒中酚酸的含量是一项十分困难的工作。通常需先行对啤酒中的酚酸进行分离、富集等处理后,方可用于仪器分析。溶剂萃取浓缩是早年曾用的技术,刘群涛等采用乙酸乙酯萃取测定了啤酒的10种酚酸,但该法操作繁琐,溶剂耗量大,检测的灵敏度低[5]。比较而言,固相萃取是近年所用的更简捷有效的样品前处理技术。2004年,García等人在无醇啤酒的酚酸分析中,采用Waters Sep Pak C18固相萃取柱作样品的萃取净化,测定了啤酒中10种酚酸组分,但该方法测定结果中大部分酚酸组分回收率较低,并且公认对啤酒抗氧化能力具有重要作用的没食子酸的回收率仅6%,且未在实际样品检测中均未能检出[4]。2007年,DVOˇRÁKOVÁ等人对6种固相萃取小柱的萃取净化效果进行了较为详细的研究,指出不同类型的固相萃取柱对啤酒中酚酸检测的回收率和精密度有较大影响[6]。本研究采用SPE-HPLC方法,在研究比较了,并优化了SPE柱的种类、淋洗操作及样品pH等诸多条件后,着力解决了没食子酸测定的瓶颈问题,同时将酚酸的检测对象扩大到15种,操作更加简便,灵敏度及准确度都有了较大提高。
1 材料与方法
1.1 试剂与材料
没食子酸、原儿茶酸、儿茶酸、对羟基苯甲酸、对羟基苯乙酸、绿原酸、香草酸、咖啡酸、表儿茶酸、丁香酸、对-香豆酸、阿魏酸、芥子酸、水扬酸、肉桂酸、槲皮素等,采购于SIGMA试剂公司。
Oasis HLB固相萃取柱(1 mL),Oasis MAX固相萃取柱 (3 mL),均购于Waters公司。
1.2 仪器与设备
高效液相色谱仪(2695型,带有waters 2489紫外/可见检测器,美国Waters公司),固相萃取装置(WIN SPE12,北京莱伯泰科仪器公司)。
1.3 色谱条件
色谱柱 ZORBAX ODS柱 4.6 mm×250 mm,5 μm。流动相A:0.1%乙酸-甲醇溶液,流动相B:1%乙酸-水溶液。流动相洗脱梯度程序:0~25 min,10% ~30%A;25 ~40 min,30%A;40 ~60 in,30% ~60%A;60~61 min,60% ~10%A;61~75 min,10%A。流速 v=1.0 mL/min,柱温:30℃,检测波长 280 nm,进样量 10 μL。
1.4 标样的配制
混标储备液1:分别称取0.05 g没食子酸、原儿茶酸、对羟基苯甲酸、对羟基苯乙酸、绿原酸、阿魏酸、丁香酸、对香豆酸、咖啡酸于同一烧杯中,用甲醇溶解后,定容于100 mL容量瓶中,该标准储备液浓度为500 mg/L。
混标储备液2:各称取0.1 g肉桂酸、香草酸、儿茶酸、水扬酸于同一烧杯中,用甲醇溶解后,定容于100 mL容量瓶中,该标准储备液浓度为1 000 mg/L。
芥子酸标准储备液:称取0.01 g芥子酸,用甲醇溶解后定容至100 mL,该标准储备液浓度为100 mg/L。
表儿茶酸标准储备液:称取0.001 g表儿茶酸,用甲醇溶解后定容至10 mL,该标准储备液浓度为100 mg/L。
上述各标准溶液于4℃冰箱中储存,各标准使用液现用现配。
1.5 样品制备
Waters Oasis HLB柱(1 mL)经1 mL甲醇活化、l mL水(含1%乙酸)洗后,取1 mL经超声波除气的啤酒样品上样,调整流速1 mL/min,然后再经1 mL水(含1%乙酸)洗后,用2 mL酸化甲醇(含1%乙酸)洗脱,收集洗脱液,经0.45 μm膜过滤后,上机检测。
Waters Oasis MAX柱(3 mL)经3 mL甲醇活化后,用3 mL水淋洗,取1 mL经超声波除气的啤酒样品上样,用3 mL 2%的氨水淋洗以锁定目标,之后用3 mL甲醇淋洗;最后3 mL 2%的酸化甲醇洗脱,收集洗脱液,经0.45 μm膜过滤后,上机检测。
2 结果与讨论
2.1 固相萃取条件的优化
2.1.1 固相萃取柱的选择
酚酸是一类带有酚类基团的有机酸,具有一定的极性,在不同的溶剂中具有不同的分配系数;同时酚酸又具有一定的弱酸性,在不同氢离子浓度下会保持不同的离解状态。因此,在本文的研究中选取了反相HLB柱和离子交换模式的MAX柱两种类型的萃取柱,以2 mg/L的混标代替啤酒样品进行实验。
使用HLB固相萃取柱的实验中,标样经固相萃取操作后上机检测,所有组分的回收率均大于90%。在使用MAX萃取柱的实验中,没食子酸、儿茶酸、丁香酸均没有流出,表儿茶酸回收率最高达到88%,其余组分的回收率则在20%~60%之间;当使用酸性更强的三氯乙酸-甲醇作为洗脱液时,各组分的回收率可略有提升,但除表儿茶酸和香草酸回收率大于80%,其余组分回收率均较低。因此本文的研究选用HLB固相萃取柱作为样品制备用小柱。
2.1.2 淋洗液的选择
啤酒样品上样后,对萃取小柱进行水淋洗以去除样品中的干扰杂质组分。图1为经过水洗与不经水洗处理后的样品色谱图。从图1可以明显看出,水洗操作能有效去除样品背景杂质,其中对于没食子酸色谱峰的准确定量显得尤为关键。
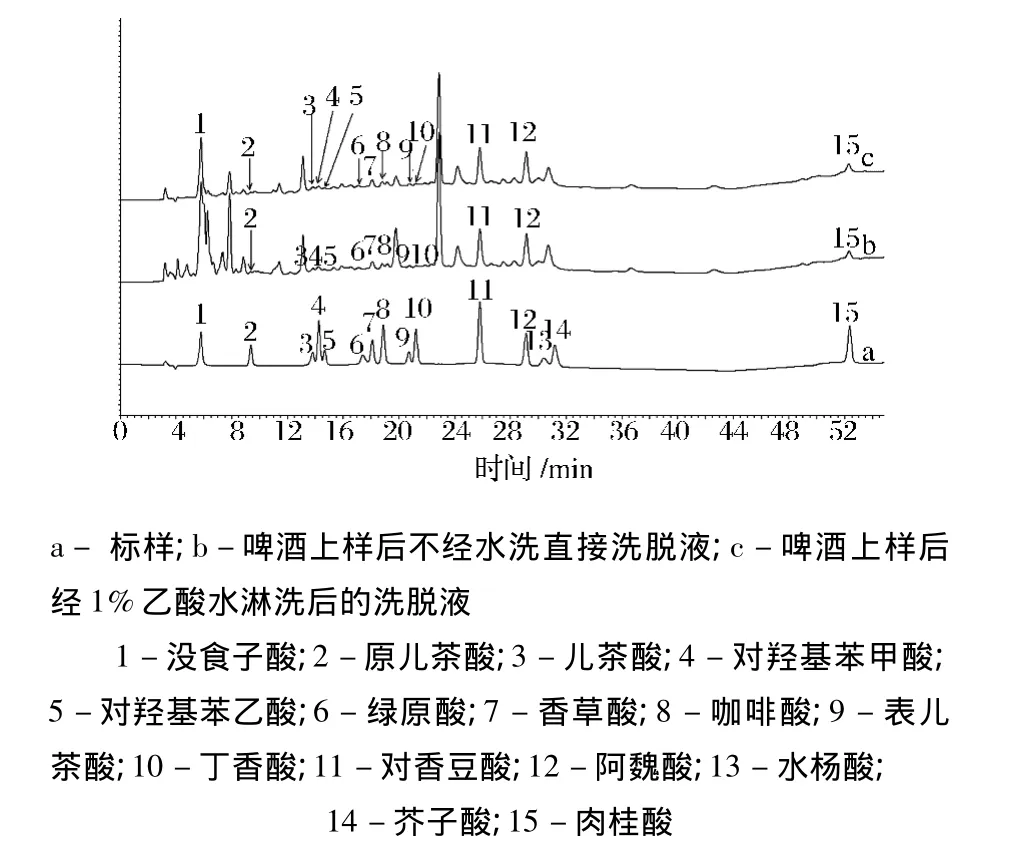
图1 经过水洗与不经水洗处理后的样品色谱图Fig.1 HPLC chromatogram of samples with/without washing with water
为了考察水洗操作对于目标组分的影响,本文以2 mg/L的混标溶液替代样品进行固相萃取操作,接收淋洗液进行酚酸含量分析,结果见图2。从图2可以看出,除没食子酸外,其余酚酸化合物在水洗操作时均没有流失。重复6次实验,计算出没食子酸损失率在7%~10%之间。

图2 固相萃取过程水淋洗对于酚酸组分的影响对比图Fig.2 Comparison chromatograms for the effect of washing on phenolic acid
本研究中对比了超纯水与酸化水淋洗对没食子酸的影响。配制2.0 mg/L的没食子酸标准溶液,取两支SPE固相萃取柱,按2.5中所述进行上样操作,其中一支用超纯水淋洗,另一支用酸化水淋洗。实验重复进行3次。经检测,使用超纯水淋洗的没食子酸含量均值为1.45 mg/L,而使用酸化水淋洗的没食子酸含量均值为1.92 mg/L。从中可以看出,淋洗用水的酸性会影响到对酚酸的测定,这是由于酚酸属于弱酸性物质,在不同氢离子浓度下会保持不同的离解状态,当样品在酸性条件下时,酚酸主要以分子形式存在,所以在样品萃取净化过程中,应避免酚酸以离子形式发生损失,因此,水洗操作步骤应使用酸化水(含1%乙酸)。
2.1.3 样品pH值对测定的影响
酚酸是一类有机弱酸,因此当体系溶液中H+浓度增加时,会使酚酸物质更大程度地呈分子形式存在。在固相萃取过程中,保持样品在低pH值会更有利于酚酸类化合物在反向保留模式的萃取柱上的保留行为。文献[4]和[6]在作SPE柱处理前需要将啤酒样品的pH调为1.5,为了验证调节啤酒pH值对检测结果的影响,本文做了比较试验。取同一瓶啤酒样品,经超声除气后,其中一部分样品用36%的盐酸调至pH1.5,另一部分为原样,两者通过固相萃取处理后进样分析,检测结果见表1。
由表1中看出,啤酒原样和调整啤酒pH为1.5的样品中酚酸测定结果没有明显差异。这是由于啤酒属于弱酸性饮料,pH值通常在4.2~4.3,其缓冲容量很大,而酚酸化合物酸性较弱,在啤酒溶液中解离趋势变小,主要以分子形式存在,因此进一步强化啤酒样品的酸性对于酚酸的分析结果不会产生影响,在本研究中未对啤酒的pH作调整。
2.2 组分的分离与定性
通过标准样品的保留时间比对并结合文献数据对样品组分峰作定性分析。典型的混标及啤酒样品色谱图见图3。有文献报道啤酒中含有一定量的槲皮素[4-6],其来源为啤酒酿造大麦。肉桂酸则是另一来自酒花的酚酸化合物,在本研究中,肉桂酸的出峰保留时间与文献中槲皮素的保留时间较为接近,为对组分峰的确切定性,进行了验证实验。取同一经脱气的啤酒样品分为3份,1份添加2 mg/L的肉桂酸,1份添加2 mg/L的槲皮素,最后1份最为本底,按2.3进行样品制备后上机检测,结果见表2。
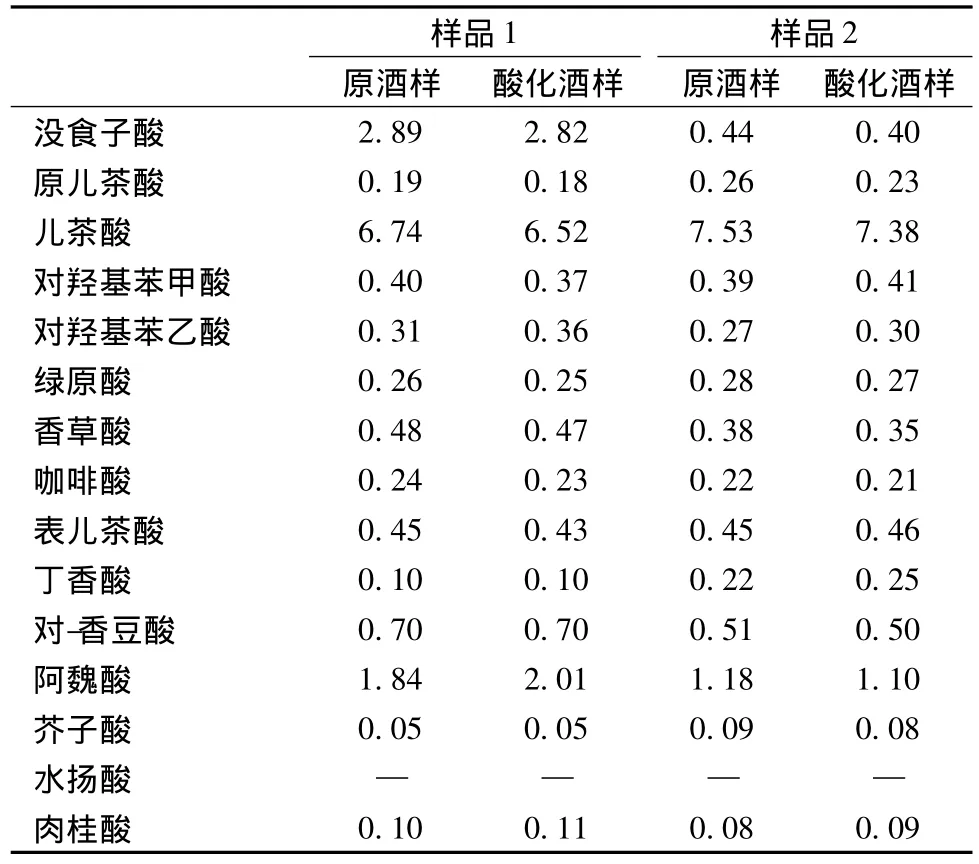
表1 调酸与不调酸样品的检测结果(mg/L)Table 1 Phenolic acid content in beer and acidized beer
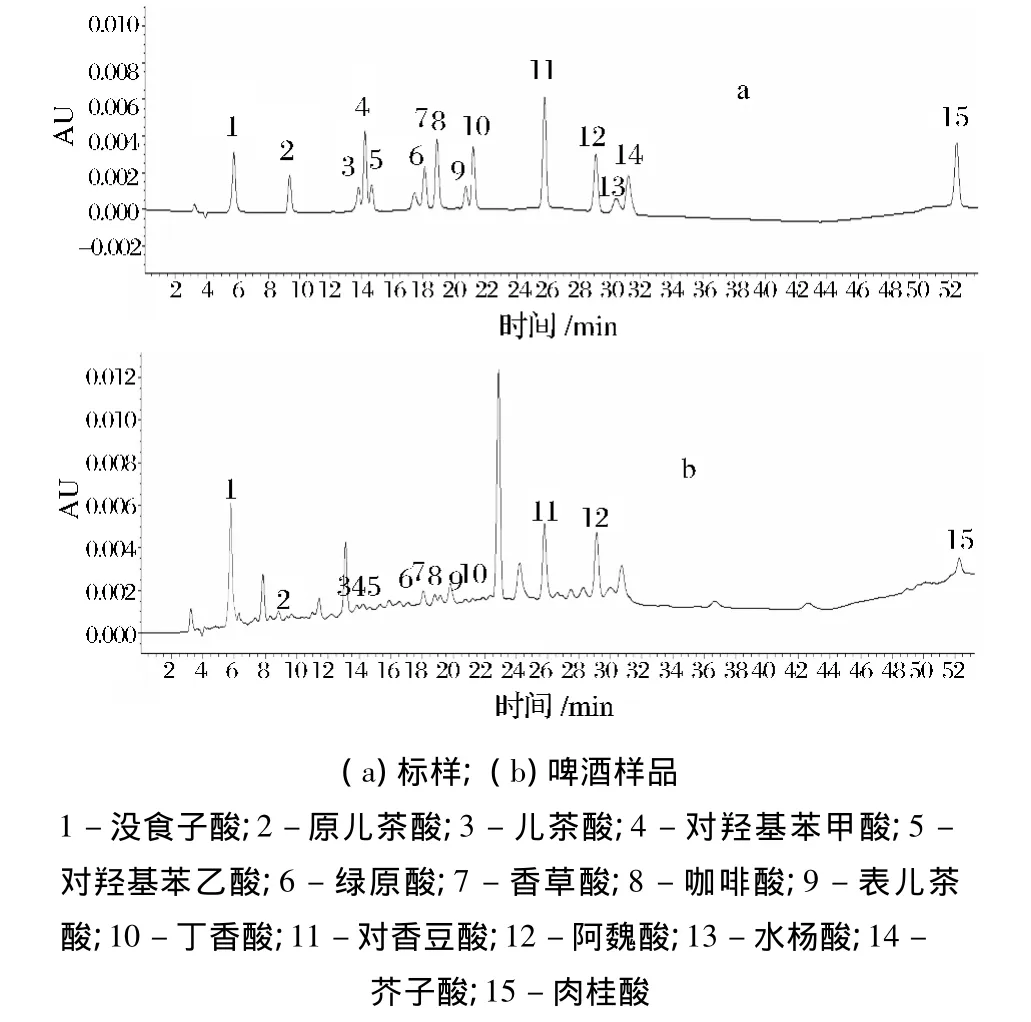
图3 酚酸的高效液相色谱图Fig.3 HPLC chromatograms of phenolic acid

表2 肉桂酸和槲皮素的确证实验检测结果Table 2 Corroboration test of cinnamic acid and quercetin
由表2结果可以看出,在单独添加肉桂酸的样品中,50.73 min处的色谱峰面积较本底峰面积有明显增加,而单独添加檞皮素的样品中,50.73 min的色谱峰面积并无增长。
为了更确切地验证槲皮素的出峰情况,配制了槲皮素的单标溶液于相同色谱条件下进行分析,其结果是在本文色谱条件下,槲皮素没有出峰。推断其原因可能是:槲皮素的水溶性差,在做样品配制时需纯甲醇溶剂才能保持溶液的澄清,而在本文中的色谱条件,甲醇流动相的最大洗脱梯度仅达到60%,而这一梯度维持时间很短,在这一强度下不足以将槲皮素洗脱出来,这可能是造成其不出峰的原因,槲皮素应吸附在柱内未流出。
由此,在本文的色谱条件下,50.73 min处的色谱峰确认为肉桂酸,而非槲皮素。
2.3 回归方程、线性范围与检出限
配制含有15种酚酸组分的系列混合标准溶液,在2.3色谱条件下依次进样,各组分的保留时间、回归方程、相关系数、线性范围及检出限见表3。

表3 15种酚酸组分的保留时间、回归方程、相关系数、线性范围和检出限Table 1 Retention time,linear equations,correlation coefficients,linear range and LODs of 15 phenolic acids
2.4 回收率与精密度
取同一瓶啤酒样品,用HLB小柱按2.5方法处理后上机检测,实验进行3次平行,计算测定结果的相对标准偏差。同时另取约20 mL啤酒样品于100 mL容量瓶中,加入酚酸标准溶液,摇匀,并在室温下放置24 h,样品测定前再充分混匀,按2.5方法进行样品制备,上机检测。结果见表4。
在做方法回收率的实验过程中,如加入标准样品后将容量瓶上下倒置20次,即进行样品处理,实验结果是各酚酸组分的回收率仅在40~80%之间,远不能满足方法要求。分析原因可能是,啤酒样品酒精度低,加入的标准样品与酒液没有达到充分混匀和溶解的状态。将摇匀后的加标样品于室温下静置24 h,进行固相萃取前再充分振摇,然后进行样品测定,即得到表4中结果,测定的回收率良好。
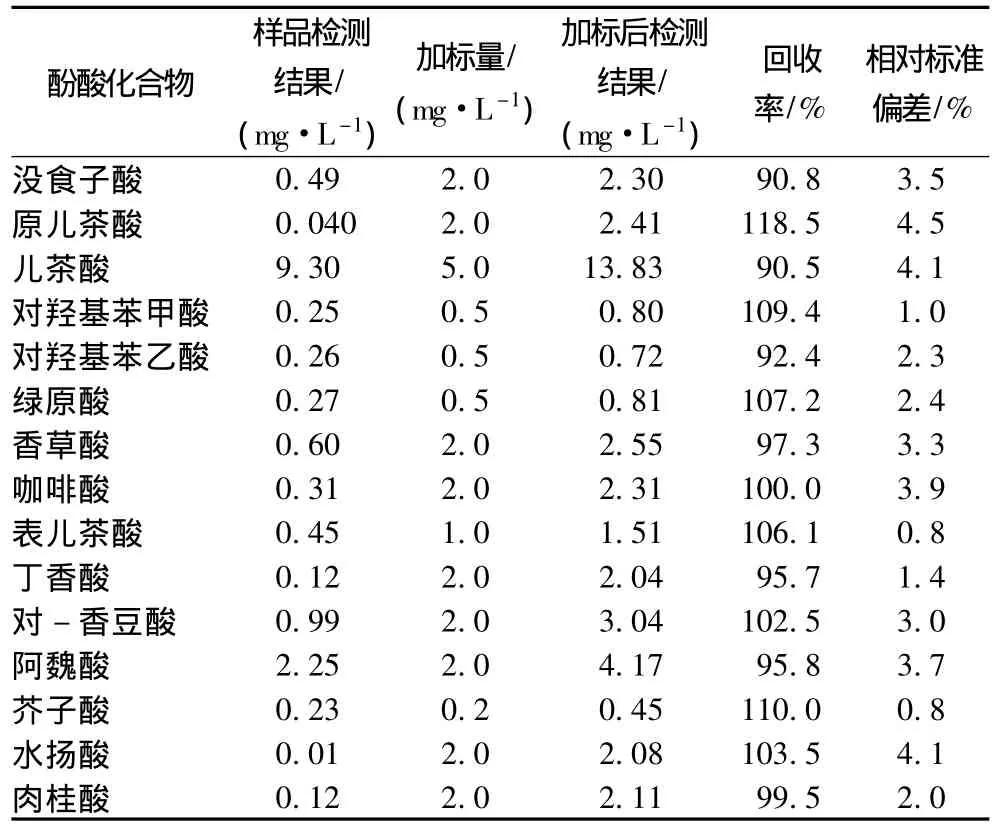
表4 方法回收率及精密度试验结果(n=3)Table 4 Recovery and RSD of 15 phenolic acids
2.5 样品的测定
选取了6种典型市售啤酒样品测定酚酸含量,结果见表5。
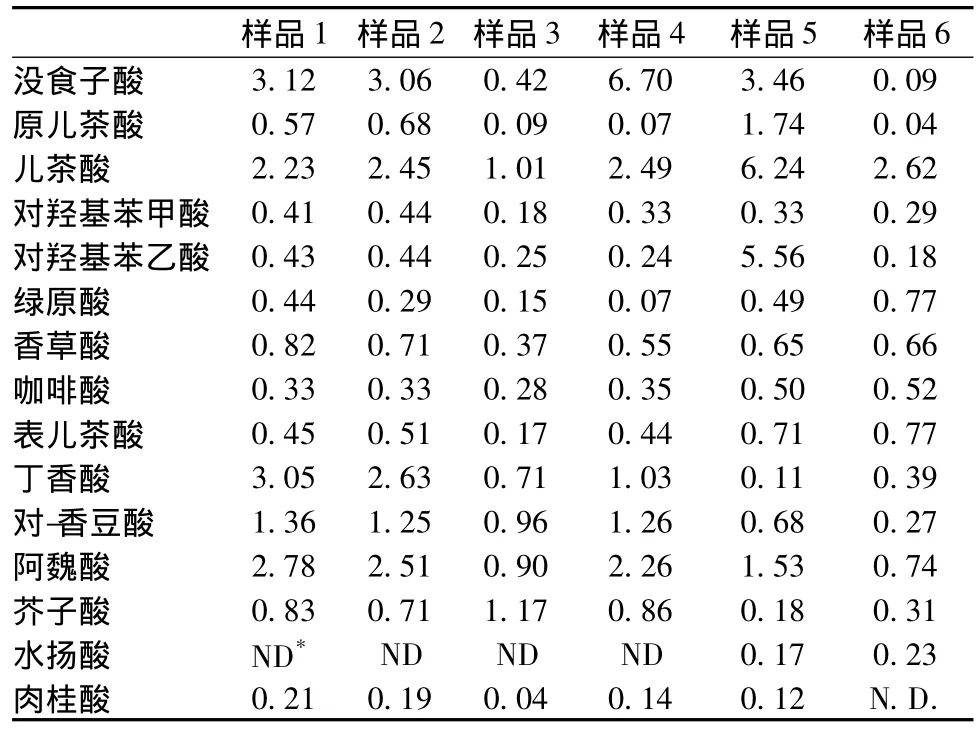
表5 市售啤酒样品酚酸含量检测结果(mg/L)Table 5 Phenolic acids contents in 6 commercial beers
应用本方法测定了6个市售啤酒,结果发现,不同啤酒中各酚酸物质的含量有一定的区别,可能与其生产原料、加工工艺的不同有关。从总体来看,各啤酒中的没食子酸、儿茶酸、丁香酸、对香豆酸和阿魏酸的含量较高。
3 结论
建立了啤酒中15种酚酸同时分离并定量的分析方法。使用Oasis HLB小柱对啤酒样品进行固相萃取处理,在优化的条件下可有效提取啤酒中的酚酸化合物,使用酸化水对固相萃取柱进行淋洗能有效去除啤酒中杂质对目标组分分离的影响。本研究同时对槲皮素和肉桂酸的确切定性进行了有效确认。方法有较好的精密度和回收率,同时具有法操作简便、重复性好等特点,适用于啤酒中酚酸含量的准确测定。至于啤酒酚酸与抗氧能力之间的相关性,则是下一步研究的目标。
致谢:本研究的实验及论文撰写得到了中国食品发酵研究院胡国栋教授和蔡心尧教授的大力帮助,在此表示感谢!
[1] Dvoˇráková M,Douanier M,Jurková M,et al.Comparison of antioxidant activity of barley and malt extracts with the content of free phenolic compounds measured by high performance liquid chromatography coupled with coularray detector[J].Journal of the Institute of Brewing,2008,114(2):150-159.
[2] ZHAO H,CHEN W,LU J,et al.Phenolic profiles and antioxidant activities of commercial beers[J].Food Chemistry,2010,119(3):1 150-1 158.
[3] Leitao C,Marchioni E,Bergaentzlé M,et al.Effects of processing steps on the phenolic content and antioxidant activity of beer[J].J Agric and Food Chem,2011,59(4):1 249-1 255.
[4] García A A,Grande B C,Gándara J S.Development of a rapid method based on solid-phase extraction and liquid chromatography with ultraviolet absorbance detection for the determination of polyphenols in alcohol-free beers[J].J Chromatography A,2004,1054(1/2):175-180.
[5] 刘群涛,李崎,武千均,等.反相高效液相色谱法测定啤酒中的酚酸[J].分析试验室,2006,25(12):68-72.
[6]DVOˇRÁKOVÁ M,HULÍN P,KARABÍN M,et al.Determination of polyphenols in beer by an effective method based on solid-phase extraction and high performance liquid chromatography with diode-array detection[J].Czech J Food Sci,2007,25(4):182-188.
