基于TTC染色法的高活力酵母细胞定量筛选*
2014-12-16徐俊雍晓雨费文斌周俊王舒雅陈怡露郑涛
徐俊,雍晓雨,费文斌,周俊,2,王舒雅,2,陈怡露,郑涛,2
1(南京工业大学生物与制药工程学院,江苏南京,211816)
2(南京工业大学 生物能源研究所,江苏南京,211816)
2,3,5-氯化三苯基四氮唑(TTC)是一种显色剂,能够对多种细胞(酵母,细菌,植物细胞等)发生呈色反应。TTC本身为无色,但能被活细胞中的呼吸链脱氢酶将无色的氧化态TTC还原为红色的TTF(Triphenyl formazan)[1]。TTF存在于细胞内,且不溶于水,经有机溶剂萃取,在一定波长下其吸光值的大小反映了细胞膜电子传递链递氢能力的大小。且细胞内TTC反应所呈现的红色的深浅反映了其生命活力的强弱,颜色越深表明其活力越强。由于TTC的上述特点,TTC染色法被广泛应用于种子、微生物细胞呼吸活性[2-4]等的检测,例如Ogur等用TTC筛选酵母的呼吸缺陷株[5];刘华等人利用TTC法测定红豆杉细胞活力[6];王跃华等人利用TTC法测定滇重楼细胞活力并优化测定条件[7];杨天佑等人利用TTC-脱氢酶测定法研究低温真空环境对细菌呼吸活性的影响[8]。TTC染色法也被应用于高产乙醇酵母的筛选[9-10]。在酵母细胞中,乙醇发酵的主要途径包括葡萄糖酵解和丙酮酸的无氧降解,在此过程中糖-乙醇转化酶起主要作用,TTC能对酵母的代谢产物产生显色反应,通过其颜色的深浅可以判断其胞内转化酶活力的大小,颜色越深表明其细胞活性越强,产乙醇能力也越强[11]。
现有的筛选高产乙醇酵母的方法还存在较多缺陷。第1是含有TTC培养基的平板制作复杂,接种酵母后生长比较缓慢,并且后续挑取颜色较深的酵母时,操作也比较繁琐,需时较长;第2是利用人眼观测通过TTC染色法的呈色反应后颜色的深浅来判断细胞活力从而预测酵母产乙醇能力的高低,由于待筛选细胞繁多,很容易产生疲劳和误差,影响细胞筛选的准确度和效率。本实验探索利用TTC染色法和96孔板培养酵母细胞,通过酶标仪在一定波长下检测,定量、快速、可靠地直接反应细胞活力,能够显著降低筛选时间及降低操作过程中的视觉判断产生的人为误差。
1 材料与方法
1.1 菌株
酵母菌株#1-#23(共23 株),J-10,J-19,J-27,OY-11(由本实验室保藏)。
1.2 培养基
YPD斜面培养基:1 L培养基含10 g酵母粉,20 g蛋白胨,20 g葡萄糖,20 g琼脂粉。
YPD液体培养基:1 L培养基含10 g酵母粉,20 g蛋白胨,20 g葡萄糖。
1.3 酵母细胞活力检测方法的建立
1.3.1 有机溶剂选择
根据实验设计,需选择价格低廉、萃取效果好、毒性较低、并且对细胞培养板无腐蚀性的有机溶剂作为萃取剂。将培养好的酵母细胞菌液分别加入1 mL乙酸乙酯、甲醇、丙酮、二甲基亚砜,振荡后离心,取200 μL上清液加入酶标板中,用酶标仪检测其TTF吸收值。
1.3.2 有机溶剂最佳浓度的选择
取1 mL在含有TTC的培养液中培养好的酵母细胞菌液10 000 r/min离心1 min后弃上清液,加入1 mL不同体积分数的二甲基亚砜溶液(100%、95%、90%、85%、80%、75%、70%、65%),充分混匀后10 000 r/min离心1 min,取200 μL上清液加入酶标板中,用酶标仪检测其TTF吸收值。
1.3.3 TTF最大吸收波长的确定
取1 mL培养好的酵母细胞液,10 000 r/min离心1 min后弃上清液。加入1 mL体积分数为85%的二甲基亚砜溶液,振荡后离心机10 000 r/min离心1 min,取200 μL上清液加入酶标板中,用酶标仪进行全波长扫描,检测TTF吸收值,检测波长范围为200~1 000 nm,步长为1 nm。
1.3.4 TTF 标准曲线的绘制[7,12]
分别取 1 mL 0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1 g/L的TTC溶液加入10 mL离心管中,加入2 mL pH8.4 Tris-HCl和1 mL 10 g/L的Na2S2O4溶液,37℃水浴振荡5 min(以上步骤均在暗处操作),使得TTC完全还原为TTF。将上述反应液10 000 r/min离心10 min后弃上清液,加入5 mL体积分数为85%的二甲基亚砜溶液并充分混匀,于486 nm处测吸光值,并以此为纵坐标,以TTC浓度作为横坐标绘制标准曲线,绘制得到的标准曲线。
1.3.5 培养体系中TTC浓度的确定
设置YPD培养基中TTC质量浓度分别为0.1、0.2、0.4、0.6、0.8、1.0 g/L。将培养好的酵母种子液按10%的接种量分别接入含有以上TTC浓度的YPD培养基中,200 r/min 30℃培养12 h。分别取1 mL培养好的菌液,10 000 r/min离心1 min后弃上清液,再分别加入1 mL二甲基亚砜溶液,充分混匀后10 000 r/min离心1 min,取200 μL上清液加入酶标板中,用酶标仪检测其TTF吸收值。
1.3.6 培养液pH的确定
设置YPD培养基中pH分别为1~14,将培养好的酵母种子液按10%的接种量分别接入以上pH的YPD培养基中,200 r/min 30℃培养12 h。分别取1 mL菌液10 000 r/min离心1min,弃上清液,再分别加入1 mL二甲基亚砜溶液,充分混匀后10 000 r/min离心1 min,取200 μL上清液加入酶标板中,用酶标仪检测其TTF吸收值。
1.3.7 待检测酵母细胞培养
取100 μL待检测酵母细胞菌液涂布于YPD固体平板培养基上,30℃培养48 h后挑取单菌落转移至96孔细胞培养板。96孔细胞培养板中加入150 μL的YPD培养液,并设置最终体积分数为0、10%、14%的乙醇,30℃ 200 r/min培养4 h后,测定其OD600值。将上述酵母细胞培养液4 000 r/min离心5 min后弃上清液,在96孔细胞培养板各孔中加入150 μL体积分数为85%的二甲基亚砜溶液,振荡15 s后4 000 r/min离心5 min待测。添加不同体积分数的乙醇,是为了检测在不同乙醇体积分数下待测菌株的细胞活力,这样既可以用该方法检测同一株菌在有无乙醇及乙醇体积分数高或低的处理下细胞活力,还可以检测并比较不同菌株在同一乙醇体积分数下的活力,以此选择耐乙醇的菌株。
1.3.8 TTF值的测定
吸取100 μL上述细胞培养板中振荡离心后的上清液到96孔酶标板中,在486 nm下测定TTF吸收值,根据TTF标准曲线及步骤1.3.2中测定的细胞OD600值,计算细胞内TTF含量,计算公式为:TTF含量=实验测得TTF吸收值×(1/细胞OD600吸收值),以所得到的在标准曲线线性范围内的TTF值确定细胞呼吸力即细胞活力大小。TTF含量越高,表明细胞活力越强。
1.3.9 各菌株乙醇产量的测定
使用气相色谱内标法测定各株菌株的乙醇产量。选用SGE 30QC2/AC20-0.25毛细管柱,柱箱温度60℃,进样器温度190℃,检测器温度240℃,内标物为正丙醇,检测液为6%正丙醇溶液与被测样品混合液,检测液配置方法:取0.5 mL 6%正丙醇溶液和0.5 mL被测样品加入10mL容量瓶,加水定容至10 mL,测定时检测液进样量为2 μL。通过气相色谱内标法测定各株菌的乙醇产量后,通过各株菌对应的胞内TTF值,确定TTF值与乙醇产量的关系,最后筛选出具有较强活力的菌株。
2 结果与讨论
2.1 检测方法中实验参数的确定
2.1.1 有机溶剂选择
表1为二甲基亚砜等所选4种有机溶剂的胞内TTF提取效果比较。首先所选用的有机溶剂必须能够最大程度地提取出胞内所形成的TTF结晶。由表1可知,用二甲基亚砜提取TTF结晶时,其上清液中TTF吸收值达到1.127,分别为使用甲醇、乙醇、乙酸乙酯时的1.19、1.55、1.80倍,在3种有机溶剂中效果最好。同时,考虑到有机溶剂对于96孔酶标板的腐蚀性,会对实验结果产生影响。相比于其他3种有机溶剂,二甲基亚砜对96孔酶标板无腐蚀性,在酶标仪检测时,所测实验数据真实可信。而且,二甲基亚砜价格较低,相比于其他几种有机溶剂毒性较低。经综合考虑,本实验选用二甲基亚砜作为TTF提取剂。

表1 有机溶剂提取胞内TTF效果比较Table 1 Comparison of intracellular TTF extracted by organic solvent
2.1.2 有机溶剂最佳浓度的选择
二甲基亚砜最佳浓度的选择结果见表2。由表2可知,体积分数为100% ~85%的二甲基亚砜提取TTF结晶,上清液TTF吸收值都达到1.15左右,效果基本相当。当体积分数为80%时,吸收值为1.109,有一定程度的下降。当体积分数低于80%时,TTF吸收值有很明显的下降,且随二甲基亚砜浓度的降低而降低,故实验中选用体积分数为85%的二甲基亚砜溶液。
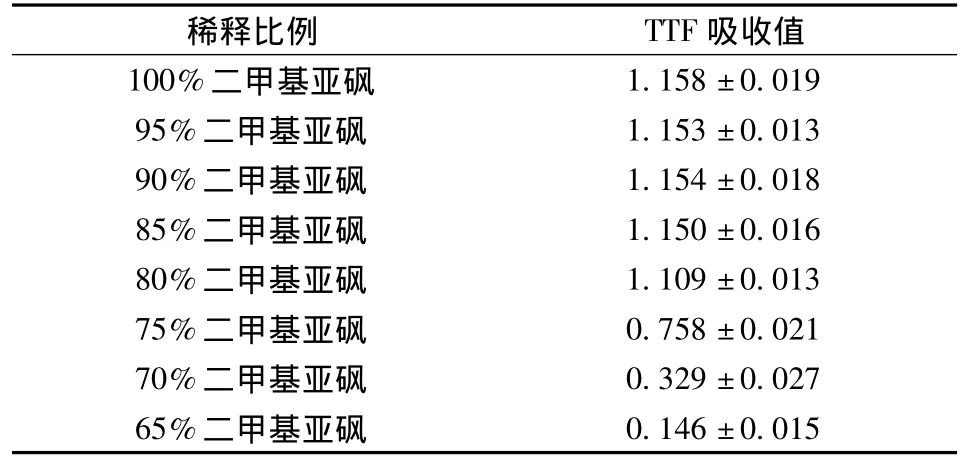
表2 不同稀释比例二甲基亚砜提取效果比较Table 2 Comparison of the extraction effect of different dilution ratio dimethyl sulfoxide
2.1.3 TTF最大吸收波长的确定
全波长扫描图谱见图1。由图1可知,在486 nm处TTF有一明显的吸收峰,故本实验选用486 nm作为TTF吸收峰的检测波长。
2.1.4 TTF标准曲线的绘制
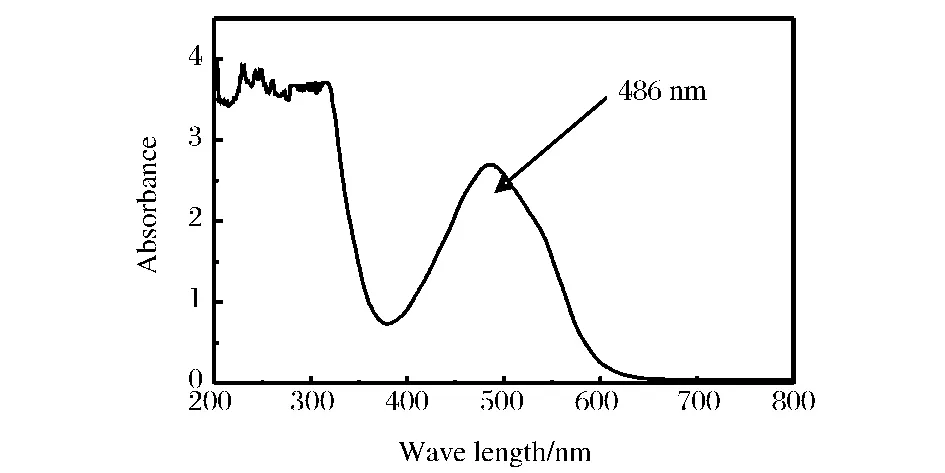
图1 TTF的全波长扫描Fig.1 Absorbance spectrum of TTF
按照1.3.1章节所述准备标准曲线制作的反应液,并以混合液于486 nm处吸光值为纵坐标,TTC浓度为横坐标绘制标准曲线,得到标准曲线方程为Y=-0.000 9+14.72X,R2=0.995 6。当 TTC浓度在0.01% ~0.06%时,OD值在0.15~0.88,两者呈较好的线性关系,可以用于定量测定。当OD值低于0.15或者高于0.88时,即认为超出可信区间,在此基础上测得的值认为不可取。标准曲线是为了检测细胞生成的TTF值落在一个可信的区间内,不在这个区间的认为这个值不可信。
2.1.5 培养体系中TTC浓度的确定
由图2可知,在TTC浓度为0.4%时所测的TTF的吸收值最高,超过这一浓度后TTF吸收值下降。这是由于TTC本身具有一定的毒性,过高的TTC浓度本身对细胞活性有一定的影响,溶液中积累TTC浓度越高,对细胞活性影响越大,细胞生长越慢,即细胞OD值越低。0.05% ~0.2%时测得的TTF吸收值偏低,原因可能是由于溶液中TTC的含量太少,不足以测得培养液中所有酵母群体的活性。因此,本实验选定反应体系中的TTC浓度为0.4%。
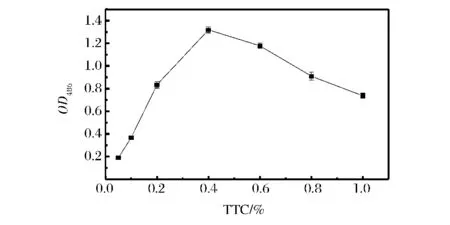
图2 TTC浓度对酵母细胞生长的影响Fig.2 Effect of TTC concentration on the yeast culture
2.1.6 培养液pH的确定
由图3可知,反应液的pH <6时,测得的TTF吸收值很小,当反应液的pH在8~9时,所测得TTF吸收值较大,其中在pH为8时测得TTF吸收值最大。当pH >10时,所测得吸收值很小。其原因有:当pH值较低时,由于细胞处于较为不适的生长pH环境,所以生长较为缓慢,测得的细胞OD值也较低。当pH在中性微偏碱环境下时,酵母细胞处于较为适应的生长环境,其生长较快,且有最大活性,因此,测得细胞OD值也较高。当pH值超过10时,碱性环境不利于细胞生长,随pH值降低,生长速度减慢,其细胞OD值也较低。故实验中反应体系的pH值应控制在pH 8左右。
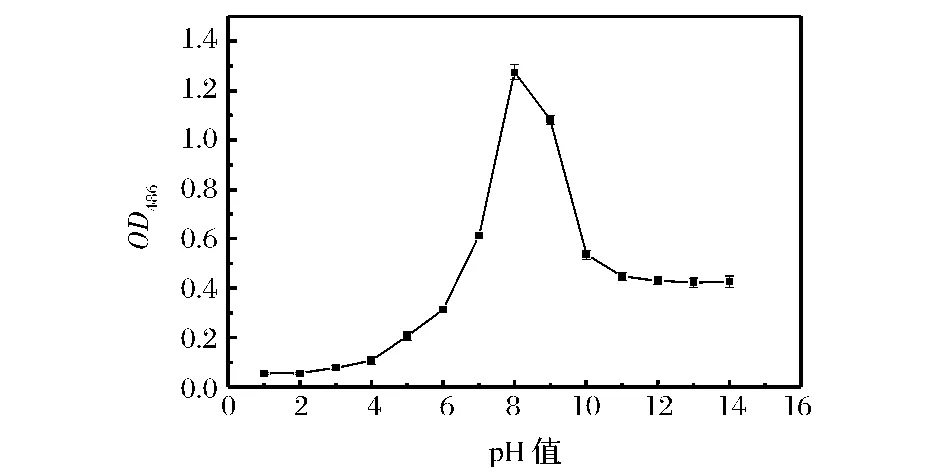
图3 培养液pH对酵母活性的影响Fig.3 Effect of pH on the activity of yeast
2.2 酵母活性及乙醇产量检测
根据1.3建立的检测方法以及乙醇产量检测方法,从本实验室保藏的27株菌株中筛选出具有较强活力的6株菌株,按细胞活力强弱依次排列为#5,#1,#8,OY-11,#7,#6,实验结果见表 3。
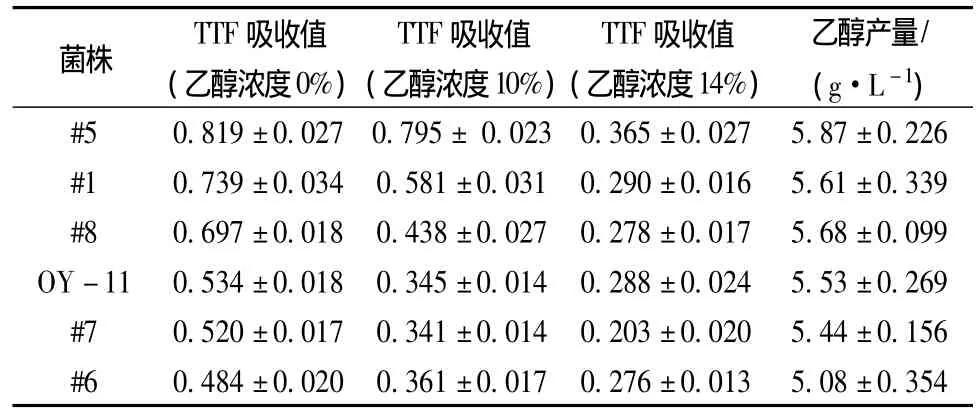
表3 酵母菌株活性及乙醇产量情况Table 3 Cell activity and ethanol yield of yeast strains
从表3中可以看出:在乙醇体积分数为0%,10%,14%时,菌株#5 TTF吸收值均为最高,分别达到0.819、0.795、0.365。菌株#5相比于其他5株菌,在有无乙醇压力情况下都具有较为明显的优势,可见其活性在测试的所有菌株中最强,其他菌株按活性强弱依次为#1,#8,OY-11,#7,#6。同时测定菌株乙醇产量,菌株#5的乙醇产量也为最高,达到5.87 g/L,其他菌株按乙醇产量高低依次为#8,#1,OY-11,#7,#6。乙醇发酵过程中糖-乙醇转化酶起主要作用,TTC能对酵母的代谢产物产生显色反应,通过其颜色的深浅可以判断其胞内转化酶活力的大小。颜色越深,表明TTC在酵母胞内转化为TTF结晶含量越高,既TTF吸收值较高,同时也可表明其胞内转化酶活性越强,细胞活性也越强,而转化酶活力的强弱与乙醇产量有关。酶活越高,产乙醇能力也越强。菌株#5在乙醇压力为0%,10%,14%时都具有最高的TTF吸收值,也就表明其胞内转化酶活性在所有菌株中最强,乙醇产量也最高,通过表3中乙醇产量可以看出,#5菌株比其他菌株高出5%左右。通过分析其他菌株的TTF吸收值与乙醇产量可以看出,TTF值下降,细胞活性降低,乙醇产量也有一定程度下降。由此得出,菌株的细胞活力与乙醇产量在一定程度上是成正相关的。
相比于原有研究中,王跃华等人报道TTC-脱氢酶还原法能够检测滇重楼地下茎的细胞活力,其目标为检测细胞活性,而本研究所发明的TTC染色法用于酵母菌细胞活性的测定,使用96孔板及酶标仪快速检测多株酵母,且最终目标定位于能够通过比较TTF生成量与乙醇产量关系来筛选高产乙醇酵母菌株,同时,本研究所建立的方法中,TTC工作浓度仅为0.4%,仅为前人报道的1/2,因此,本方法具有准确、高效、操作简单、经济性等特点。
3 结论
(1)本实验选用体积分数为85%二甲基亚砜作为TTF最佳提取剂,培养液中TTC浓度为0.4%,溶液pH8,TTF最大吸收波长为486 nm。通过检测待测菌株在上述条件下培养后所测得的TTF吸收值,以及细胞OD值,可以通过公式TTF含量=实验测得TTF吸收值×(1/细胞OD600吸收值),计算出细胞内实际TTF值,以所得到的在标准曲线线性范围内的TTF值确定细胞呼吸力即细胞活力大小。同时,测定待测菌株所对应的乙醇产量,可以得到细胞呼吸活力与乙醇产量的关系,即酵母呼吸活力与其乙醇产量在一定程度上呈正相关。
(2)本实验所建立的基于TTC染色法的高活力酵母细胞定量筛选方法,相比于原有一些对于利用TTC染色法筛选酵母的研究中虽利用96孔板但没有明显减少实验时间,以及在利用96孔板仅仅是对细胞群体密度的定量等相比,本方法具有准确性、高效性、操作简单、经济性等特点。
(3)本实验所建立的方法可应用于高活性、高产乙醇酵母的筛选,也可用于其他微生物及植物细胞的活性检测,为快速、大量检测细胞活性提供一条新途径。
[1] Rich P R,Mischis L A,Purton S,et al.The sites of interaction of triphenyltetrazolium chloride with mitochondrial respiratory chains[J].FEMS Microbiol Lett,2001,202:181-187.
[2] 韩晓云,姜安玺,贲岳,等.低温生物膜中微生物脱氢酶活性分析[J].沈阳建筑大学学报(自然科学版),2006,22(5):817-820.
[3] 尹军,谭学军,任南琪.用TTC与INT-电子传递体系活性表征重金属对污泥活性的影响[J].环境科学,2005,26(1):56-62.
[4] Vallieres C.A rapid in vivo colorimetric library screen for inhibitors of microbial respiration[J].ACS Chem Biol,2012,7(10):1 659-1 665.
[5] Ogur M,St John R,Nagai S.Tetrazolium overlay technique for population studies of respiratory deficient yeast[J].Science,1957,125:928-929.
[6] 刘华,梅兴国.TTC法测定红豆杉细胞活力[J].植物生理学通讯,2001,37(6):336-339.
[7] 王跃华,刘益丽,马良良,等.TTC-脱氢酶还原法测定滇重楼细胞活力优化条件筛选[J].成都大学学报(自然科学版),2011,30(1):1-3.
[8] 杨天佑,田静等.TTC-脱氢酶测定法表征低温真空环境对细菌呼吸活性的影响[J].食品与机械,2008,24(6):32-35.
[9] 董博宇,陈叶福,岳瑞雪,等.TTC在发酵木糖高产乙醇的休哈塔假丝酵母选育中的应用[J].酿酒科技,2008,10:40-43.
[10] 胡晓冰,王振伟.TTC法在筛选西瓜果酒酵母中的应用[J].酿酒科技,2011(2):69-70.
[11] 王梅,张彭湃,帅桂兰,等.TTC在黄酒酵母选育中的应用[J]. 酿酒,2001,28(5):62-64.
[12] 赵连梅,池勇志,张春青.TTC-脱氢酶活性测定中标准曲线的影响因素研究[J].实验室科学,2009(4):72-74.
