苏丹红Ⅰ在活化玻碳电极上的电化学行为研究及其应用*
2014-12-16马心英陈美凤晁明永
马心英,陈美凤,晁明永
(菏泽学院化学化工系,山东菏泽,274015)
苏丹红Ⅰ是一种化学染色剂,被广泛用于溶剂、油、蜡、汽油的增色以及鞋、地板等增光方面。研究表明食用苏丹红Ⅰ能引起膀胱癌和肝癌,世界卫生组织将其定为第三类致癌物质,多数国家禁止其用于食品[1]。但一些生产商为提高经济利益仍将其作为添加剂,用于辣椒油、番茄酱、腐乳、调料等食品中,以增加其颜色色泽。食品添加剂,特别是人工色素的使用安全问题越来越受到人们的关注,因此建立快速、灵敏检测食品中苏丹红的方法对人体健康安全具有重要意义。目前,用于苏丹红Ⅰ测定的方法主要有高效液相色谱法[2,3]、薄层色谱法[4],分光光度法[5],质谱法[6],化学发光法[7],毛细管电泳[8]、分子印迹法[9]和电化学方法[10-12]等。色谱法仪器昂贵,样品处理复杂,而分光光度法则易受染色剂在比色皿吸附的干扰。电化学方法具有简单、快速等优点,其中化学修饰电极法近年来发展十分迅速[13-15],修饰材料由单一向多元化方向发展,制备方法也日趋复杂化,修饰材料的选择及制备方法决定着实验结果的灵敏度、选择性及稳定性[16-22]。活化玻碳电极与修饰电极相比,制备过程更为简单,所用试剂更为廉价,而且显示出良好的稳定性与灵敏性。活化玻碳电极的制备有不同途径,如Khoo在pH 7.0磷酸盐缓冲溶液中,通过控制较高的氧化正电位得到活化玻碳电极并用于测定生物分子[23];Abraham John在硫酸溶液中制备了活化玻碳电极,用于尿酸及抗坏血酸的测定[24]。本文在硫酸溶液中优化实验条件制备了活化玻碳电极,探讨了苏丹红Ⅰ在该电极上的电化学行为,并用于食品中苏丹红的检测,该方法简单、快速,具有较宽的线性范围和较高的灵敏性,有较好的应用前景。
1 材料与方法
1.1 材料与仪器
苏丹红Ⅰ,天津市化学试剂研究所,溶于无水乙醇配成 1.00×10-2mol/L储备液;0.5 mol/L 的H2SO4溶液;Na2HPO4-C6H8O7·H2O配制成磷酸盐缓冲溶液(PBS,pH 2.2 ~8.0)。试剂均为分析纯,实验用水均为二次石英亚沸蒸馏水。
CHI660e型电化学分析系统,上海辰华公司;KH-100DB型超声波清洗器,昆山禾创有限公司;电化学实验用三电极系统,玻碳电极(GCE)或活化玻碳电极(AGCE)为工作电极,Ag/AgCl电极为参比电极,铂丝电极为对电极。
1.2 样品制备
分别称取2.500 g辣椒油和3.000 g番茄酱于磨口瓶中,用无水乙醇超声萃取3次(每次20 mL,萃取时间20 min)萃取液过滤后合并,用无水乙醇定容至100 mL容量瓶中,低温保存备用。
1.3 活化玻碳电极的制备
将玻碳电极(Φ=3.8 mm)在湿润的金相砂纸(粒度为2000)上磨光,然后用中性氧化铝(0.05 μm)悬乳液抛光成镜面,然后依次用HNO3(1∶1)、无水乙醇、蒸馏水超声波清洗,红外灯下烘干。以玻碳电极为工作电极,Ag/AgCl电极为参比电极,铂丝电极为对电极,在-1.30~2.40V电位范围内,160 mV/s扫描速率在0.5 mol/L溶液中循环扫描8周,取出电极用亚沸水淋洗电极表面,晾干,即制得硫酸活化玻碳电极。
1.4 实验方法
1.4.1 干扰试验的测定方法
在pH=4.0 的 PBS中,在浓度为 1.00 ×10-5mol/L苏丹红Ⅰ溶液中加入实验了一些体内常见物质进行测定,以活化玻碳电极做工作电极,以Ag/AgCl电极做参比电极,铂丝电极做对电极,搅拌60 s后,在-1.0~1.0 V 电位范围内,以100 mV/s扫描速率进行循环扫描,记录扫描曲线。
1.4.2 标准曲线、检测限的测定方法
在pH=4.0的PBS中,改变苏丹红Ⅰ溶液的浓度,以活化玻碳电极做工作电极,以Ag/AgCl电极做参比电极,铂丝电极做对电极,搅拌60 s后,在0~0.5 V电位范围内,用差分脉冲伏安法,分别进行扫描测定,记录差分脉冲曲线。
1.4.3 回收率的试验方法
每个样品取3个不同体积分别置于电解池中,分别按照标准曲线的测定方法进行测定,记录曲线,每个样品测定6次,然后加入已知浓度的标准苏丹红Ⅰ溶液,进行测定,记录曲线。根据工作曲线的线性方程计算出加入的标准苏丹红Ⅰ溶液的浓度数值,与已知加入浓度进行比较,计算出回收率。
2 结果和讨论
2.1 活化玻碳电极制备条件的优化
为使苏丹红Ⅰ在活化玻碳电极上得到最大电流响应信号,对活化玻碳电极制备条件进行了优化。分别改变了硫酸溶液浓度、活化高低电位、扫描速度、活化周数进行实验,结果表明,在0.5 mol/L H2SO4溶液中,-1.30~2.40 V 电位范围内,以 160 mV/s扫描速率循环扫描8周,所制备的活化玻碳电极对苏丹红Ⅰ响应电流最大。
2.2 苏丹红Ⅰ在活化玻碳电极上的电化学行为
图1为苏丹红Ⅰ在活化玻碳电极(a)和玻碳电极(b)上的循环伏安曲线。由图1可见,苏丹红Ⅰ在玻碳电极上电流响应微弱,而在活化玻碳电极上,氧化还原峰电流明显增加,氧化还原峰电位和电流值分别为:Epa=0.195 V,Epc=0.063 V,ΔE=0.132 V;ipa=-22.96μA,ipc=17.99 μA,ipa/ipc>1,表明苏丹红Ⅰ在活化电极上的电极反应为准可逆过程。
2.3 苏丹红Ⅰ测定条件的选择
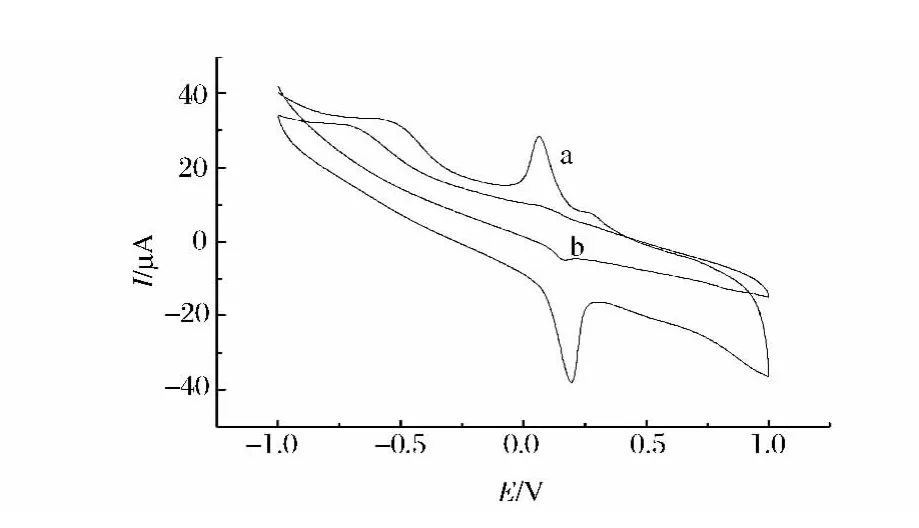
图1 1.00×10-5mol/L苏丹红Ⅰ号在活化玻碳电极(a),裸电极(b)上的CV曲线Fig.1 Cyclic voltammograms of 1.00 ×10-5mol/L Sudan I at activated glassy carbon electrode(a)and bare electrode(b),PBS(pH=4.0)scan rate:100m V/s
2.3.1 测定底液pH值的影响
在pH 2.2~8.0范围内,以磷酸盐缓冲溶液进行试验,实验发现随着pH值的升高,氧化峰和还原峰电位随pH的增大均负移,且氧化峰电位与pH呈线性关系,线性方程为 Epa=-0.059 pH+0.38,r=-0.998 0(见图2),说明苏丹红Ⅰ的氧化反应有质子参与,斜率为 59.0 mV/pH,接近 56 mV/pH,因此苏丹红Ⅰ电极反应过程质子转移数等于电子转移数[25]。在 pH 2.2 ~8.0 内,随着 pH 值的增大,其氧化峰和还原峰电流均先增大后减小。在pH=4.0的时,峰电流达到最大值。因此,选择测定底液最佳pH值为 4.0。
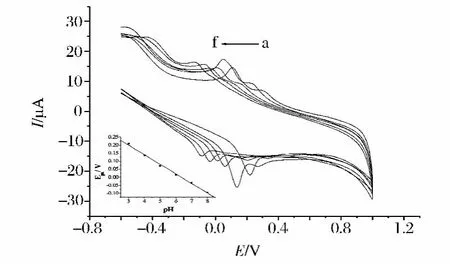
图2 1.00×10-5mol/L苏丹红Ⅰ号在活化玻碳电极上的上随pH变化的CV曲线图内插图为氧化峰电位与溶液pH线性关系图Fig.2 Cyclic voltammograms of 1.00 ×10-5mol/L Sudan I at different pH values;Scan rate 100m V/s pH from a to f:3.0;4.0;5.0;6.0;7.0;8.0 Inset is the plot of the peak potential of Sudan I versus pH value of buffer solutions.
2.3.2 搅拌时间的影响
搅拌时间不同苏丹红Ⅰ在修饰电极表面吸附的程度不同。实验结果表明,随搅拌时间的增长,峰电流先增大后减小,60 s达到最大值,因此实验选择搅拌富集时间为60 s。
2.3.3 扫描速度的影响
在40~400 mV/s的扫描速率范围内考察了扫速对苏丹红Ⅰ电化学行为的影响,发现随着扫速的增大,峰电流不断增加,氧化还原峰电位差增大(图3)。氧化峰电流与扫速成正比,其回归方程为ipa(A)=-1.01 ×10-6+1.87 ×10-8ν,R=0.999 2,因此苏丹红Ⅰ在活化电极上的电极过程为吸附过程。
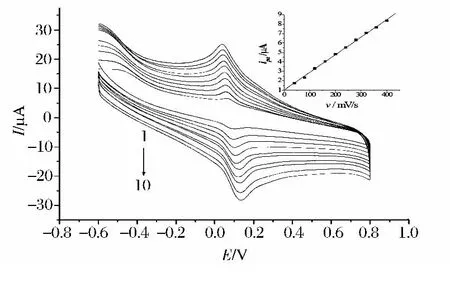
图3 1.00×10-5mol/L苏丹红Ⅰ在pH4.0磷酸盐缓冲溶液中不同扫速下的CV曲线。内插图为氧化峰电流与扫描速度的线性关系图Fig.3 Cyclic voltammetric curves of 1.00 × 10-5mol/L Sudan I at activated glassy carbon electrode at different scan rate.Inset is the plot of oxidation peak currents of Sudan I versus scan rates.Scan rate from 1 to 10:40,60,80,100,120,140,160,180,200,22,240,260,280,320,360,400mV/s
图4为苏丹I在活化玻碳电极的上氧化还原峰电位随变化的关系曲线。根据描述准可逆薄层电化学的 Laviron 理论[26]可知:
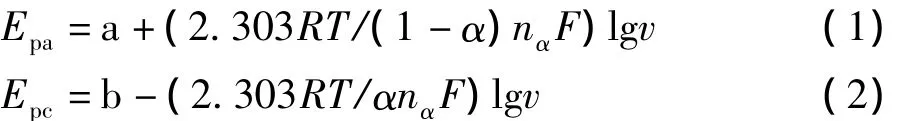
式中a、b为常数。由图4可知,在pH=4.0条件下,对于苏丹I氧化还原过程,扫速在240~400 mV/s,Epa=0.113lgv-0.155,R=0.996 9;Epc=-0.063 lgv+0.199,R=0.997 8。根据(1)、(2)可求出苏丹I氧化还原反应电子转移数nα=1.47≈2,电子传递系α=0.64,接近理论值0.5,符合准可逆特征。由于质子转移数等于电子转移数,因此苏丹红Ⅰ在活化玻碳电极上可能发生了如下反应:
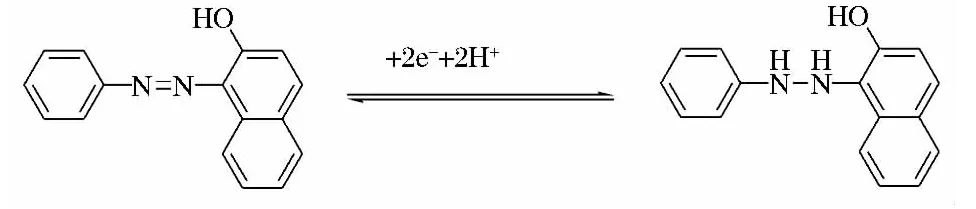
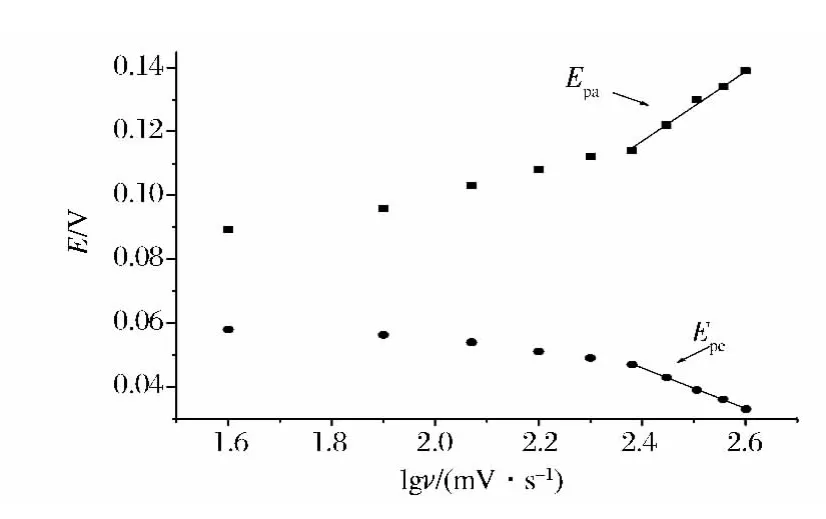
图4 氧化峰、还原峰电位与lgv的关系曲线,扫描速度分别为:40,80,120,160,200,240,280,320,360,400mV/s.Fig.4 Plots of the peak potentials versus the logarithms of the scan rates
2.4 工作曲线、检出限
在最佳条件下,用活化玻碳电极对苏丹红Ⅰ号进行测定,苏丹红Ⅰ号氧化峰电流与其浓度在4.0×10-8~1.0×10-5mol/L范围内呈现良好的线性关系(图 5),其回归方程为 ipa(A)=0.70 C+5.91 ×10-7,R=0.998 9。检出限为 9.0 ×10-9mol/L 。由表1可见,与其他修饰电极测定结果比较,本方法测定苏丹红Ⅰ号具有较宽的线性范围和较低的检出限,说明活化玻碳电极对苏丹红Ⅰ号具有较好的催化性能与灵敏性。
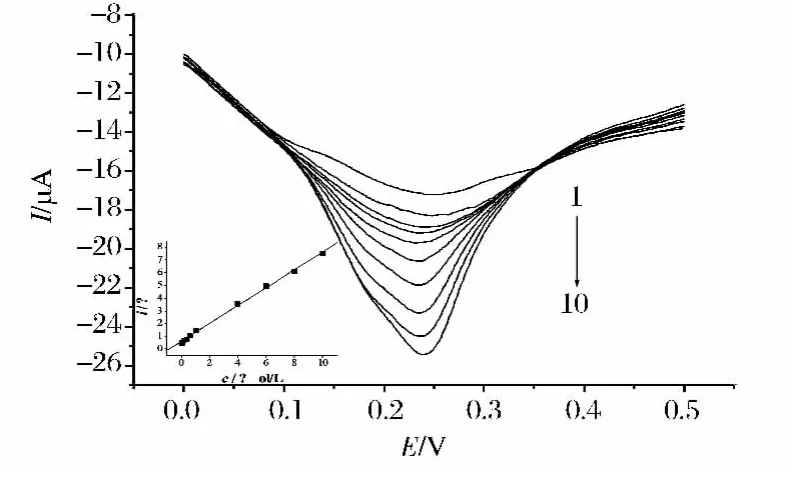
图5 在pH=4.00磷酸盐缓冲溶液中不同浓度的苏丹红Ⅰ在活化玻碳电极上差分脉冲伏安曲线。内插图为苏丹红Ⅰ氧化峰电流与其浓度变化关系曲线Fig.5 Differential pulse voltammograms of Sudan I at various concentrations at an activated glassy carbon electrode in pH 4.0 phosphate buffer solutions.Each of the numbers from 1 to 10 corresponds to a concentration of 4.0 × 10-8,8.0 × 10-8,2.0 × 10-7,4.0 × 10-7,6.0 × 10-7,1.0 ×10-6,4.0 × 10-6,6.0 × 10-6,8.0 × 10-6,1.0 × 10-5 mol/L.Inset is the plot of oxidation peak current of Sudan I versus its concentration;Scan rate 100mV/s
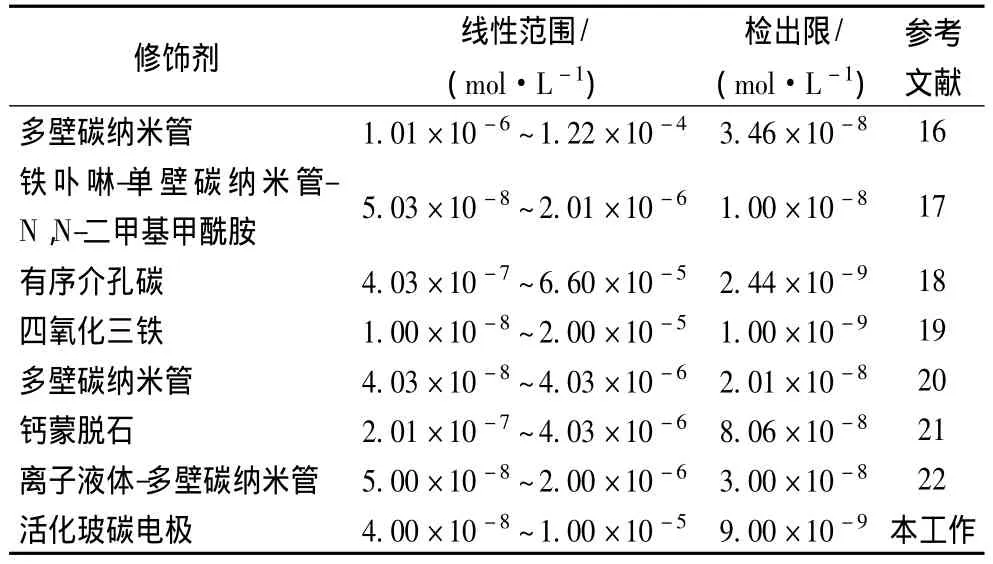
表1 活化玻碳电极与其它修饰电极性能比较Table 1 Comparison of the analytical performances of AGCE with that of other modified electrodes
2.5 干扰试验
对浓度为1.00×10-5mol/L苏丹红Ⅰ溶液进行测定,允许测定误差在+5%范围内,实验了一些体内常见的金属离子、阴离子、氨基酸对苏丹红Ⅰ的影响,结果表明,10 倍的 K+、Na+、Ca2+、NH4+、氨基丙酸、Cl-、葡萄糖、酒石酸对苏丹红Ⅰ的测定均不产生干扰;100倍的辣椒红色素在活化玻碳电极上无氧化还原峰存在,对样品测定无干扰;苏丹红ⅠI、III、IV号由于与苏丹红Ⅰ具有相似的结构,因此在活化玻碳电极上具有相似的电化学行为,若存在,可利用薄层色谱法分离[4]后,进行分别测定。
2.6 样品分析
取一定量的样品溶液,在最佳实验条件下进行测定,未观察到明显的氧化还原峰,说明样品中无苏丹红Ⅰ存在或其含量在检出限以下。按照同样的方法对等质量的原始样品进行不同浓度的苏丹红Ⅰ标准溶液加标回收实验,结果见表2。
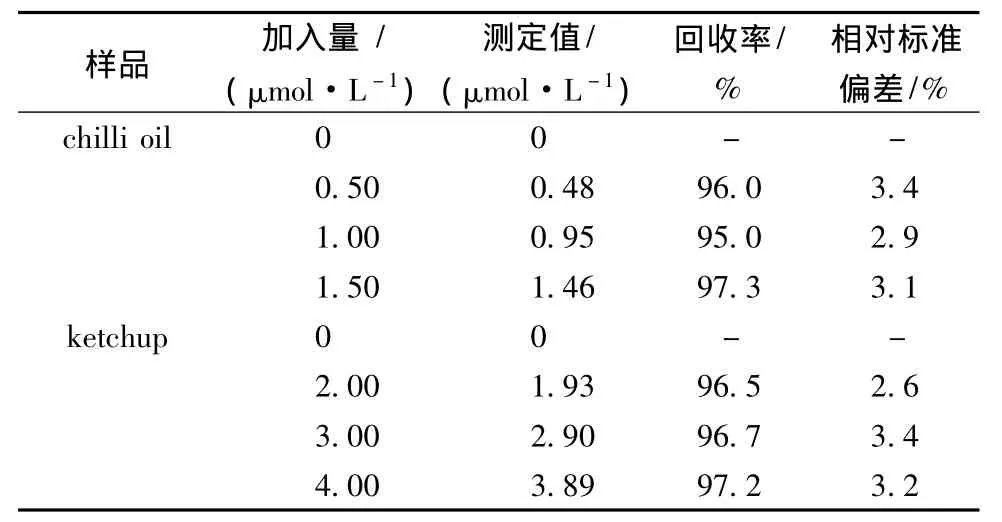
表2 辣椒油和番茄酱苏丹红Ⅰ检测结果Table 2 Determination results of Sudan I in chilli oil and ketchup samples(n=6)
3 结论
制备了活化玻碳电极,建立了差分脉冲伏安法测定辣椒油及番茄酱中的苏丹红Ⅰ的方法,此方法简单快速,检出限为9.0×10-9mol/L,加标回收率在95%-97.3%之间,实用性好,无毒,无污染,为检测食品中苏丹红Ⅰ提供了一种安全有效的新方法,易于推广应用。
[1]Stiborová M,Martínek V,Ry'dlová H,et al.Sudan I is a potential carcinogen for humans:evidence for its metabolic activation and detoxication by human recombinant cytochrome P450 1A1 and liver microsomes[J].Cancer Research,2002,62:5 678-5 684.
[2]Zhao C D,Zhao T,Liu X Y,et al.A novel molecularly imprinted polymer for simultaneous extraction and determination of Sudan dyes by on-line solid phase extraction and high performance liquid chromatography[J].Journal of Chromatography A,2010,1217:6 995-7 002.
[3] 喻凌寒,牟德海,李光宪,等.HPLC-DAD法测定辣椒及其制品中苏丹红的含量[J].光谱试验室,2004,11(6):31-33.
[4]丁长河,钱林.辣椒制品中苏丹色素的薄层色谱检测方法的研究[J].食品科学,2007,28(2):226-228.
[5]张玉采,钟燕,王文亭,等.薄层色谱分离分光光度法测定辣椒酱中苏丹红Ⅰ[J].现代食品科技.2007,23(2):84-86.
[6]Tateo F,Bononi M.Fast determination of Sudan I by HPLC/APCI-MS in hot chilli,spices,and oven-baked foods[J].Journal of Agricultural and Food Chemistry,2004,52:655-658.
[7]牛丽川,宋正华.流动注射化学发光法测定苏丹红Ⅰ[J].分析化学,2009,1:209-209.
[8]Mejia E,Ding Y,Mora M F,et al.Determination of banned Sudan dyes in chili powder by capillary electrophoresis[J].Food Chemistry,2007,102:1 027-1 033.
[9]Hu X G,Cai Q L,Fan Y N,et al.Molecularly imprinted polymer coated solid-phase micro extraction fibers for determination of Sudan I-IV dyes in hot chili powder and poultry feed samples[J].Journal of Chromatography A,2012,1219:39-46.
[10]瞿万云,杨春海,黄文胜.基于十二烷基苯磺酸钠增敏效应电化学方法检测苏丹红Ⅰ[J].应用化学,2009,9(26):1 065-1 068.
[11]张剑德,杜 丹.碳纳米管修饰的玻碳电极测定蕃茄制品中苏丹红[J].分析科学学报.2010,26(5):617-620.
[12]罗宿星,代小容,伍远辉,等.苏丹红Ⅰ在壳聚糖-氧化石墨烯自组装膜修饰玻碳电极上的电化学行为及其测定[J].分析测试学报,2012,31(12):1 562-1 566.
[13]贾莉,雷秋芬,张修华,等.邻氨基硫酚自组装膜修饰电极测定多巴胺[J].应用化学,2005,22(2):172-175.
[14]孙登明,马伟,吴云.聚L-异白氨酸修饰电极的制备及对多巴胺的测定[J].应用化学,2006,23(11):1 214-1 217.
[15] 韩晓霞,高作宁.DA和AA在CPB现场修饰碳糊电极上的电化学行为及电分析方法[J].应用化学,2007,24(7):770-773.
[16]Yang D X,Zhu L D,Jiang X Y.Electrochemical reaction mechanism and determination of Sudan I at a multi wall carbon nanotubes modified glassy carbon electrode[J].Journal of Electroanalytical Chemistry,2010,640(1/2):17-22.
[17]Wu Y H.Electrocatalysis and sensitive determination of Sudan I at the singlewalled carbon nanotubes and I ron(III)-porphyrin modified glassy carbon electrodes[J].Food Chem,,2010,121(2):580-584.
[18]Yang D X,Zhu L D,Jiang X Y,et al.Sensitive determination of Sudan I at an ordered mesoporous carbon modified glassy carbon electrode[J].Sensors and Actuators B:Chemical,2009,141(1):124-129.
[19]Yin H S,Zhou Y L,Meng X M,et al.Electrochemical behavior of Sudan I at Fe3O4nanoparticles modified glassy carbon electrode and its determination in food samples[J].Food Chemistry,2011,127(3):1 348-1 353.
[20]Gan T,Li K,Wu K B.Multi-wall carbon nanotube-based electrochemical sensor for sensitive determination of Sudan I[J].Sensors and Actuators B:Chemical,2008,132(1):134-139.
[21]Lin H G,Li G,Wu K B.Electrochemical determination of Sudan I dsing montmorillonite calcium modified carbon paste electrode[J].Food Chemistry,2008,107(1):531-536.
[22]Mo Z R,Zhang Y F,Zhao F G,et al.Sensitive voltammetric determination of Sudan I in food samples by using gemini surfactant-ionic liquid-multiwalled carbon nanotube composite film modified glassy carbon electrodes[J].Food Chemistry,2010,121(1):233-237.
[23]Premkumar J,Khoo S B.Electrocatalytic oxidations of biological molecules(ascorbic and uric acids)at highly oxidized electrodes[J].Journal of Electroanalytical Chemistry,2005,576(1):105-112.
[24]John S A.Simultaneous determination of uric acid and ascorbic acid using glass carbon electrodes in acetate buffer solution [J].Journal of Electroanalytical Chemistry,2005,579(2):249-256.
[25]Amare M,Admassie S.Differential pulse voltammetric determination of theophylline at poly (4-amino-3hydroxynaphthalene sulfonic acid)modified glassy carbon electrode[J].Bulletin of the Chemical Society of Ethiopia,2012,26(1):73-84.
[26]Laviron E.General expression of the linear potential sweep voltammogram in the case of diffusionless electrochemical systems[J].Journal of Electroanalytical Chemistry and Interfacial Electrochemistry,1979,101:19-28.
