表面活性剂辅助酶法提取黄芪黄酮的工艺优化
2014-12-16谢蓝华张嘉怡林凤英杨公明
王 超,杜 冰,谢蓝华,张嘉怡,林凤英,杨公明
(华南农业大学食品学院,广东广州510642)
黄芪是豆科植物蒙古黄芪或膜荚黄芪的根[1]。黄芪的主要生理活性物质有多糖、类黄酮、皂苷三大类[2],黄酮类化合物具有抗氧化、抗肿瘤、延缓衰老及降血糖、降血压、降血脂、抗炎镇痛等作用[3-4],因而受到国内外的广泛关注。目前,黄芪黄酮类化合物的主要提取方法有:超声提取法[5]、有机溶剂提取法[6]、纤维素酶提取法[7]、闪式提取法[8]等,应用最为广泛的是有机溶剂提取法,由于植物类黄酮存在于细胞内,常规的乙醇提取法无法使细胞壁完全破裂,类黄酮的溶出存在较大阻力,造成得率低和提取成本较高。
近年来,国内外已有利用表面活性剂的增溶作用协同提取天然产物活性成分的研究,该法通常是以溶有少量表面活性剂的水替代高质量分数的醇或其他有机溶剂进行活性成分的提取,能大大降低提取成本,并提高得率[9-10]。此外,表面活性剂对木质素具有吸附作用,可以阻止纤维素酶与木质素的无效结合[11],对纤维素酶具有稳定效应,在水解过程中可有效阻止纤维素酶的变性[12],从而提高纤维素酶的水解效率。
本文在常规的乙醇提取法之前,对黄芪进行表面活性剂辅助酶预处理,在单因素实验的基础上,采用Box-Behnken的中心组合实验,并且利用Design-Expert8.0软件进行响应面优化分析,确定黄芪黄酮的最佳提取工艺参数,以期为黄芪深加工提供依据。
1 材料与方法
1.1 材料与仪器
蒙古黄芪药材 内蒙古乌兰察布市广一中药材种植有限公司提供;纤维素酶(酶活力≥6200IU/g)广州柏棠贸易有限公司;芦丁标准品 Sigma公司;亚硝酸钠、硝酸铝、氢氧化钠、乙醇、冰醋酸、无水乙酸钠、十二烷基硫酸钠(SDS)、溴化十六烷基三甲胺(CTMAB)、吐温-80、吐温-20、十二烷基苯磺酸钠(LAS) 分析纯,广州化学试剂厂。
液氮粉碎机 华南农业大学食品学院中低温加工研究中心研制;JA-2003型电子分析天平 赛多利斯科学仪器有限公司;722E型紫外可见分光光度计 上海光谱仪器有限公司;101-1AB型电热鼓风干燥箱 天津太斯特仪器有限公司;电热恒温水浴锅 金坛市精达仪器制造厂;PHS-3C酸度计 上海理达仪器厂;HJ-3型恒温磁力搅拌器 巩义市英峪予华仪器厂;SHZ-Ⅲ型循环水真空抽虑机 上海亚荣生化仪器厂。
1.2 实验方法
1.2.1 芦丁标准曲线的制作 根据文献[13],将芦丁标准品于105℃干燥至恒重后,精密称取20mg用80%乙醇溶解,定容至100mL,得浓度为0.200mg/mL芦丁标准液。准确吸取芦丁标准液 0、1.0、2.0、3.0、4.0、5.0、6.0mL 于25mL 容量瓶中,加入5%NaNO2溶液0.3mL,摇匀放置 6min 后加入 10%Al(NO3)3溶液0.3mL,摇匀放置 6min后加入 4%NaOH溶液4mL,用80%乙醇溶液定容,摇匀,10min后用1cm比色皿于510nm测定吸光度A。
1.2.2 总黄酮含量的测定 按照测定芦丁标准液吸光度的步骤测定吸光度X,计算黄芪黄酮的含量,重复3次,取平均值。黄芪黄酮得率按下列公式计算。
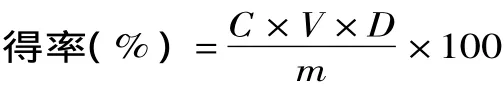
式中:C为由标准曲线计算得出的样品的黄酮浓度,mg/mL;V为样品溶液的体积,mL;D为样品的总稀释倍数;m为样品的质量,mg。
1.2.3 黄芪黄酮提取工艺 黄芪烘干、经液氮粉碎机粉碎后过60目筛。准确称取黄芪干粉5.000g,在pH4.0,温度50℃的条件下经不同表面活性剂、一定质量的纤维素酶处理1h,升温灭酶;抽滤,蒸发浓缩得滤液A,滤渣加一定浓度的乙醇溶液30mL并调pH至7,一定温度下提取一段时间后,抽滤,蒸发浓缩得滤液B,滤渣用同浓度的乙醇溶液洗涤3次,得滤液C,合并滤液,用同浓度乙醇溶液定容至100mL。
1.2.4 单因素实验设计 在表面活性剂添加量0.2%、酶添加量 0.2%、乙醇浓度 80%、提取温度80℃、提取时间2h的条件下,考察表面活性剂十六烷基硫酸钠(SDS)、溴化十六烷基三甲胺(CTMAB)、十六烷基苯磺酸钠(LAS)、吐温-80、吐温-20对黄芪黄酮得率的影响;在溴化十六烷基三甲胺添加量0.2%、乙醇浓度80%、提取温度80℃、提取时间2h的条件下,考察酶添加量 0.1% 、0.2% 、0.3% 、0.4% 、0.5%对黄芪黄酮得率的影响;在溴化十六烷基三甲胺添加量0.2%、酶添加量0.2%、提取温度80℃、提取时间2h的条件下,考察乙醇浓度 50%、60%、70%、80%、90%对黄芪黄酮得率的影响;在溴化十六烷基三甲胺添加量0.2%、酶添加量0.2%、乙醇浓度80%、提取时间2h的条件下,考察提取温度50、60、70、80、90℃对黄芪黄酮得率的影响;在溴化十六烷基三甲胺添加量0.2%、酶添加量0.2%、乙醇浓度80%、提取温度80℃的条件下,考察提取时间0.5、1.0、1.5、2.0、2.5h 对黄芪黄酮得率的影响。
1.2.5 响应面分析与优化设计 根据单因素实验结果,对影响黄酮得率较为明显的提取温度(A)、乙醇浓度(B)、溴化十六烷基三甲胺添加量(C)三个因素,采用Box-Behnken中心组合实验,设计三因素三水平中心组合实验,利用Design-Expert8.0软件进行响应面分析,建立多元二次回归方程,确定黄芪黄酮的最佳提取工艺条件。
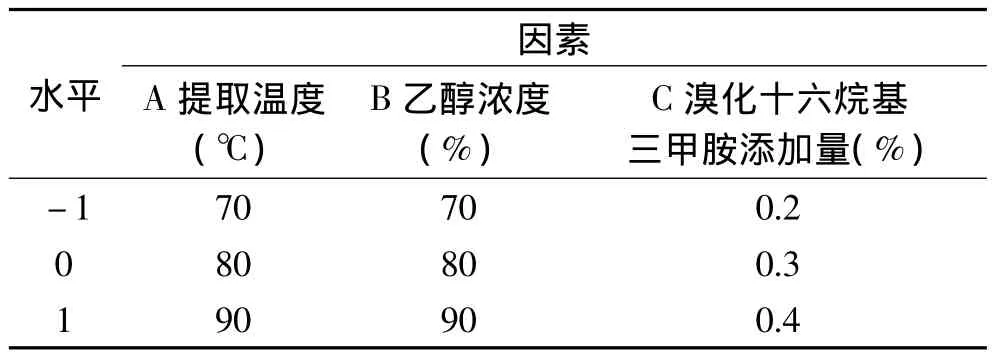
表1 三因素三水平中心组合实验因素水平编码表Table 1 Three factors and three levels of central composite experiment factor level table
2 结果与分析
2.1 单因素实验
2.1.1 标准曲线 按照 1.2.1 方法,得到芦丁浓度Y(mg/mL)与吸光度 X的回归方程:Y=8.645X-0.003,相关系数 R2=0.9993,芦丁浓度在 0~0.048mg/mL范围内,吸光度与芦丁浓度呈良好线性关系。
2.1.2 表面活性剂种类对黄酮得率的影响 由图1可知,表面活性剂种类对黄芪黄酮得率有明显影响,原因可能是不同表面活性剂对木质纤维素中的木质素的吸附作用力不同,阻止了酶与木质素的无效结合,或是在溶液中形成不同的分子聚合体改变了黄酮的溶解性,其中溴化十六烷基三甲胺添加量在黄芪黄酮的提取过程中所起促进作用最明显,因此,选择溴化十六烷基三甲胺进行下一步实验。
2.1.3 溴化十六烷基三甲胺添加量对黄酮得率的影响 由图2可知,随着溴化十六烷基三甲胺添加量的增加,黄酮得率随之提高。在溴化十六烷基三甲胺添加量0.1%~0.3%时黄酮得率增加较明显,随后变化趋于平缓。结果表明,随着溴化十六烷基三甲胺添加量增加,得率逐渐上升,并在0.4%~0.5%达到平衡,因此,选择溴化十六烷基三甲胺添加量为0.4% 为宜。
2.1.4 酶添加量对黄酮得率的影响 由图3可以看出,随着纤维素酶添加量的增加,黄酮得率略有上升。在酶添加量为0.2%时,黄酮得率达到较大值(3.981%),之后继续加大酶添加量,得率提高不显著,考虑提取成本问题,选择纤维素酶添加量0.2%为宜。
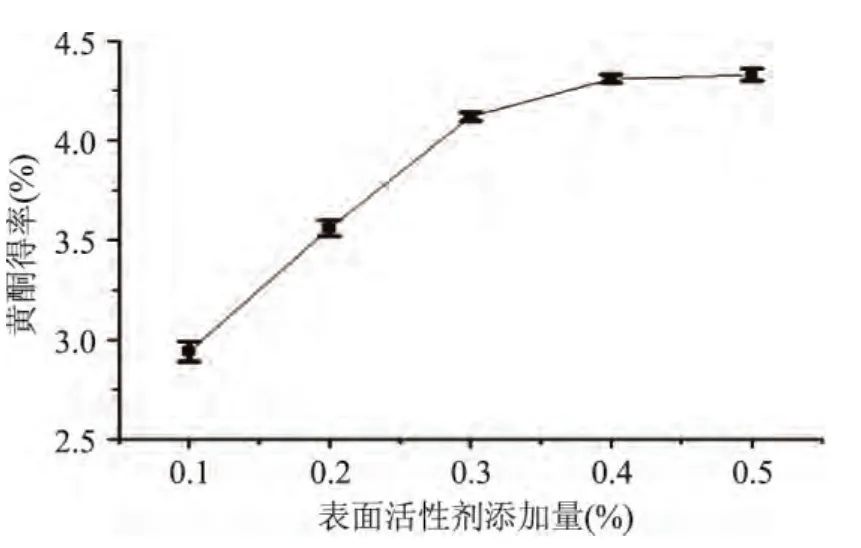
图2 溴化十六烷基三甲胺添加量对黄酮得率的影响Fig.2 Effects of surfactant addition on the yield of flavonoids
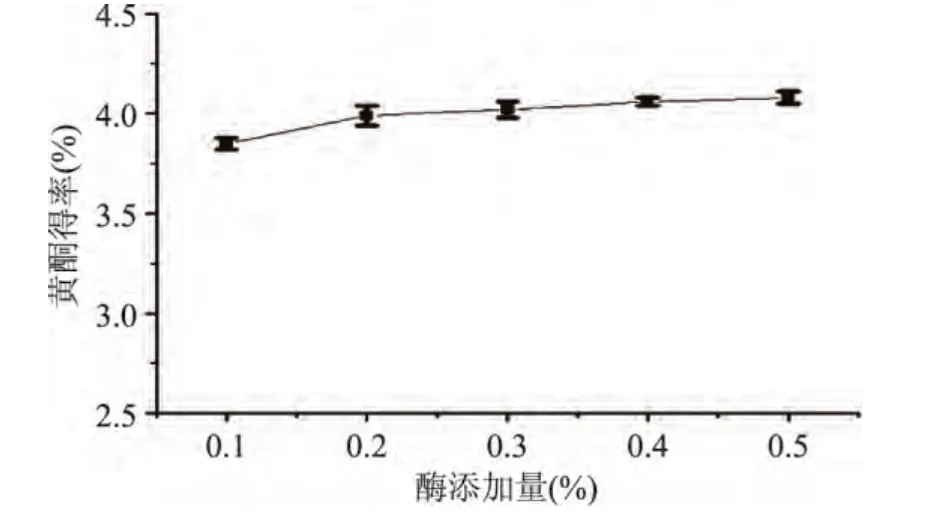
图3 酶添加量对黄酮得率的影响Fig.3 Effects of enzyme addition on the yield of flavonoids
2.1.5 提取温度对黄酮得率的影响 由图4可以看出,提取温度对黄芪黄酮得率有明显影响。在一定范围内,黄酮得率随提取温度的增大而先增加后降低。在提取温度为80℃时,黄酮得率达到最高值(4.127%),之后得率略有降低。原因可能是过高的温度使黄酮分解,从而使黄酮得率降低。因此,提取温度选取80℃为宜。
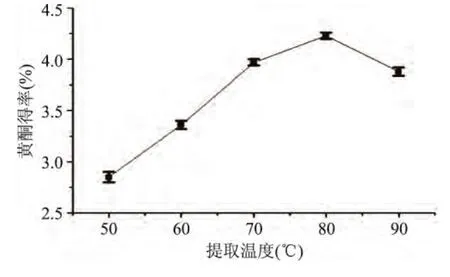
图4 提取温度对黄酮得率的影响Fig.4 Effect of extracting temperature on the yield of flavonoids
2.1.6 提取时间对黄酮得率的影响 由图5可以看出,提取时间对黄酮得率有明显影响,随着提取时间的延长,黄酮得率呈现逐渐上升的趋势,2h时黄酮得率达到最高点(4.172%)。提取的传质过程,需要一定时间才能达到平衡,时间太短,还未达到平衡,黄酮得率偏低;当传质过程达到基本平衡后,随着提取时间的延长,可能导致黄酮类物质热分解损失。因此,提取时间选择2h为宜。
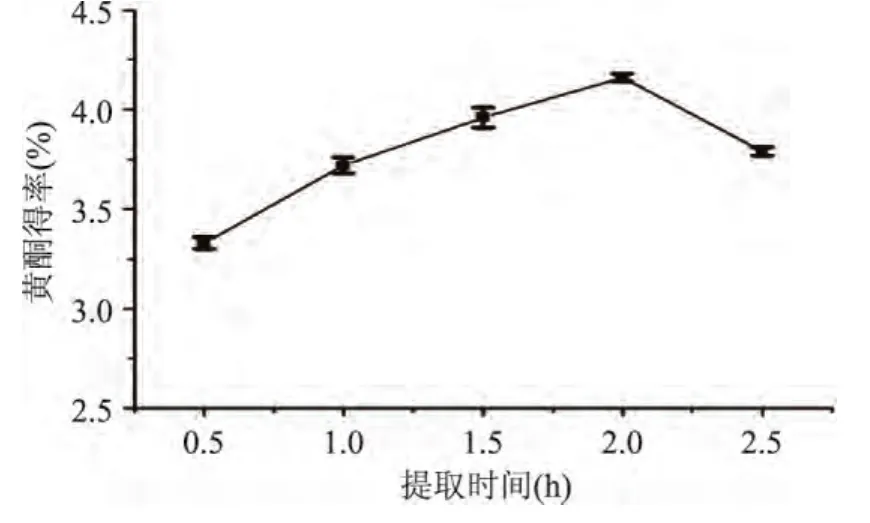
图5 提取时间对黄酮得率的影响Fig.5 Effect of extracting time on the yield of flavonoids
2.1.7 乙醇浓度对黄酮得率的影响 由图6可以看出,随着乙醇浓度的增大,黄芪黄酮得率逐渐升高,乙醇浓度为80%时,黄酮得率达最大,但当乙醇浓度超过80%时,得率有所下降,这说明乙醇浓度较低时不利于黄酮类物质的溶出,而乙醇浓度过大时,蛋白质,糖类等大分子会发生凝聚,阻塞内部组织的孔道,使黄酮类化合物扩散的阻力增加。因此确定乙醇溶液的适宜浓度为80%。
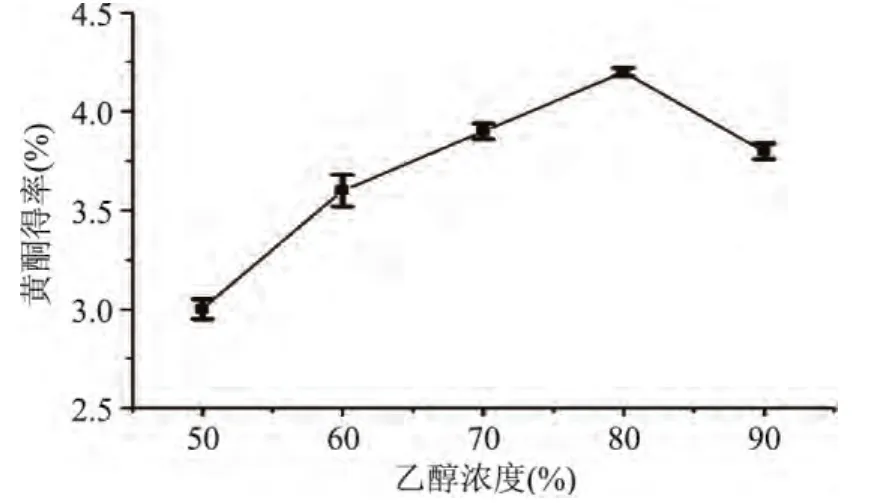
图6 乙醇浓度对黄酮得率的影响Fig.6 Effect of ethanol concentration on the yield of flavonoids
2.2 回归模型的建立与分析
根据单因素实验结果,利用Box-Behnken中心组合实验的设计原理[14],设计了乙醇浓度、提取温度、溴化十六烷基三甲胺添加量三因素三水平共15个实验点的响应分析实验。
利用Design-Expert8.0软件进行乙醇浓度、提取温度、溴化十六烷基三甲胺添加量三个因素对黄芪黄酮得率的回归分析,建立三元二次回归方程:
Y=4.26+0.08A+0.033B-5.00E-003C+0.08AB+0.13AC+0.095BC-0.19A2-0.29B2-0.21C2(R2=0.9779)
运用Design Expert8.0软件对15个实验点的响应值进行方差分析,见表3。
由表3可以看出,回归模型是极显著的(p=0.0001 <0.01),同时该模型具有较高的相关系数(R2=0.9779),拟合度大于97%。说明该模型能够反映响应值的变化,而且方程的失拟项很小,说明该方程对试验拟合情况好、误差小,因此可以用该回归方程代替试验真实点对试验结果进行分析和预测。
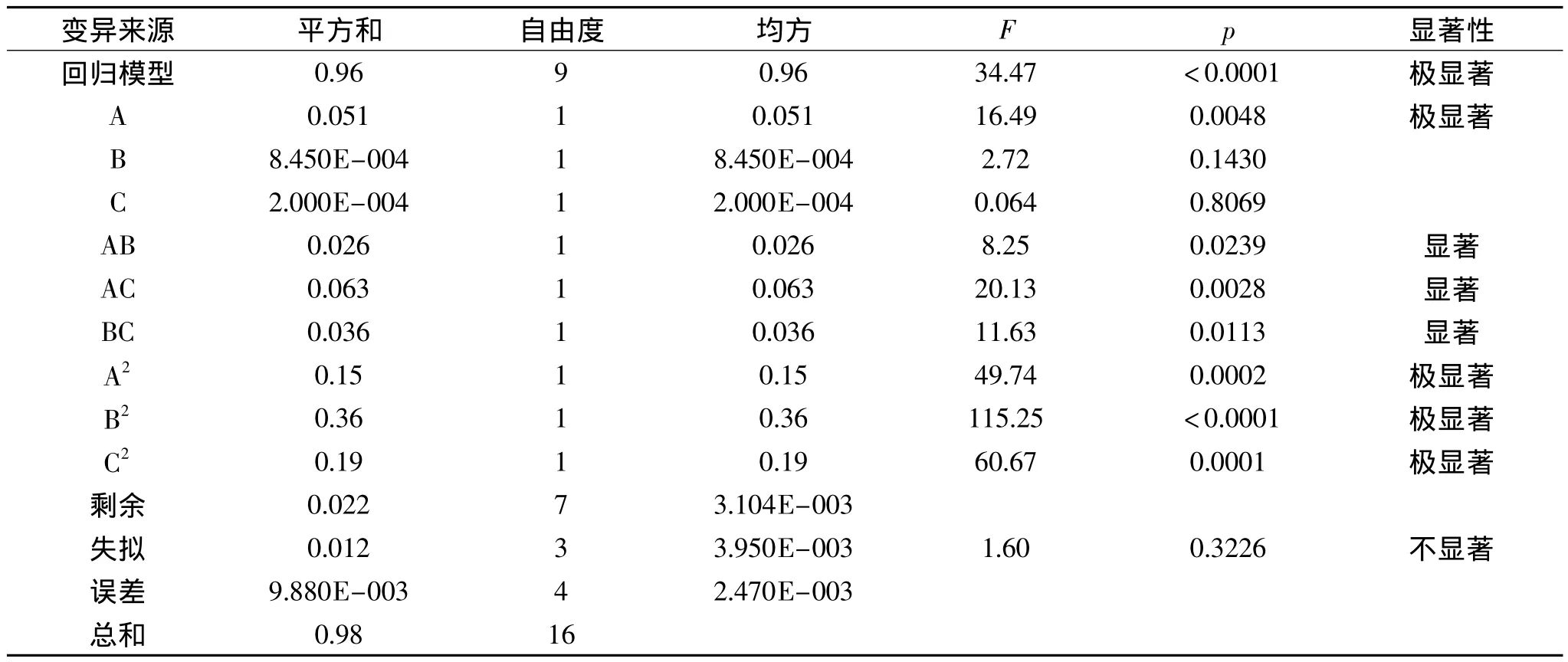
表3 方差分析表Table 3 Variance analysis for regression equation
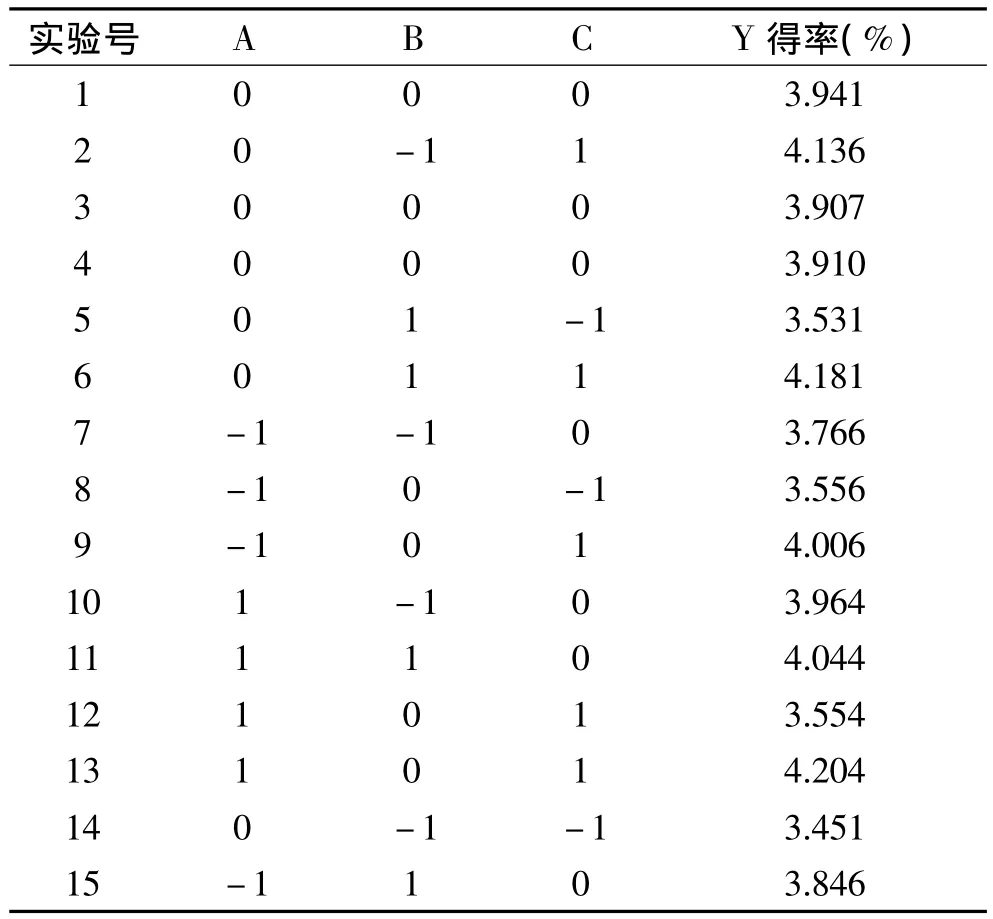
表2 三因素三水平中心组合实验方案与结果Table 2 Three factors and three levels of central composite experiment factor level table
2.3 响应面实验交互因素分析
通过Design Expert 8.0软件分析,将三因素两两进行分析比较,做出响应面曲线图。由图7~图9可以看出,温度相较于乙醇浓度、溴化十六烷基三甲胺添加量的曲线较陡峭,说明温度对于黄酮提取的影响较显著些;温度固定时,乙醇浓度的曲线比溴化十六烷基三甲胺添加量的陡峭,再一次验证了黄芪黄酮提取过程中,乙醇浓度的影响比溴化十六烷基三甲胺添加量的大。
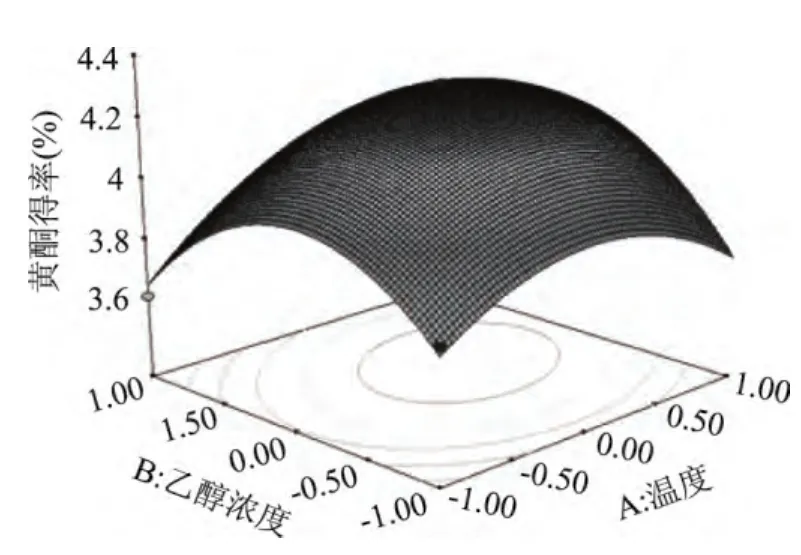
图7 提取温度与乙醇浓度对黄酮得率影响Fig.7 Interaction effects of extracting temperature and ethanol concentration on the yield of flavonoids
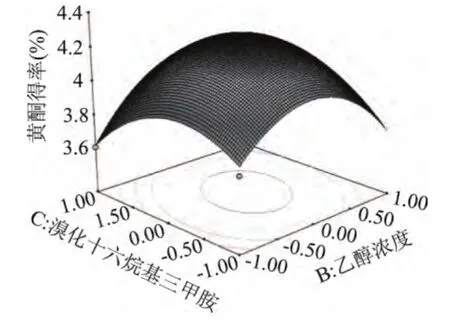
图8 乙醇浓度与溴化十六烷基三甲胺添加量对黄酮得率影响Fig.8 Interaction effects of ethanol concentration and CTMAB addition on the yield of flavonoids
等高线即为响应面图在底面的投影,其形状反映了交互影响的强弱大小。等高线趋于圆形时,两因素的交互作用相对较弱;等高线呈椭圆形时,两因素的交互作用相对较强[15]。由图可知,乙醇浓度和溴化十六烷基三甲胺添加量等高线趋于圆形,说明在某一因素取最佳值,其他两因子的交互作用为差异显著。乙醇浓度和提取温度的等高线、提取温度和溴化十六烷基三甲胺添加量等高线为椭圆形,说明这两组因素的交互作用显著。
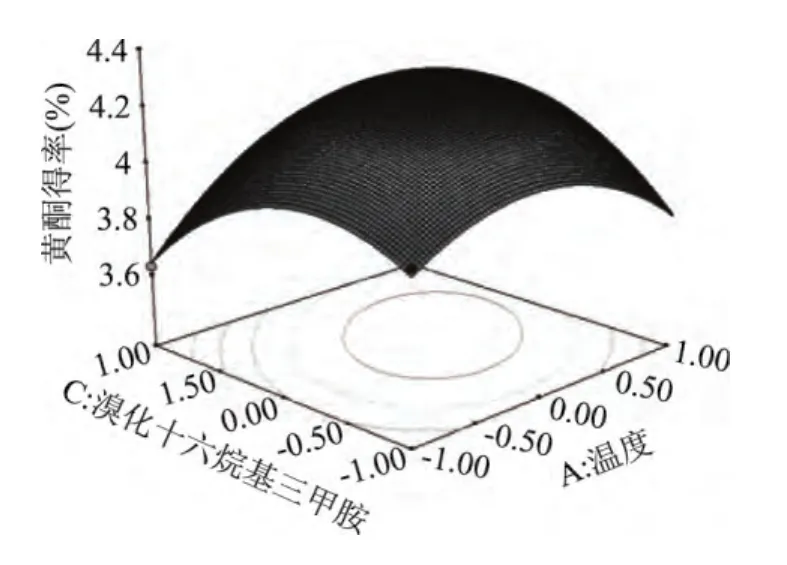
图9 提取温度与溴化十六烷基三甲胺添加量对黄酮得率影响Fig.9 Interaction effects of extracting temperature and CTMAB addition on the yield of flavonoids
由回归方程可知,表面活性剂辅助酶解提取黄芪黄酮最优工艺条件为:提取温度78.87℃,乙醇浓度79.73%,溴化十六烷基三甲胺添加量0.37%,在该条件下,黄芪黄酮的得率的理论值达4.287%。考虑到实际操作情况,将表面活性剂辅助酶解提取黄芪黄酮工艺条件优化为提取温度79℃,乙醇浓度80%,溴化十六烷基三甲胺添加量为0.37%。在此工艺条件下,进行3次验证实验,黄芪黄酮的平均得率为4.192%。
3 结论与讨论
3.1 在单因素实验结果的基础上,根据 Box-Behnken的中心组合实验设计原理,设计三因素三水平实验,利用Design-Expert8.0软件进行响应面分析,建立了黄芪黄酮提取的三元二次回归方程,经检验该回归方程是合理可靠的,能够较好的预测黄芪黄酮的得率。优化得出黄芪黄酮的最佳提取工艺条件为溴化十六烷基三甲胺添加量0.37%,乙醇浓度80%,提取温度79℃,在此条件下黄酮得率实测值可达 4.192%,与理论值(4.287%)基本吻合,充分验证了该模型的可靠性。
3.2 本文采用表面活性剂辅助酶法预处理提取法,该方法目前尚无文献报道,可以拓展为一种中药有效成分提取的新方法。与传统提取方法相比,具有选择性高、能耗低、排污量少等优点,与闪式提取法、超声波提取法相比,适用面更广,且设备简单,有效成分得率显著提高,符合当今绿色化学的潮流,对黄芪的进一步开发利用具有重要现实意义。
3.3 本文将表面活性剂辅助酶法预处理与有机溶剂提取相结合,提高了酶的水解效率,最大程度地释放有效成分。另外,由于表面活性剂的分子结构具有两亲性,可降低物质之间的界面张力,使溶剂分子更易渗入颗粒中,从而提高有效成分的提取效率。但该方法还处于实验室研究阶段,还未应用于实际生产中,在以后的工作中需要对表面活性剂的残留问题以及产物的安全性进行深入的研究。
[1]中华人民共和国药典委员会.中国药典(一部)[S].北京:化学工业出版社,2005:212-213.
[2]段亚丽,谢梅冬.黄芪化学成分及其有效成分黄芪甲苷含量测定的研究现状[J].中国兽药杂志,2005,39(3):35-38.
[3]Heim KE,Tagliaferro AR,Bobily D.Flavonoid antioxidants:chemistry,metabolism and structure-activity relationships[J].The Journal of Nutritional Biochemistry,2002,13(10):572-584.
[4]Wang Deqing,Zhuang Yuan,Tian Yaping,et al.Study of the effects oftotalflavonoids ofAstragalus on atherosclerosis formation and potential mechanisms[J].Oxidative medicine and cellular longevity,2012,11(10):282-283.
[5]常美玲,薛彦朝,李奉勤,等.超声波法提取黄芪中黄酮的最佳工艺研究[J].河北医药,2006(5):426-427.
[6]肖卫华,韩鲁佳.黄芪黄酮乙醇回流提取工艺的研究[J].食品工业科技,2008,29(1):233-235.
[7]贲永光,丘泰球,李坤平,等.纤维素酶法提取黄芪总黄酮的工艺研究[J].时珍国医国药,2009,20(10):2478-2480.
[8]武艳梅,赵航,李淑燕,等.闪式提取法提取黄芪活性成分工艺研究[J].食品科学,2011,24:98-101.
[9]李秀信,张军华.表面活性剂-微波辅助提取香椿黄酮[J].食品与发酵工业,2011,37(1):199-201.
[10]赵二劳,范建凤,张小燕.表面活性剂-尼纳尔增效微波提取沙棘叶黄酮的研究[J].日用化学工业,2009,39(1):36-40.
[11]曾晶,叶媛,龚大春.等.表面活性剂对纤维素酶水解过程的影响[J].酿酒科技,2008,12(1):38-40.
[12]邓一民.表面活性剂与染料对纤维素酶活性的影响[J].广西纺织科技,2009,39(4):23-26.
[13]王军,王敏,季璐.苦荞麦麸皮总黄酮提取工艺及其数学模型研究[J].农业工程学报,2006(7):223-225.
[14]费荣昌.实验设计与数据处理[M].无锡:江南大学出版社,2001:59-63.
[15]王倩,常丽新,贾长虹.超声波法提取狗枣猕猴桃叶黄酮的工艺研究[J].食品研究与开发,2012,33(2):43-46.
