复配谷物糖化酶解制备饮品预制粉(PBP)及其特性研究
2014-12-16龚雪梅蔡福带李同刚杨帆仔林小秋
龚雪梅,蔡福带,李同刚,杨帆仔,林小秋
(惠尔康集团有限公司,福建厦门361004;厦门惠尔康食品有限公司,福建厦门361004)
亚健康状态在经济发达、社会竞争激烈的国家和地区中普遍存在,人数呈逐年增加的趋势。世界卫生组织(WHO)章程序言中提到:全世界属于健康状态者仅占5%,诊病者约占20%,剩下的75%就属于亚健康状态者。世卫组织在《迎接21世纪挑战》中指出:21世纪的医学不应该继续以疾病为主要研究领域,应该以人类和人群的健康为主要研究方向[1]。谷物杂粮含有人体必需营养元素,一是维生素B1的含量高,二是含有较多膳食纤维,三是可以增强身体的免疫能力。作为21世纪最具开发潜力的食品资源,谷物杂粮具有健康的营养成分,有利于膳食结构的改善,有利于人类的健康[2]。但现有谷物杂粮复配产品少,或以简单的物理处理达到颗粒细化,不能充分细化营养分子[3]。在很多谷物研究中需去除谷壳谷皮,不仅浪费原料、污染环境,而且设备工艺复杂,产业化以及复制难度大。
本实验在复配谷物液化酶解实验[4]研究中,直接将谷壳谷皮酶解,提高产品膳食纤维的同时,也解决了生产上遇到的部分难题。但制备的可复制预制粉(PBP)颗粒、色泽以及溶解性均不理想,故进一步对复配谷物液化酶解液开展糖化酶解工艺研究,制备溶解性好、色泽呈乳黄色,饮品调配中不会出现pH变化,易于生产复制,且其蛋白质、脂肪以及可溶性膳食纤维含量达到生产标准等生产要求的PBP,实现实验工艺优化,简化实验步骤,最终达到谷物杂粮规模化生产成本降低、产品附加值提高的目的。
1 材料与方法
1.1 材料与仪器
复配谷物液化酶解液(DE值54.88%) 厦门惠尔康食品有限公司;葡萄糖淀粉酶 邢台万达生物工程有限公司;糖化酶解;酚酞试剂、菲林试剂、葡萄糖、氢氧化钠、碘液、盐酸等 分析纯。
DK-98-1电热恒温水浴锅 常州菲普实验仪器厂;EMS-4B磁力搅拌器 天津市欧诺仪器仪表有限公司;pH测定仪 上海虹益仪器仪表有限公司;XB120A电子天平 上海精密仪器仪表有限公司;DHG9055A鼓风干燥箱 上海精密仪器仪表有限公司;PK-WB-6GS微波干燥炉 南京三乐微波技术发展有限公司。
1.2 预制粉生产工艺流程
在对原料进行液化酶解(淀粉酶和纤维素酶)的基础上,进行后续糖化酶酶解,液化酶解与糖化酶解对整个预制粉的制备过程起着至关重要作用,具体生产工艺流程如下。

1.3 最佳酶解条件的确定
选择最佳复配谷物液化酶解液,选用葡萄糖淀粉酶,以DE值为指标,分别考察加酶量、酶解温度以及酶解时间对原料液化酶解效果的影响,在此基础上进行正交实验设计,确定最适酶解条件[5-7]。
1.3.1 酶解单因素实验
1.3.1.1 加酶量对底物水解度的影响 固定温度50℃、时间 60min、自然 pH,分别选取 100、150、200、250和300U/mL不同的加酶量进行实验,确定最适加酶量。
1.3.1.2 温度对底物水解度的影响 固定加酶量200U/mL、时间60min、自然pH,温度分别设置为40、50、60、70、80 和 90℃,确定最适温度。
1.3.1.3 时间对底物水解度的影响 固定加酶量200U/mL、温度60℃、自然 pH,分别选取 20、40、60、80、100和120min不同时间进行单因素实验,选择最适酶解时间。
1.3.2 正交设计优化实验 在酶解单因素实验结果的基础上,以底物水解度(DE值)为指标,利用正交实验设计,优化酶法制备复配谷物饮品专用预制粉的最佳工艺。实验设计如表1。
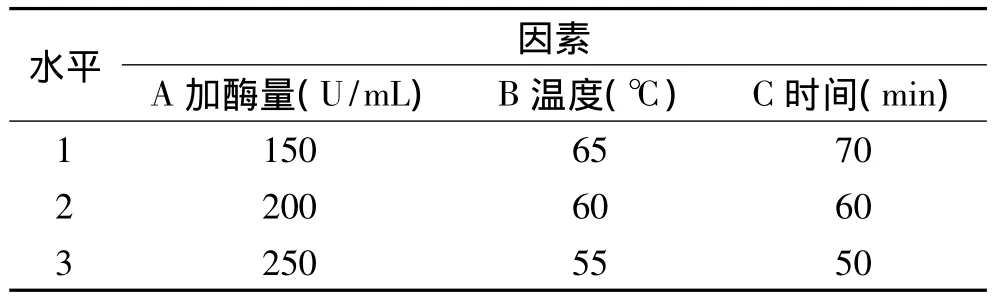
表1 因素水平编码表Table 1 The code list of factors level
1.4 指标测定
还原糖含量的测定:采用菲林试剂滴定法[5],总固形物的测定采用105℃恒重法。
DE值计算公式:
DE(%)=还原糖的含量(mg/mL)/总固形物的含量(mg/mL)×100
复配谷物预制粉组分检测方法:蛋白质参照国家标准 GB 5009.5-2010;脂肪参照 GB/T 5009.6-2003;膳食纤维参照GB/T 22224-2008。
其他成分检测方法:黄曲霉毒素B1参照GB/T 5009.22-2003;总砷(以 As 计)参照 GB/T 5009.11-2003;铅(Pb)参照 GB 5009.12-2010,试样经灰化后,在一定浓度范围内,注入原子吸收分光光度计石墨炉中,其吸收值与铅含量成正比,与标准系列比较定量。
溶解性测定[8]:在溶质还没有完全溶解于溶剂中时,这时在溶液中取出的液体是不一定饱和。但如果溶质已经完全溶解于溶剂中并有溶质析出时,这时在溶液中提取的液体是饱和的。在恒温水浴条件下,取一定量谷物预制粉加入500mL去离子水中,配制成饱和溶液,取100mL的饱和溶液倾入蒸发皿,再将蒸发皿放入烘箱中烘干,放入干燥器内冷却后称量并记录m2(mg),重复上述操作(两次相差不超过2mg),称量并记录蒸发皿的质量m1(mg),计算PBP溶解性S(mg/100mL),溶解性测算公式:
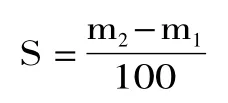
1.5 感官评定
抽取10名有食品感官鉴定经验的人员,对复配谷物经液化和糖化两步酶解后,微波干燥所得粉剂进行颗粒大小与色泽评定。评定等级标准见表2。

表2 感官评定参考标准Table 2 The reference standard of sensory evaluation
1.6 数据处理
采用微软办公软件Office2007®,Spss19.0软件处理数据。本实验均做了三次平行,结果为三次实验的平均值。
2 结果与分析
2.1 加酶量对糖化酶解的影响
加酶量对酶解效果影响明显,且关乎生产成本的规划,是实验中重要参数。由图1可知,加酶量由100U/mL提升到200U/mL时,DE值增高迅速,当加酶量达到200U/mL继续提高加酶量至300U/mL,DE值增加缓慢。这是因为底物近乎完全被酶络合,酶解进行较为彻底[9-10],所以结合生产成本因素,选用200U/mL为最适糖化酶解加酶量。
2.2 酶解温度对糖化酶解的影响
温度是影响酶活性的重要因素,由图2可知,不断提高温度,DE值呈现明显的先增后降,当温度为60℃时,DE值达到86.12%。这是由于低温度时酶的活性不高影响了酶解效果,当温度过高时又抑制了酶活。本实验选用温度为60℃,进行后续优化实验。
2.3 酶解时间对糖化酶解的影响
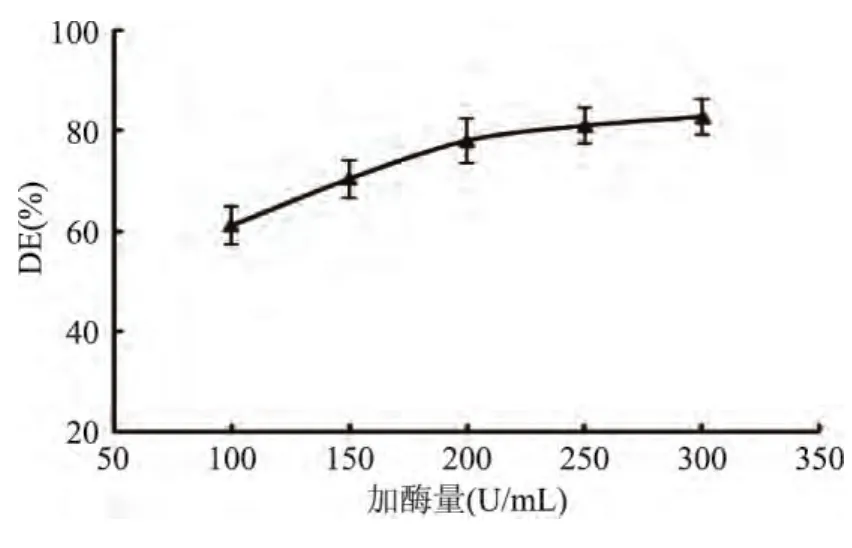
图1 加酶量对糖化酶解的影响Fig.1 Effect of the enzyme concentration on ability of saccharifying hydrolysis
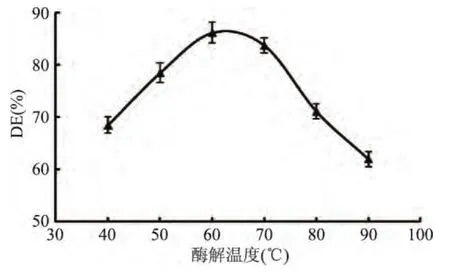
图2 温度对糖化酶解的影响Fig.2 Effect of the temperature on ability of saccharifying hydrolysis
时间是影响酶解效果又一重要参数,由图3可知,糖化时间由20min增加到60min时,DE值快速增加;60min至80min,DE值缓慢增加;80min后DE值趋于平缓,继续增加酶解时间,酶解效果已不明显。这是因为酶解具有专一性[10],酶解前期需识别底物并与之结合,后期随着底物减少,酶解效果减弱。综合考虑,本实验选择60min作为后续的酶解优化时间。
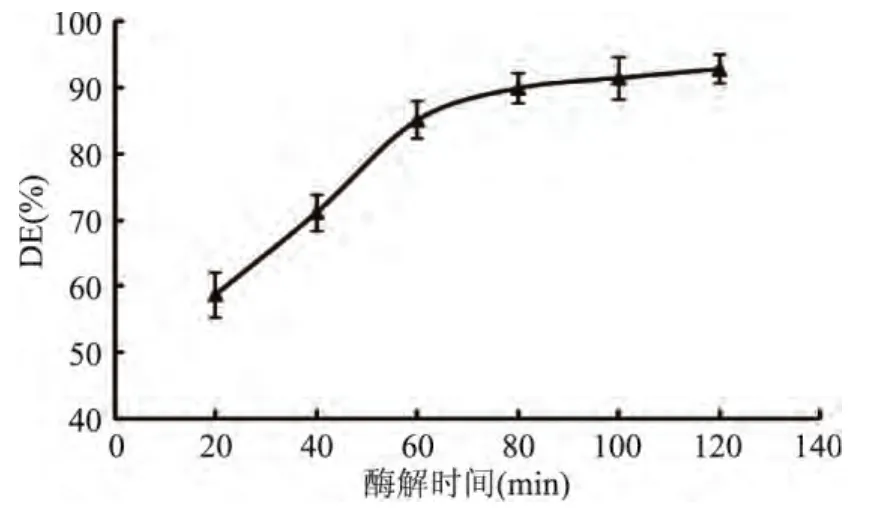
图3 酶解时间对糖化酶解的影响Fig.3 Effect of the time on ability of saccharifying hydrolysis
2.4 糖化酶解正交优化实验结果
由单因素实验可知,糖化酶加酶量、反应时间和反应温度都会对酶解反应产生影响,采用正交实验来确定糖化酶解的最佳实验条件。在复配谷物液化酶解的研究基础上,以DE值为考察指标,以反应温度、加酶量、反应时间为因素设计L9(34)正交实验。正交实验结果见表3。
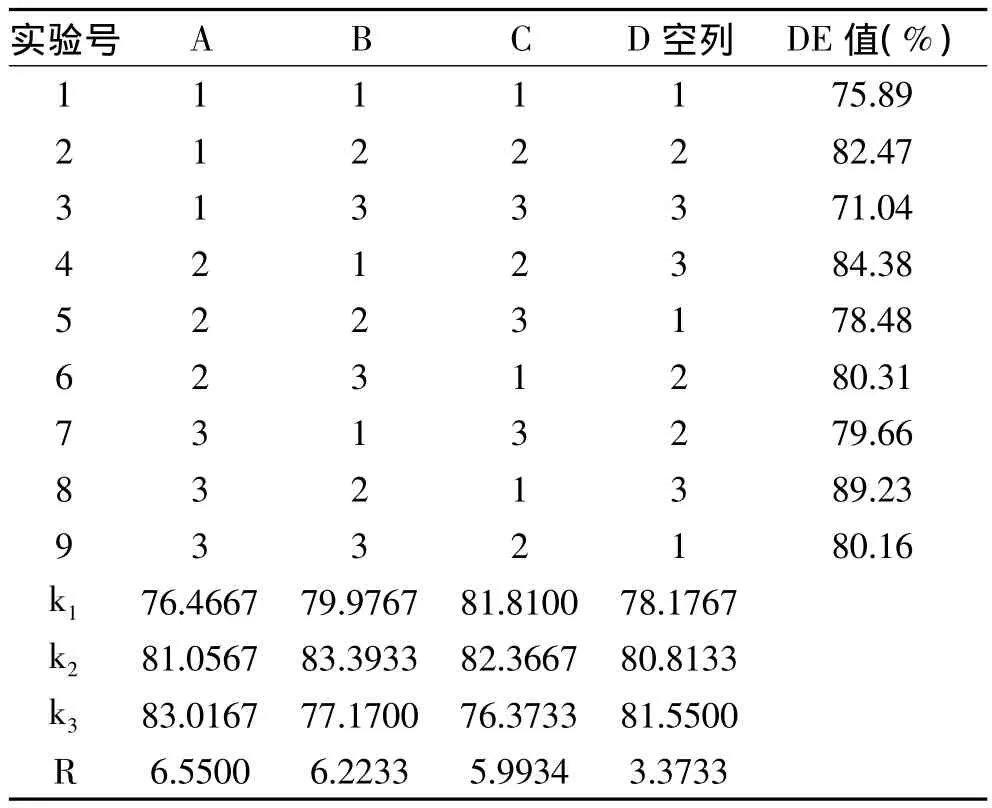
表3 正交实验设计结果与分析Table 3 The results and analyase of orthogonal experimental design
由表3可知,在实验范围内,各因素的作用大小顺序为加酶量高于温度,温度高于时间,即A>B>C。实验最佳组合为A3B2C2,即加酶量250U/mL、温度60℃、时间60min。实验结果表明,在此条件下,PBP的DE值达到88.96%。
2.5 不同水解度的PBP感官与溶解性比较
PBP的感官与溶解性是其作为生产饮品原料的重要参考因素,感官中的颗粒大小、色泽等影响饮品的颜色和口感,而溶解性直接关系到饮品中固形物的含量以及产品的整体效果。
由表4可知,随着酶解的进行,即DE值的提高,PBP颗粒逐渐细化,色泽由橘黄色变成乳黄色(接近开发乳品理想的颜色),当 DE值达到88.96%时,感官评分得92分。同时,其溶解性缓慢提高,适宜开发饮品。综合实验需求、生产成本等因素考虑,故选择DE值为88.96%的PBP为后续研究开发原料。

表4 不同水解度的PBP感官与溶解性Table 4 The PBP sensory and solubility of different DE(%)
2.6 PBP的溶解性研究
物质溶解性决定其是否适合生产应用,溶解能力的大小,一方面决定于物质的本性;另一方面也与外界条件如温度、溶剂种类等有关。在相同条件下,有些物质易于溶解,而有些物质则难于溶解,即不同物质在同一溶剂里溶解能力不同。通常把某一物质溶解在另一物质里的能力称为溶解性。在20℃、100mL水中,物质溶解大于等于10g则易溶;大于等于1g小于10g为可溶;大于等于0.01g小于1g为微溶;小于0.01g则表示难溶或者不溶[8]。上述实验得出,高DE值的PBP不仅色泽、颗粒适合开发乳品,同时溶解性较高。进一步研究不同条件下,DE值88.96%的PBP的溶解性,以期为后续的生产研究提供理论参考。
2.6.1 PBP在不同温度条件下溶解性的变化 由图4可知,在自然pH、不同温度条件下,PBP的溶解能力变化明显,温度在0℃时,PBP 溶解不到 2.80g/100mL,继续提高温度到50℃时,可达到5.25g/100mL,继续加热溶剂到100℃,溶解效果可以达到8.13g/100mL。所以,本实验制备的PBP属于可溶物质。
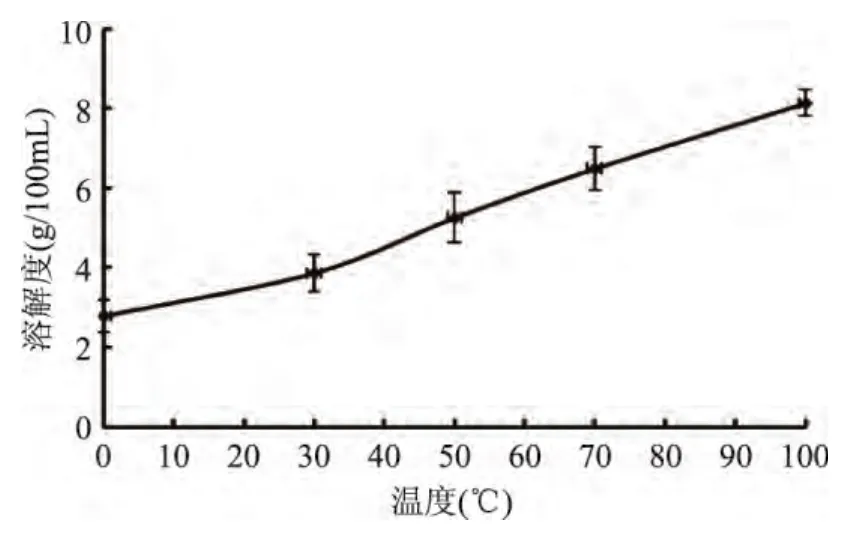
图4 在不同温度条件下溶解性变化Fig.4 The changement of Solubility under different temperature
2.6.2 PBP在不同pH条件下溶解度的变化 由图5可见,在常温条件下,PBP随着pH的提高,溶解性先增大后减小,即强酸条件下溶解性较低,降低酸度至pH 为 5.5 时,溶解性达到最大值的 7.58g/100mL,继续提高pH到6.5左右时,PBP的溶解能力下降明显,但 pH 为 7.5 时,溶解能力为 4.98g/100mL,仍属于可溶物质。
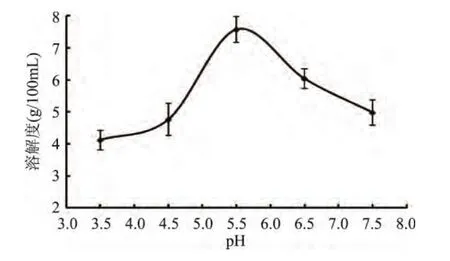
图5 在不同pH条件下溶解性变化Fig.5 The changement of Solubility under different pH
2.7 PBP的营养组分分析
由表5可知,PBP中蛋白质和脂肪含量分别为28.00、31.10g/100g(约7%为不饱和脂肪酸),可溶性膳食纤维达到1.10g/100g,为饮品开发提供营养原料。其他物质中,根据国家标准食品中污染物限量[11],杂粮中无机砷限量 0.2mg/kg、乳粉中 0.25mg/kg、果汁及果浆中总砷不超过 0.2mg/kg,PBP 砷含量 0.10mg/kg,符合要求;铅的含量不到0.10mg/kg,低于国家标准谷类、豆类、薯类中铅限量0.2mg/kg。所以,本实验制备的PBP营养组分较为丰富,有害物质符合国家要求限量标准。
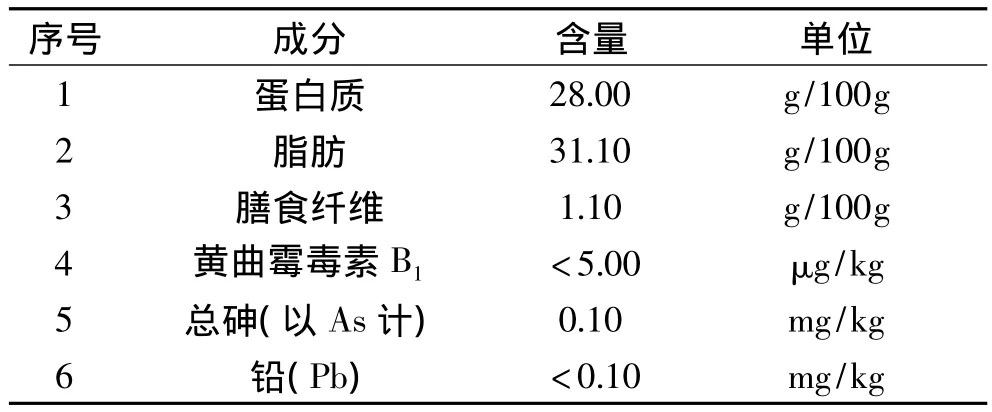
表5 预制粉基本成分Table 5 The basic components of PBP
3 结论
本实验内容在前期液化酶解工艺的基础上,开展糖化酶解的工艺优化。采用葡萄糖淀粉酶对液化酶解液二次酶解,通过单因素实验与正交实验的结合,得到最佳糖化酶解工艺条件为:加酶量250U/mL、温度60℃、时间60min、自然pH,此时酶解液DE值达到88.96%。该酶解液进行干燥得到谷物饮品预制粉(PBP),对其性质测量得,其中蛋白质和脂肪含量分别为 28.00、31.10g/100g,膳食纤维达到 1.10g/100g,营养组分较为丰富,且色泽、颗粒大小较适合开发饮品;砷含量 0.10mg/kg,铅的含量不到 0.10mg/kg,有害物质符合国家要求限量标准。溶解性测量表明PBP为可溶物质。
[1]李莹,包国金.亚健康状态的研究现状及展望[J].中国疗养医学,2008,18(5):421-422.
[2]预拌粉或将成为行业未来发展趋[EB/OL].http://www.chinacir.com.cn/2013_hyzx/357614.shtml,2013-06-04.
[3]吴朝霞,丁霞.杂粮的营养价值及杂粮保健食品的开发和应用[J].杂粮作物,2001,21(5):48-50.
[4]李同刚,蔡福带,龚雪梅,等.复配谷物制备饮品专用预制粉的液化酶解工艺研究[J].食品工业科技,2014(16):188-191.
[5]杨希娟,党斌,耿贵工,等.青稞谷物饮料酶解工艺的研究[J].食品工程,2012(30):72-75.
[6]刘彬,黄文,单麟军,等.酶水解米渣蛋白的工艺研究[J].粮食与饲料工业,2005,8:6-8.
[7]舒德海,钱俊青.糖化酶酶解米渣纯化米蛋白的工艺[J].Amino Acids & Biotic Resources,2009,31(3):7-9.
[8]Grant DJW,Higuchi T.Solubility behavioroforganic compounds[M].John Wiley & Sons,New York,1900.
[9]陈清西.酶学及其研究技术[M].厦门:厦门大学出版社,2010.
[10] IssaraSereewtthanawut,SurawitPrapintip,Katemanee Watchiraruji,et al.Extraction of protein and amino acids from deoiled rice bran by subcritical water hydrolysis[J].Bioresource Technology,2008,99:551-561.
[11]食品安全国家标准食品中污染物限量[S].GB 2762~2005.
