不同提取方法对杜香熊果酸提取得率的影响
2014-12-16张乔会逄锦慧董施彬宁亚萍王建中
张乔会,逄锦慧,杨 喆,董施彬,宁亚萍,王建中,*
(1.北京林业大学生物科学与技术学院,林业食品加工与安全北京市重点实验室,北京100083;2.北京林业大学材料科学与技术学院,林木生物质化学北京市重点实验室,北京100083)
杜香(Ledum palustre L.)为杜鹃花科杜香属的常绿灌木[1],是我国东北、内蒙古大兴安岭林区的主要森林组成树种,其分布面积约占大兴安岭林地面积的70%[2]。大兴安岭杜香干叶年生产量达 536925t·a-1[3],小兴安岭杜香的蕴藏量可达 8776.7t·hm-2·a-1,其中允收量以鲜重计为 1843.2t·hm-2·a-1[3]。杜香枝叶含有多种挥发性成分、熊果酸、多糖等成分[4-7]。
熊果酸具有抗炎[8]、镇静、增强机体免疫力、保肝[9-10]、抗癌、抗肿瘤[11-16]、美白、抗菌等药理作用。能溶于醇,不溶于水、石油醚等,其提取采用乙醇热提法、甲醇渗漉法、超临界提取、回流提取法,并辅助超声波、微波提取等。醇提一般辅以一定的温度,杂质较多;超声波产生的振动作用加强了胞内物质的释放、扩散及溶解;微波辅助提取是利用微波能来提高萃取率的新发展起来的技术;闪式提取是在高剪切力的作用下破坏物料的物理结构从而溶出其中物质。各种方法各有优点也各有不足,同时闪式提取杜香熊果酸鲜有报道,杜香资源大,开发利用杜香熊果酸价值高,研究不同方法提取杜香熊果酸对其利用具有重要意义。
1 材料与方法
1.1 材料与仪器
杜香 由内蒙古金河林业局2013年7月中旬采集提供,由北京林业大学植物专家坚定为杜香;无水乙醇(AR)、石油醚(AR)、香草醛(AR)、冰醋酸(AR)、高氯酸(AR)、去离子水、活性碳、熊果酸标准品 HPLC≥98%,中国食品药品检定研究所。
HHS4型恒温水浴锅 上海浦东跃新科学仪器厂;KQ-500E型超声波清洗器 昆山市超声仪器有限公司;QI-901涡旋混合器 海门市其林贝尔仪器制造有限公司;台式离心机 上海安亭科学仪器厂;RE-5203旋转蒸发仪 上海亚荣生化仪器厂;METTLER TOLEDO电子天平 梅特勒-托利多仪器(上海)有限公司;冷冻干燥机FD-1 北京德天佑科技发展有限公司;JHBE-50S闪式提取控制器 郑州金星科技有限公司;T6紫外可见分光光度计 北京普析通用仪器有限责任公司;Tensor27型FT-IR红外光谱仪 德国Bruker公司;S-3400N扫描电子显微镜 日本日立公司;E-1010溅射镀膜机 日本日立公司。
1.2 实验方法
1.2.1 试样的制备 将杜香枝叶切分成2~3cm的小段后于40℃烘箱中烘干,然后用BL-05粉碎机粉碎,80目过筛,将过筛后的粉末按1∶5加入石油醚脱脂脱色12h,过滤除去石油醚并将粉末放入40℃烘箱中烘干,然后存于室内阴凉干燥处备用。
1.2.2 杜香中熊果酸的提取工艺 采用90%的乙醇液提取,回收溶剂并用石油醚和水除杂,用活性碳脱色,并置于冷冻干机中干燥。
1.2.3 杜香熊果酸的定性检测 准确称取熊果酸标准品10mg及提取样品置容量瓶中,用无水乙醇溶解并定容到100mL,以乙醇作为对照液。利用紫外光谱对杜香醇提熊果酸及熊果酸标准品进行紫外可见光谱扫描,扫描范围为200~800nm,扫描速度快,扫描次数为3。利用Tensor27型FT-IR红外光谱仪对杜香醇提熊果酸及熊果酸标准品进行红外测定,红外测定范围为400~4000cm-1,分辨率为2cm-1。并对标准品和样品的光谱结果进行比对鉴定。
1.2.4 熊果酸粗提物得率计算 按以下公式计算提取得率:

式中:P-熊果酸粗提物提取得率;m-提取得到的杜香熊果酸的干重;W-杜香粉末的重量。
1.2.5 粗提物中熊果酸含量的测定 样品中含量的测定采用分光光度法,参考温媛媛方法进行测定[17]。
1.2.5.1 熊果酸标准曲线的绘制 精密称取105℃干燥至恒重的熊果酸标准品10mg,用无水乙醇定容至100mL的容量瓶中,即得0.1mg/mL的熊果酸标准品溶液。分别精密吸取熊果酸标准品溶液 0.5、0.6、0.7、0.8、0.9、1.0mL 置试管中,加热挥去溶剂,加 5% 香草醛- 冰醋酸 0.2mL,高氯酸 0.8mL,60℃ 水浴加热15min,取出冷却后移至10mL容量瓶中,加冰醋酸稀释至刻度,摇匀后在548nm处测定吸光度,同时以试剂空白作为参比。
1.2.5.2 样品中熊果酸含量的测定 准确称取不同方法提取所得样品10mg,用无水乙醇定容至100mL的容量瓶中,即得0.1mg/mL的熊果酸标准品溶液。取0.8mL置试管中,加热挥去溶剂,加5%香草醛-冰醋酸 0.2mL,高氯酸 0.8mL,60℃ 水浴加热 15min,取出冷却后移至10mL容量瓶中,加冰醋酸稀释至刻度,摇匀后以试剂空白作为参比在548nm处测定吸光度,并计算出熊果酸含量。
1.2.6 杜香中熊果酸提取工艺的实验设计 设计不同的提取方法,具体为超声波提取30min、室温浸提24h、闪式提取1min、闪式提取2min、闪式提取3min、闪式提取4min,考察不同方法对杜香中熊果酸提取得率的影响。
1.2.6.1 超声波提取 设定料液比 1∶20,提取温度为室温,提取时间30min,物料粒度分别为80目,用超声波辅助提取,超声波功率为440W。
1.2.6.2 室温浸提 设定料液比 1∶20,提取温度为室温,提取时间24h,物料粒度分别为80目,辅以轻微的震荡。
1.2.6.3 闪式提取 设定料液比 1∶20,提取温度为室温,物料粒度分别为80目,提取时间分别为1、2、3、4min,使用闪式提取器进行辅助提取。
1.2.7 提取后料渣的电镜扫描 在扫描电子显微镜(SEM)设备下观察提取后的料渣的表面形态,扫描电镜采用10千伏的加速电压,检测前,使用溅射镀膜机对材料表面进行喷金。
1.2.8 数据处理 实验数据均采用 Microsoft excel 2007进行处理。
2 结果与分析
2.1 杜香熊果酸的紫外及红外检测结果
从熊果酸标准品及杜香熊果酸提取样品的紫外波长扫描谱图来看,两者都在204nm处有最大吸收峰,且整个紫外-可见波长范围内只有204nm处的一个峰,符合熊果酸的紫外特征吸收,证明提取物中含有熊果酸。

图1 熊果酸标准品的紫外扫描谱图Fig.1 UV scanning spectrum of Ursolic Acid standard

图2 熊果酸样品的紫外扫描谱图Fig.2 UV scanning spectrum of Ursolic Acid sample
从图 3可以看出,熊果酸标准品在 3526.78、2959.40、1717.94、1454.61、1385.57、1244.77cm-1等处都有明显有吸收峰,为熊果酸中-OH、-C=O、-C-H、-CH3等基团的振动。从图4可以看出,从杜香中提取的熊果酸样品的红外谱图在 3522.78、2951.39、1721.86、1446.43、1385.34、1244.36cm-1等处也均有峰,与熊果酸标准品的特征峰基本一致,说明提取物中含有熊果酸。
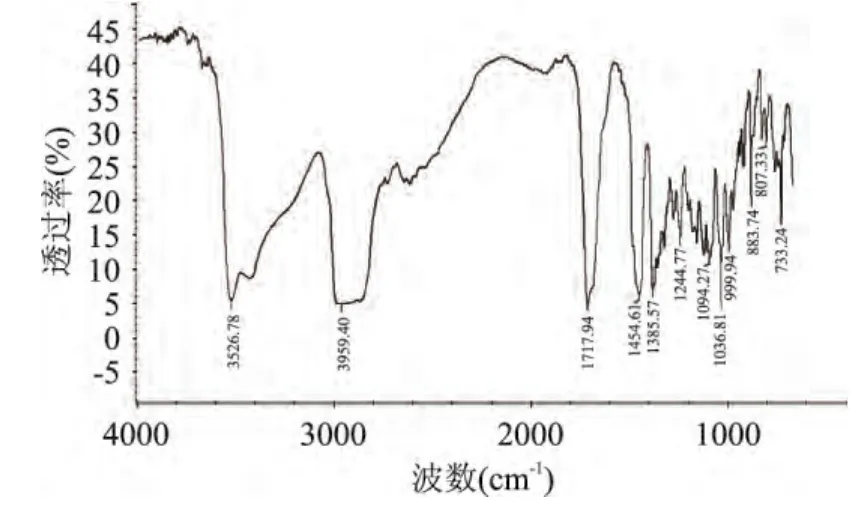
图3 熊果酸标准品的红外光谱图Fig.3 IR spectrum of Ursolic Acid standard
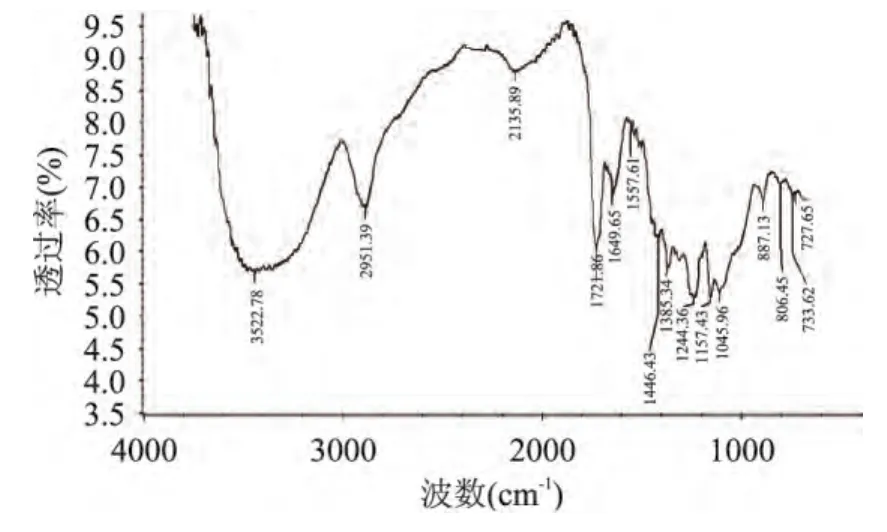
图4 熊果酸样品的红外光谱图Fig.4 IR spectrum of Ursolic Acid sample
2.2 不同方法提取杜香中熊果酸实验结果
2.2.1 提取得率 从图5可以看出,3min内,随着闪式提取时间的增加,提取得率增大,之后随时间的增加提取得率不再变化。超声波辅助提取的得率高于室温浸提24h,但低于闪式提取2min以上的提取得率。总体来说,闪式提取得率(提取2min以上)>超声波辅助提取30min>室温浸提24h。
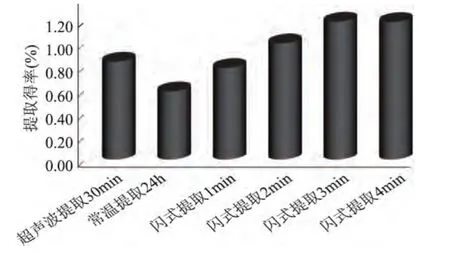
图5 不同提取方法的提取得率Fig.5 Extraction rate of different extraction technologies
2.2.2 提取过程中温度的变化 从表1可以看出,超声波辅助提和闪式提取器辅助提取都会明显导致提取温度的变化,且在1~3min内,随着闪式提取时间增加,温度呈线性上升。超声波在传播过程中,声能可以不断被介质所吸收,吸收的能量几乎全部转变为热能,从而导致介质本身和待萃取成分温度升高,增大了有效成分的溶解度这种吸收声能引起植物组织内部温度的升高是瞬时的,因此可使被提取成分的生物活性保持不变;而闪式提取产生的温度变化可能是由于闪式提取刀头的高速转动和物料的摩擦产生机械摩擦,从而将机械能转化为热能,所以随着闪式提取时间的增加,温度也随着增加,但当温度达到一定水平后,由于产生的热量和周围空气产生热交换,使提取温度不再上升。
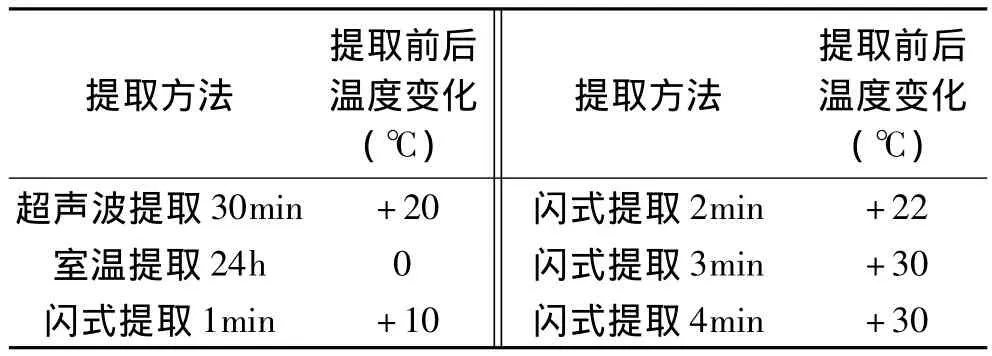
表1 不同方法提取后物料的温度变化Table 1 Change of the material’s temperture after extract by different methods
2.2.3 提取粗产物的比较结果 从表2可以看出,超声波辅助提取及室温提取的粗产物颜色明显要浅,且呈粉末状态;用闪式提取器辅助提取的粗产物颜色深,呈胶黏状。因而可以推断出用闪式提取器辅助提取可能因为提取液含有15%的水,且闪式提取刀头摩擦产热导致局部温度快速升高,从而导致杜香粉末中的多糖及其他组分溶出,使得粗产物黏性增加、颜色加深。超声波辅助提取的粗产物由于受超声的影响,也溶出一些其他组分,但瞬时升温对多糖的溶出影响不大。

表2 不同提取方法粗提物的颜色及状态Table 2 Color and form of the impure extracting by different extraction technologies
2.2.4 不同方法得到样品中熊果酸含量测定结果 从图6可知,熊果酸浓度在5~10μg/mL范围内呈良好线性关系,回归方程为 y=0.0732x-0.1264,相关系数 R2=0.9991。

图6 熊果酸标准曲线Fig.6 The standard curve of ursolic acid
从表3可以看出,不同方法提取得到的熊果酸样品中熊果酸的含量略有差异,但差异不大。其中含量最高的是用超声波辅助提取得到的样品,其次是室温提取得到的样品。闪式提取得到的样品中熊果酸的含量随着闪式提取时间的增加而逐渐降低,这与闪式提取得到的样品颜色较深、杂质较多相匹配。但含量降低的程度很小,可能是增加的熊果酸的提取率,但也增加杂质的提取率,使得样品中熊果酸的含量有一定的降低。
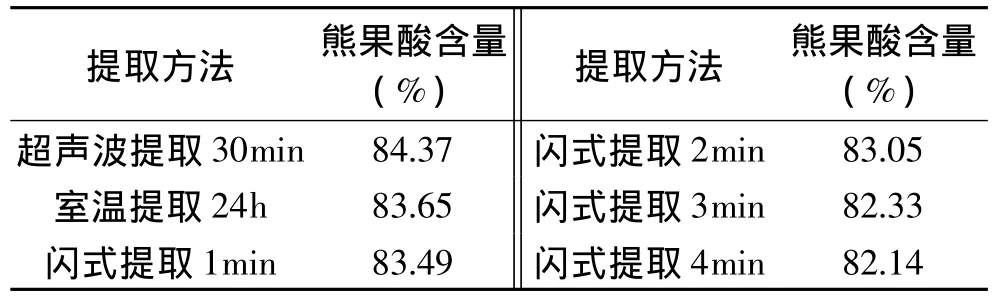
表3 不同提取方法粗提物的中熊果酸含量Table 3 The content of ursolic acid by different extraction technologies
2.3 提取后杜香粉末的扫描电镜结果

图7 原料的扫描电镜图(500×)Fig.7 Scanning picture of original medicinal meterials by SEM(500×)
2.3.1 500倍放大结果 从图7~图13可以看出,放大500倍时,24h浸泡、超声波提取30min与未处理的几个样品没有明显的区别。但闪式提取后的样品就能看出明显的差别,与前几个样品比较,经过闪式提取后的样品颗粒度明显比其他处理的要细,且随着闪式提取时间的加长,颗粒度变细的程度也逐渐增大。

图8 室温提取24h料渣的扫描电镜图(500×)Fig.8 Scanning picture of extraction in room temperature for 24 h by SEM(500×)

图9 超声波辅助提取30min的扫描电镜图(500×)Fig.9 Scanning picture of extraction for 30 minutes by ultrasonic assisted by SEM(500×)

图10 闪式提取1min的扫描电镜图(500×)Fig.10 Scanning picture of flash extraction for 1 minutes by SEM(500×)
2.3.2 3000倍放大结果 从图14~图20可以看出,没有经过处理的粉末表面比较光滑,没有碎裂,也没有过多的孔洞。而室温浸泡24h的粉末及闪式提取1min的物料表面出现了很多的孔洞,可能是由于粉末中的物质溶解后留下的空隙;电镜图片显示杜香原料表面可见很多粒状附着物,可能是淀粉、蔗糖等。超声波处理的粉末放大后可明显看到结构受到破坏,其中很大部分都碎裂并分离。而经过闪式提取处理的样品则主要表现在表面结构被机械破碎,粉末的表面一层受到了很大的机械破坏,且随着闪式时间的加长,破碎的程度加大。

图11 闪式提取2 min的扫描电镜图(500×)Fig.11 Scanning picture of flash extractionfor 2 minutes by SEM(500×)
2.4 电镜与提取得率综合分析结果
结合提取后物料的电镜扫描照片及不同方法提取的得率进行分析,可以看出,就提取熊果酸得率而言,几种方法中最优的是闪式提取,其次是微波辅助提取,最后是室温提取24h,而闪式提取的时间设3min即可。但从粗提物的颜色及状态来判断,闪式提取的杂质最多,室温长时间提取次之,超声波辅助提取杂质最少。可能是因为闪式提取除挤压和剪切作用外,还产生许多次级效应,如涡旋扩散、粉碎、化学效应等也都有利于使植物中有效成分向溶剂转移,并充分和溶剂混合,促进提取的进行;闪提时间在3min内对提取呈正相关,但超过3min后,由于物料已经被挤压破碎得很细,加上升高温度及二级作用使得物质已经全部溶解到溶剂中而使提取得率不再上升。室温长时间提取可能是因为物质在溶剂中经过长时间的扩散,逐步转移到溶剂中;而超声法,空化产生的极大压力造成被破碎物细胞壁及整个生物体破裂,而且整个破裂过程在瞬间完成。同时超声波产生的振动作用加强了胞内物质的释放、扩散及溶解,加速植物中的有效成分进入溶剂[18]。

图14 原料的扫描电镜图(3000×)Fig.14 Scanning picture of original medicinal meterials by SEM(3000×)

图15 室温提取24h的扫描电镜图(3000×)Fig.15 Scanning picture of extractionin room temperature for 24 h by SEM(3000×)
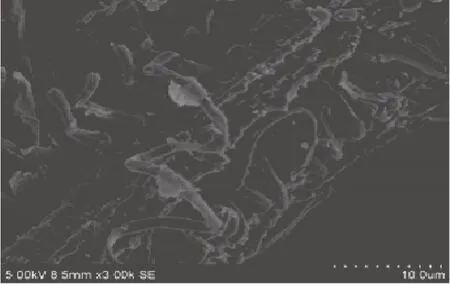
图16 超声波提取30 min的扫描电镜图(3000×)Fig.16 Scanning picture of extraction for 30 minutes by ultrasonic assisted by SEM(3000×)

图17 闪式提取1min的扫描电镜图(3000×)Fig.17 Scanning picture of flash extraction for 1minutes by SEM(3000×)

图18 闪式提取2 min的扫描电镜图(3000×)Fig.18 Scanning picture of flash extraction for 2 minutes by SEM(3000×)

图19 闪式提取3 min的扫描电镜图(3000×)Fig.19 Scanning picture of flash extraction for 3 minutes by SEM(3000×)

图20 闪式提取4 min的扫描电镜图(3000×)Fig.20 Scanning picture of flash extraction for 4 minutes by SEM(3000×)
3 结论
综合以上分析可知,闪式提取及超声波辅助提取都对物料造成较大的机械破坏使得提取得率增加,闪式提取法以机械挤压摩擦造成机械破碎,而超声波以机械空化及振动使物料造成机械破碎。物料机械破碎的程度越大,提取得率越高,同时杂质越多。为追求熊果酸最大提取得率,较优方法为闪式提取3min,提取得率为1.18%,但闪式提取杂质较多,超声波辅助提取杂质相对较少,如考虑简化纯化步骤,较优方法为超声波辅助提取,提取得率为0.83%。结合资源、能源及提取得率等分析,较优提取方法为闪式提取3min。当然,具体提取参数还有待进一步研究分析。
[1]中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社,1999:4.
[2]冯旭,周勇,郭立新.黑龙江省野生香料植物资源及其利用[J].国土与自然资源研究,1995,2:68-72.
[3]周以良.中国大兴安岭植被[M].北京:科学出版社,1991:239-310.
[4]赵頔,张敏,武文斌,等.杜香黄酮提取纯化工艺及其抗炎作用研究[J].中成药,2012,34(8):1590-1594.
[5]路博琼,罗书勤,张力平.超临界CO2萃取杜香挥发油工艺优化及成分分析[J].现代农业科技,2014(6):173-176.
[6]姜玮,刘静波,陶旭,等.均匀设计-BP神经网络优化超临界CO2提取杜香挥发油工艺[J].农业工程学报,2011,27(2):293-296.
[7]姜玮,刘静波,卢静,等.杜香挥发油研究概述[J].食品科学,2010,31(13):337-341.
[8]施凤.熊果酸对大鼠活化型肝星状细胞的NOX及其调控的信号网络的影响[D].南昌:南昌大学,2013.
[9]欧阳灿辉,朱宣,张和,等.熊果酸对肝纤维化大鼠肝组织TGF-β1和 α-SMA表达的影响[J].世界华人消化杂志,2009,17(22):2237-2243.
[10]李建勋.熊果酸对大鼠肝纤维化的防治及相关机制的研究[D].广州:广东中医药大学,2012.
[11]Ramos A A,Pereira-Wilson C,Collins AR.Protective effects of ursolic acid and luteolin against oxidative DNA damage include enhancement of DNA repair in Caco-2 cells[J].Mutat Research,2010,692(2):6-11.
[12]Jang S M,Yee S T,Choi J,et al.Ursolic acid enhances the cellular immune system and pancreatic β-cell function in streptozotocin induced diabetic mice fed a high-fat diet[J].International Immunopharmacology,2009,9(1):113-119.
[13]Resende F A,Kato F H,Cunha W R,et al.Antimutagenicity of ursolic acid and oleanolic acid against doxorubicin induced clastogenesis in Balb/c mice[J].Life Sciences,2006,79(13):1268-1273.
[14]Zhang Y,Kong C,Zeng Y,et al.Ursolic acid induces PC-3 cell apoptosis via activation of JNK and inhibition of Akt pathways in vitro[J].Molecular Carcinogenesis,2010,49(4):374-385.
[15]Subbaramaiah K,Michaluart P,Sporn M B,et al.Ursolic acid inhibits cyclooxygenase-2 transcriptionin human mammary epithelial cell[J].Cancer Research,2000,60(1):2399-2402.
[16]Cárdenas C,Quesada A R,Medina M A,et al.Effects of ursolic acid on different steps of angiogenic process[J].Biochemical and Biophysical Research Communications,2004,320(2):402-408.
[17]温媛媛.山茱萸中熊果酸的提取分离及其抗氧化活性研究[D].合肥:安徽农业大学,2010.
[18]郑静,常逎滔,林英.超声波法和超声波酶法提取灵芝多糖的条件研究[J].食用菌学报,2006,13(1):48-52.
