沉水植物黑藻腐解过程中营养盐释放过程
2014-12-14李春华孔祥龙中国环境科学研究院湖泊工程技术中心环境基准与风险评估国家重点实验室北京0002辽宁石油化工大学生态环境研究院辽宁抚顺00北京师范大学资源学院北京00875环境保护部环境工程评估中心北京0002
叶 春,王 博,李春华,叶 斌 ,江 源 ,孔祥龙 (.中国环境科学研究院湖泊工程技术中心,环境基准与风险评估国家重点实验室,北京 0002;2.辽宁石油化工大学生态环境研究院,辽宁 抚顺 00;.北京师范大学资源学院,北京 00875;.环境保护部环境工程评估中心,北京 0002)
沉水植物黑藻腐解过程中营养盐释放过程
叶 春1*,王 博1,2,3,李春华1,叶 斌4,江 源3,孔祥龙1(1.中国环境科学研究院湖泊工程技术中心,环境基准与风险评估国家重点实验室,北京 100012;2.辽宁石油化工大学生态环境研究院,辽宁 抚顺 113001;3.北京师范大学资源学院,北京 100875;4.环境保护部环境工程评估中心,北京 100012)
为探究沉水植物衰亡过程中营养盐的释放规律,采用黑藻(Hydrilla verticillata Royle)作为研究用沉水植物,在实验室内模拟了黑藻在初春温度下腐解过程中的主要营养盐碳、氮、磷的释放过程.结果表明:黑藻在试验初期迅速腐解,该过程中向水体释放大量碳(81.31%)、氮(81.62%)、磷(85.94%).但随着时间的推移,黑藻向水体释放的磷大部分沉积进入底泥,而氮有部分沉积进入底泥,同时有部分以气体形式移出水体.黑藻腐烂分解产生的厌氧条件以及高 TOC供给促进水体反硝化作用加快氮素移出水体.但是较大生物残留量会引起水体缺氧,植物残体分解加剧,导致水质严重恶化,因此需要适时收割水生植物来控制水体残留生物量.
沉水植物;黑藻;腐解;营养盐;水生态
我国淡水湖泊大多为浅水湖泊,主要分布在东南沿海或长江中下游平原地区,浅水湖泊水生植物修复既是有效的治理方法,又是治理目标之一,成为我国湖泊富营养化治理与湖泊生态修复的关键所在.水生植物可分为挺水植物、浮叶植物和沉水植物,其中沉水植物与水体的关系最为密切,占据着湖泊生态系统的关键界面,不仅影响着水中的鱼类、浮游动植物、底栖生物的组成和分布,而且可以起到稳定底质和净化水质的作用[1],对湖泊生产力及生物地球化学循环具有重要的影响[2].从水生植物整个生命周期来看,植物生长期对水生态系统和水体水质会产生正效应,但是,植物衰亡后的腐烂分解过程对水体水质和水生态系统可能会产生负面影响.目前大部分研究关注冬季沉水植物的腐解,我国南方大部分水域沉水植物虽然在秋、冬寒冷季节开始衰亡,但由于冬季水温较低,此时植物体腐解较为缓慢,大量营养物质仍保留在植物残体中,直至翌年初春回暖,植物体才开始迅速腐解,向水体释放大量营养盐,而针对初春植物腐解对水体环境影响尚缺乏系统深入的研究[3].不同沉水植物的腐解过程及营养盐释放规律存在较大差异,有必要针对湖泊水体生态恢复中常用的土著物种开展研究.本研究选取我国南方水域常见沉水植物黑藻(Hydrilla verticillata Royle),采用室内模拟方法,研究在初春温度条件下沉水植物腐解过程中营养盐的释放规律以及营养盐释放对环境影响效应,以期为湖泊水生态修复和水生植物管理提供基础理论依据.
1 材料与方法
1.1 材料
沉水植物黑藻和底泥10月初采集于东太湖(31°01′50″N,120°20′18″E).东太湖是太湖东南部一个浅水湖湾,平均水深 1.2m,水生植被覆盖率96%.冬季平均水温为 6℃,春季水温昼夜相差不大,为16.5~18℃.采样现场沉水植物、浮叶植物、挺水植物生物量均较高,底泥肥厚,水体清澈.黑藻、苦草、马来眼子菜在区域内生长茂密,有养蟹区.湖水中 ρ(TN)、ρ(TP)、ρ(TOC)分别为 1.30,0.05,1.31mg/L;底泥中w(TN)、w(TP)、w(TOC)分别为1.23,0.51,15.84mg/g.
结合现场采集的沉水植物生物量与东太湖历年生物量,确定实验室模拟条件下水体的最大生物量为25g/4L,即6.25g/L(湿重).
1.2 方法
以塑料桶作为试验容器(直径30cm,体积6L),桶中加入200g底泥和4L已配置好的人工湖水.参照沉水植物采集区域的水质,人工湖水中ρN)为 1.00mg/L,ρ(-N)为 0.30mg/L,ρ(TP)为0.05mg/L.将黑藻于试验开始前放入6℃冰箱中进行一周低温处理,以模拟沉水植物在春季大规模腐解前的状态,然后使用滤布将其包裹后加入到试验容器中,每个容器中的生物量均为25g,同时设未加入植物的空白对照组,两种条件下均设3个平行.
试验在人工气候室中进行,参照东太湖春季水温范围,设定试验温度为 17℃.分别在第 0、7,14,21,28,35,43,50,57,64,70d从容器中取水样,测定相关水体指标,测定项目包括 ORP(氧化还原电位)、ρ(TN)、ρ(TP)、ρ(-N)、ρ(-N)、ρ(TOC),并在采集水样的当天测定单位时间内产生的N2O及N2的通量,N2O以及N2通过不透气塑料薄膜包裹塑料桶,1h后使用带有阀门的取气针抽取顶空气体;底泥以及植物中 w(TN)、w(TP)、w(TOC)在试验初始和结束时取样测定.
采用YSI DO200型溶氧仪测定ρ(DO),采用梅特勒-托利多SG-2型ORP仪测定 ORP,采用碱性过硫酸钾消解法测定 ρ(TN),采用纳氏试剂光度法测定 ρ(-N),采用紫外分光光度法测定 ρ(-N)[4],采用 SHIMADZU TOC-VCPH型TOC仪测定ρ(TOC);采用重铬酸钾-硫酸消化法测定底泥及植物中 w(TOC),采用凯氏法测定底泥及植物中w(TN),采用SMT法[5]测定w(TP),采用氢氟酸-硫酸溶钼锑抗比色法[5]测定植物中w(TP).采用气相色谱(Agilent 6890N)测定N2O通量,载气为高纯度的 N2,流速 8mL/min;分离柱为HP-Plot Q柱,工作温度50℃;检测器为电子捕获检测器(ECD),工作温度 350℃.N2由氮气测定仪HF-800测定.
1.3 数据处理
采用 SPSS 18.0和excel2010软件进行数据统计分析和作图.采用单因素方差分析(one-way ZNOVA)和 LSD法进行方差分析和差异显著性检验(α=0. 05).
2 结果与分析
2.1 黑藻营养物质的释放量
在 70d的试验周期内,黑藻的腐解率为76.56%,由表1可见试验结束时,黑藻碳、氮、磷释放率非常高,植物体 80%以上营养物质在 70d的试验周期内被释放出来.
2.2 水体溶ρ(DO)与ORP变化
水体ORP的变化趋势与ρ(DO)近似,与植物腐解的过程密切相关,由于黑藻的腐烂分解消耗了水体中大量的DO,使上覆水体中的ρ(DO)在试验初期迅速降低.在试验中、后期,植物腐解过程逐渐减弱,DO 消耗量降低,水体中 ρ(DO)逐渐上升.水体 ORP在试验前期逐渐下降,随后逐渐上升,随后又有一定下降至基本保持稳定,试验结束时黑藻组与空白组相比,ORP值仍较低.经过显著性差异检验,水体ρ(DO)与ORP之间均呈极显著正相关关系(P < 0.01).
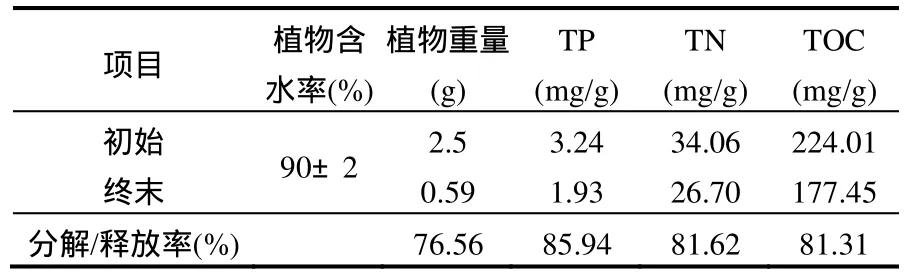
表1 黑藻营养物质含量变化Table 1 Nutrient contents variation in Hydrilla verticillata Royle
2.3 水体与底泥中磷含量的变化
由图1可知,含黑藻组水体的ρ(TP)呈先增后减的趋势,这是由于黑藻腐解迅速向水体释放出磷,第7d时ρ(TP)达到最大值,然后随着黑藻腐解过程逐渐减弱,水体 ρ(TP)逐渐下降,试验结束时水体ρ(TP)与初始相比增加了5.6倍.空白组水体ρ(TP)也有一定增加,但变化不大,与初始相比差异不显著(P > 0.05)
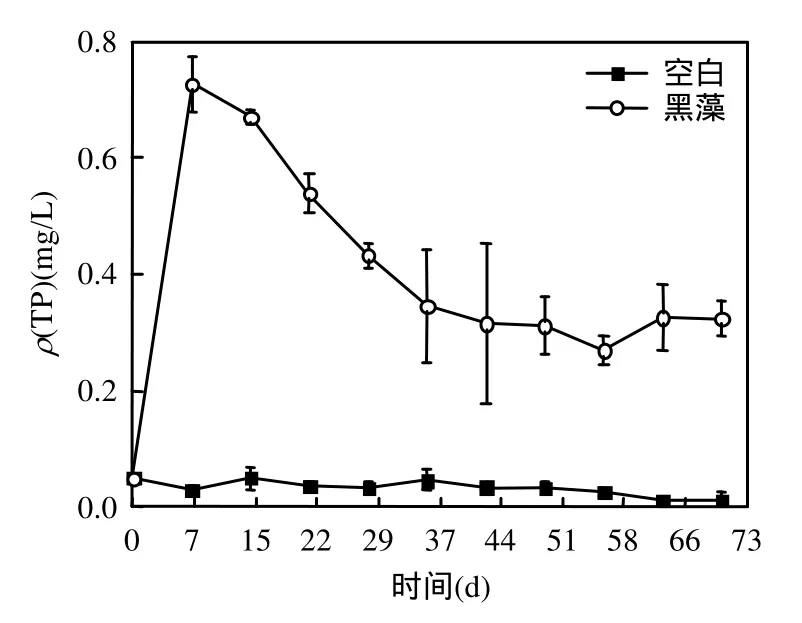
图1 水体ρ(TP)随时间的变化Fig.1 Temporal variation of ρ(TP)in water
为了探明黑藻腐解过程中所释放磷的迁移转化以及对整个水体的环境效应,在试验初始与结束时测定底泥中的 w(TP),结果见图 2.试验结束时,空白组的 w(TP)与初始值基本持平,稍有增加;由图1可知,上覆水总磷在试验中后期逐渐减少,表明黑藻腐解产生的磷并未始终滞留在水体中,而是可以通过上覆水向底泥迁移.
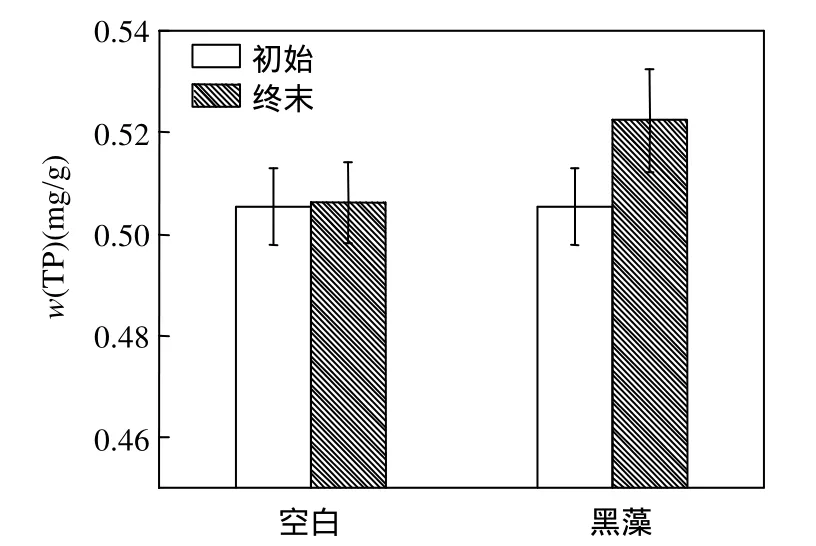
图2 试验初始和终末底泥w(TP)变化Fig.2 Initial and final w(TP)in sediment
2.4 水体与底泥碳含量的变化
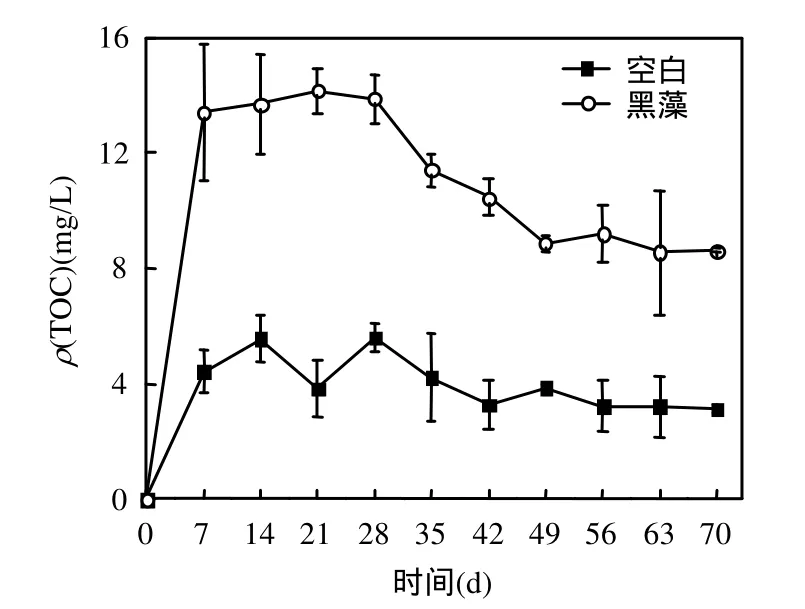
图3 水体ρ(TOC)随时间的变化Fig.3 Temporal variation of ρ(TOC)in water
图3显示了水体ρ(TOC)的变化过程,与磷的变化过程有所不同,水体ρ(TOC)在达到最大值后,并未迅速下降,而是在较高值稳定一段时间后,才开始下降.黑藻组水体中部分TOC的减少原因与磷类似,也是底泥的吸附作用所致;而另一个原因是微生物的作用,在黑藻腐解过程中有机物以CH4、CO2的形式移出系统[8].由图4可见,试验结束时,空白组底泥 w(TOC)有一定下降,表明底泥碳的输出量大于水体向底泥的迁移量,而黑藻试验组底泥 w(TOC)有一定上升,说明黑藻的腐解是引起底泥w(TOC)增加的主要原因.
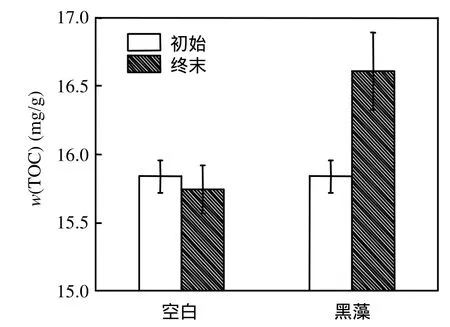
图4 试验初始和终末底泥w(TOC)变化Fig.4 Initial and final w(TOC)in the sediment
2.5 水体与底泥中氮的含量变化
2.5.1 水体与底泥中总氮的含量变化 图5显示了黑藻在腐解过程中向水体释放氮的过程,与磷的释放过程类似,即试验初期黑藻试验组水体ρ (TN)迅速增加,这主要是由于随着植物的腐烂植物体内所含的氮被不断地释放出来,致使总氮浓度升高[9-10],在试验14d时达到最大,随后黑藻试验组水体ρ(TN)逐渐降低,试验终末与初始相比减少54%.由图6可知,试验终末,黑藻试验组底泥w(TN)有一定增加,与初始相比增加3.21%.空白组底泥w(TN)同样有所增加,说明水体向底泥的氮迁移量大于输出量.黑藻腐解产生的一部分氮从上覆水中迁移到底泥中,促使底泥 w(TN)有一定增加.同时,底泥及水体中的氮在氨化、硝化和反硝化作用下转化成氧化亚氮进入大气,水体中的氮浓度降低[3].
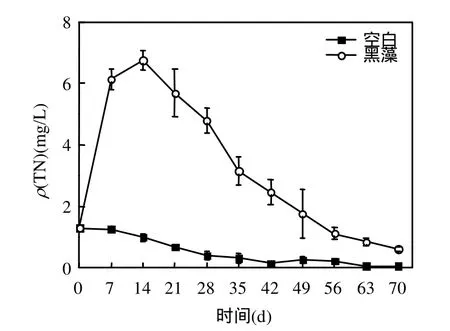
图5 水体ρ(TN)随时间的变化Fig.5 Temporal variation of ρ(TN)in the water
2.5.2 水体无机态氮含量变化 图 7为黑藻腐解过程水体 ρ(-N)的变化过程,其变化趋势与水体氮磷的变化趋势相似,黑藻试验组水体ρ(TN)第 14d达到最大,随后逐渐降低.而ρ(-N)的变化则不同(图 8),含有黑藻的试验组水体 ρ(-N)初期迅速下降,第 7~21d,ρ(-N)均维持在较低水平(0.049~0.065mg/L之间),随后逐渐上升,第 35d达到最大,随后逐渐降低.而空白组ρ(-N)试验开始到21d较稳定,然后逐渐下降.

图6 试验初始和终末底泥w(TN)变化Fig.6 Initial and final w(TN)in the sediment
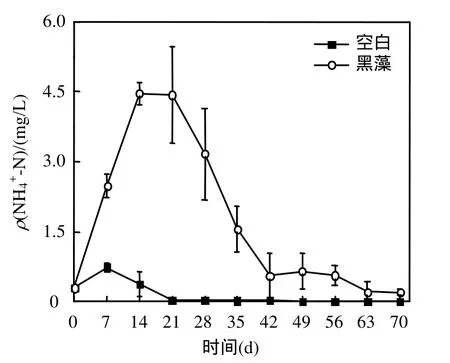
图7 水体ρ(-N)随时间的变化Fig.7 Temporal variation of ρ(-N)in the water
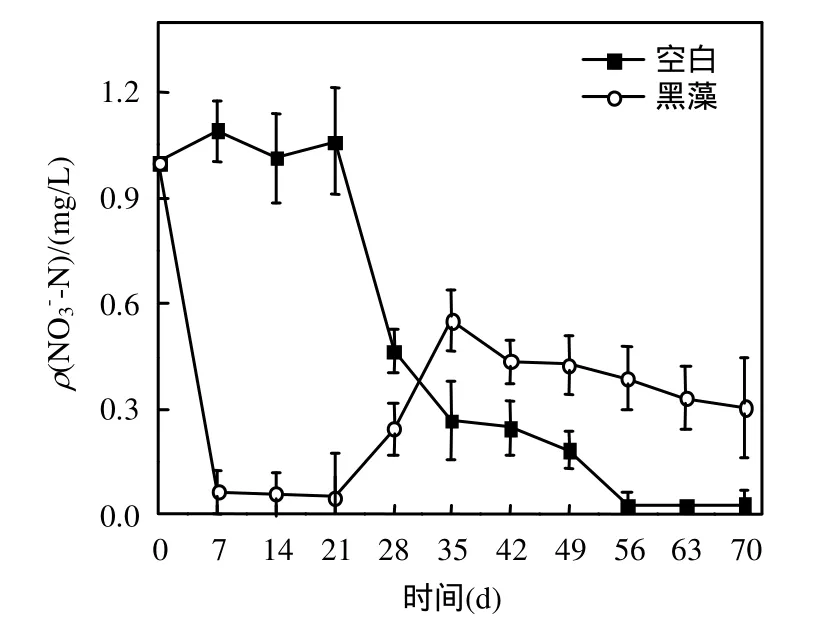
图8 水体ρ(-N)随时间的变化Fig.8 Temporal variation of ρ(N-N)in water
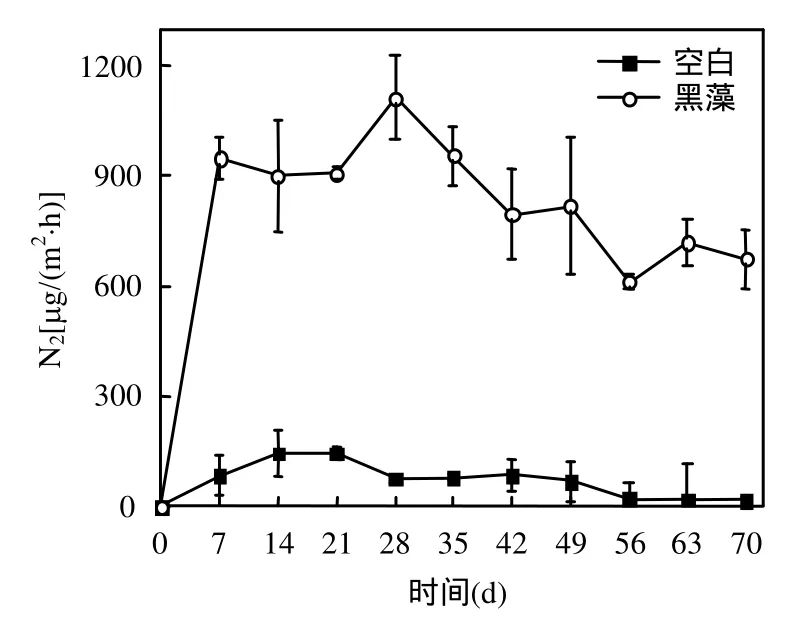
图9 黑藻腐解过程N2释放量的变化Fig.9 Variation of N2 emission during decomposition
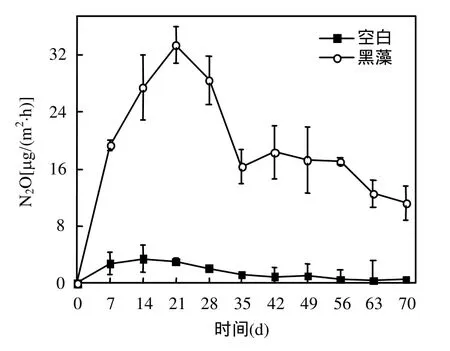
图10 黑藻腐解过程N2O释放量的变化Fig.10 Variation of N2O emission during decomposition
2.5.3 黑藻腐解过程中N2与N2O排放通量 黑藻腐解过程中N2与N2O排放通量的变化如图9、图10所示.含有黑藻的试验组N2以及N2O均分别在第28d和21d时出现一个释放高峰,这与上覆水中的 ρ(-N)的迅速减少(图 8)密切相关,这是由于沉水植物腐解导致系统内氮素的迁移转化活动加快,使N2O的释放加强.
3 讨论
3.1 黑藻腐解过程对水质的影响
水生植物生物质的腐烂分解过程十分复杂,一般认为包括3个过程[13-15]:一是起始阶段水溶性物质的淋溶作用,主要是糖类、有机酸、蛋白质和K、Ca、Mn、Mg等矿物质的释放,其间植物重量损失非常迅速.二是微生物降解有机物阶段,这一步是重量损失的主要阶段.三是一些难分解物质木质素、纤维素等不断积累,植物的进一步分解受到抑制,分解速率明显减慢的阶段.
试验初期黑藻腐烂分解消耗了水体中大量的溶解氧,使上覆水体中ρ(DO)与ORP在试验初期迅速降低,经过显著性差异检验,水体 ρ(DO)与ORP之间均呈极显著正相关关系(P<0.01),结合沉水植物分解过程,发现水体ρ(DO)以及ORP的变化过程与沉水植物分解过程是同步的.在试验中后期,植物腐解过程逐渐减弱,消耗氧气量降低,水体溶解氧逐渐有所上升.表明尽管腐解本身是个耗氧过程,但是腐解过程也不会造成水体ρ(DO)、ORP持续降低,本课题组,在太湖一些区域实地监测水体的 DO变化,发现水体虽然有大量的腐解藻类堆积,但是 ρ(DO)一般都会保持在8.0以上,因为水体是开放性的,大气中的氧气会不断进入水体,因而在腐解后期,当大气复氧增加的DO超过腐解消耗的DO时,会使两者的值又有所回升,而未产生极端的厌氧环境.
有研究表明[16],水生植物经自然腐烂分解后,所含氮、磷的 70%以上会在短期内被释放进入水体,参与水体的营养再循环.本研究中,在分解前期,水体总磷浓度迅速升高.随着分解的进行,水体总磷浓度逐渐下降,可能是因为体系中理化环境的变化,导致部分磷元素向底泥中迁移.磷在水体和底泥之间会发生迁移与转化现象,而且磷的交换和释放是一个非常复杂的生物化学过程,包括磷的生物循环、含磷颗粒的沉降与再悬浮过程、溶解态磷的吸附与解吸附作用、磷酸盐的沉降与溶解等[17].
C是构成植物有机体的主要元素,本研究中黑藻组水体中ρ(TOC)在7~28d较为稳定,原因可能是由于分解初期黑藻存在许多化学性质较稳定、较难溶解的物质[18].
氮在沉积物和水体界面之间也会发生转移.杨龙元等[19]认为,硝化和反硝化作用是沉积物和水界面氮迁移及交换的主要形式.沉积物中有机氮化合物能通过矿化作用,生成、等无机离子释放到上覆水体中;另一方面,上覆水体中的也能反向扩散进入到沉积物中,最后在反硝化细菌的作用下,生成N2、N2O等气体扩散到空气中.本研究发现,试验前期水体总氮浓度迅速上升,而试验结束时,总氮浓度下降到较低水平,这主要是由于随着植物的腐烂,植物体内所含的氮被不断地释放出来,致使总氮浓度升高[20],其中有机氮是主要成分.在植物开始腐烂时,由于水体中溶解氧充足,有机氮易于被氧化成无机氮,因此总无机氮浓度迅速达到一个峰值,随着时间推移,由于植物腐烂耗氧致使水体溶解氧浓度维持较低的水平,使无机氮浓度变化趋于平缓.同时水体中的氮在氨化、硝化和反硝化作用下转化成氧化亚氮进入大气,水体中的氮浓度降低[21].
水体中营养物质在试验初期虽迅速上升,在试验中后期又逐渐下降,经过单因素(P≤0.05)分析碳、氮、磷之间的浓度变化均不具有相关性.表明黑藻腐解过程中,各营养元素对水环境的影响有不同的表现规律.营养元素在水体中循环主要受以下二方面影响,第一是底泥的吸附作用.有研究表明[22-24],底泥对上覆水营养物质有很强的吸附以及截留作进用.本试验测定了初始与终末底泥中的营养盐含量的变化,发现底泥终末的碳、氮、磷含量对比初始值分别增加了4.86%、3.31%和3.32%.表明黑藻腐解产生的营养盐并未全部滞留在水体中,而是向底泥迁移.第二是微生物作用.部分碳、氮在微生物作用下会以气体形式逸出水环境[25].本试验监测了N2与 N2O在整个试验过程的通量变化.随着黑藻的腐解,ρ(DO)与ORP的降低而产生的厌氧环境以及黑藻腐解提供的 TOC,促进了反硝化细菌等微生物生长,提高了反硝化过程,有利于生成 N2与 N2O,使试验后期水体的氮浓度降低.水体以及底泥中的有机质可以在微生物的作用下分解为 CH4、CO2逸出水体,减少水体以及底泥中的有机质含量[26].磷的释放率高于氮和碳,主要原因是沉水植物腐解后释放的磷多以磷酸盐形式存在,且存在于易分解的活性物质中,比较难分解的结构物质纤维素、多糖等含磷很少[27].
3.2 不同沉水植物腐解过程及营养盐释放差异
不同沉水植物的腐烂分解过程及营养盐释放规律存在较大差异.对照本试验室前期研究的另一种沉水植物苦草的腐解过程,发现黑藻的分解率(76.56%)明显高于相同条件下苦草(23.66%)的分解率[28].黑藻、苦草腐解过程中,水体ρ(DO)、ORP随时间变化趋势相似,但苦草组与黑藻组ρ(DO)、ORP值之间并无显著差异(P>0.05).试验终末时水体ρ(TP)黑藻组是苦草组的1.5倍;黑藻组ρ(TN)是苦草组的2.41倍;苦草以及黑藻试验组 ρ(TOC)仅相差 0.44mg/L,差异不大.沉水植物腐解率的大小与植物碳氮浓度密切相关[29],本试验通过相关性分析,也得到植物的分解率与氮浓度呈极显著正相关(P<0.01),和碳浓度、碳氮比呈极显著负相关关系(P<0.01).苦草中木质素以及纤维素含量高于黑藻,而木质素以及纤维素是植物碳的主要形态,苦草的碳氮比值明显高于黑藻,这是造成黑藻的分解率大于苦草的主要原因.
4 结论
4.1 春初温度下黑藻在70d的试验周期内分解率较高(76.56%),碳、氮、磷等营养物质释放率分别为81.31%、81.62%、85.94%.
4.2 黑藻腐解过程中,水体中的部分营养元素被底泥吸附,沉积进入底泥中,试验终末,底泥中碳、氮、磷含量分别增加了 4.86%、3.31%和3.32%.
4.3 黑藻腐解过程中,水体中碳、氮、磷含量均呈先上升后下降的变化规律.碳、氮除一部分沉积进底泥,还有部分以气体的形式逸出水体.
4.4 黑藻腐解率较高,必须控制其残留生物量,以避免过多的黑藻残体因腐解而对水体产生二次污染.
[1]徐德兰,刘正文,雷泽湘.大型水生植物对湖泊生态修复的作用机制研究进展 [J]. 长江大学学报(农学卷), 2005,25(1):14-18.
[2]童昌华,杨肖娥,濮培民.水生植物控制湖泊底泥营养盐释放的效果与机理 [J]. 农业环境科学学报, 2003,22(6):673-676.
[3]潘慧云,徐小花,高士祥.沉水植物衰亡过程营养盐的释放过程及规律 [J]. 环境科学研究, 2008,21(1):64-68.
[4]国家环境保护总局《水和废水监测分析方法》编委会.水和废水监测分析方法 [M]. 北京:中国环境科学出版社, 2002:243-284.
[5]中国科学院南京土壤研究所.土壤理化分析 [M]. 上海:上海科学技术出版社,1978:204-262.
[6]顾久君,金朝晖,刘振英.乌梁素海沉水植物腐烂分解试验研究[J]. 干旱区资源与环境, 2008,22(4):181-184.
[7]臧淑梅.水中溶解氧的变化规律及其影响 [J]. 黑龙江水产,2012,22:39-40
[8]李雪英,骆敏聪,孙省利.湛江特呈岛红树林区底泥 TOC的释放研究 [J]. 环境科学与技术, 2011,34(1):34-37.
[9]Reddykr, Sacco P D. Decomposition of water hyacinth in agricultural drainage water [J]. Environ. Qual., 1981,10(2):228-234.
[10]Shillad D, Asaedat T, Fujinot T. Decomposition of dominant submerged macrophytes: implications for nutrient release in Myall Lake, NSW, Australia [J]. Wetlands Ecology and Management, 2006,14: 427-433.
[11]Bastardo H.Laboratory studies on decomposition of littoral plants[J]. Archiv für Hydrobiologie, 1979,26(7):267-299.
[12]Bastviken S K, Eriksson P G. Potential denitrification in wetland sediments with different plant species detritus [J]. Eco-logical Engineering, 2005,25(2):183-190.
[13]Howard-Williams C, Davies B R. The rates of dry matter and nutrient loss from decomposing Potamogeton pectinatus in a brackish south-temperate coastal lake [J]. Freshwater Biology,1979,9(1):13-21
[14]杨继松,刘景双,于君宝.三江平原小叶章湿地枯落物分解及主要元素变化动态 [J]. 生态学杂志, 2006,25(6):597-602
[15]顾久君,金朝晖,刘振英.乌梁素海沉水植物腐烂分解试验研究[J]. 干旱区资源与环境, 2008,22(4):181-184
[16]Shilla D, Fujino T, Sanderson B. Decomposition of dominant submerged macrophytes: Implications for nutrient release in Myall Lake, NSW, Australia [J]. Wetlands Ecology and Management, 2006,14(5):427-433
[17]陈永川,汤 利.沉积物-水体界面氮磷的迁移转化规律研究进展 [J]. 云南农业大学学报, 2005,20(4):527-531
[18]叶 春,王 博.沉水植物黑藻早期分解过程及影响因素研究[J]. 中国农学通报, 2009,25(17):260-264
[19]杨龙元,蔡启明,秦伯强.太湖梅梁湾沉积物-水界面氮迁移特征初步研究 [J]. 湖泊科学, 1998, 10(4):41-47
[20]Reddy K R, Sacco P D. Decomposition of water hyacinth in agricultural drainage water [J]. Environ. Qual., 1981,10(2):228-234.
[21]潘慧云,徐小花,高士祥.沉水植物衰亡过程中营养盐的释放过程及规律 [J]. 环境科学研究, 2008,21(1):64-68.
[22]厉恩华,刘贵华,李 伟.洪湖三种水生植物的分解速率及氮、磷动态 [J]. 中国环境科学, 2006,26(6):667-671.
[23]Hu D, Cai L, Chen H. Fungal diversity on submerged wood in a tropical stream and an artificial lake [J]. Biodiversity and Conservation, 2010,19(13):3799.
[24]Pettit N, Davies T, Fellman J. Leaf litter chemistry, decomposition and assimilation by macroinvertebrates in two tropical streams [J].Hydrobiologia, 2012,680(1):63.
[25]Sarneel J, Geurts J, Beltman B. The effect of nutrient enrichment of either the bank or the surface water on shoreline vegetation and decomposition [J]. Ecosystems, 2010,13(8):1275.
[26]李 静,尹澄清,王为东.表流湿地冬季运行效果及植物腐烂影响的初步研究 [J]. 农业环境科学学报, 2008,27(4):1482-1488.
[27]李小龙.铜绿微囊藻 (Microcystis aeruginosa)和玫瑰拟衣藻(Chloromonasrosae)光合作用特征、营养生长动力学及相互竞争研究 [D].北京:中国科学院研究生院, 2006.
[28]王 博,叶 春,李春华,等.初春苦草腐解过程中营养盐释放过程及规律 [J]. 生态与农村环境学报, 2012,28(2):171-75.
[29]温达志,魏 平,张佑昌.鼎湖山南亚热带森林细根分解干燥物质损失和元素动态 [J]. 生态学杂志, 1998,17(2):1-6.
Nutrient release process during decomposition of submerged macrophytes (Hydrilla verticillata Royle).
YE Chun1*,WANG Bo1,2,3, LI Chun-hua1, YE Bin4, JIANG Yuan3, KONG Xiang-long1(1.State Key Laboratory of Environmental Criteria and Risk Assessment, Centre of Lake Engineering and Technology, Chinese Research Academy of Environmental Sciences, Beijing 100012, China;2.Institute of Eco-environmental Sciences, Liaoning Shihua University, Fushun 113001,China;3.College of Resources Science and Technology, Beijing Normal University, Beijing 100875;4.Appraisal Center for Environment and Engineering, Ministry of Environmental Protection, Beijing 100012, China). China Environmental Science, 2014,34(10):2653~2659
The decaying process of submerged macrophytes (Hydrilla verticillata)was simulated in laboratory. Results showed that the plant decayed rapidly and released a lot of nutrients C (81.31%), N(81.62 %)and P (85.94%)into the water at the beginning of experiment. After a period of time, most of the phosphorus and part of nitrogen was released into sediment, whereas part of nitrogen escaped out of the water as gas. The decomposition of plant released large amounts of organic carbon making the water anaerobic. Both of the anaerobic conditions resulted from decomposition and high TOC supply are benefitial to nitrogen removal by denitrification. However, the larger biomass residues of submerged plants should be controlled to avoid secondary pollution caused by excessive decomposition of submerged plants.
submerged macrophyte;Hydrilla verticillata Royle;decomposition;nutrient;aquatic ecology
X524
A
1000-6923(2014)10-2653-07
2013-12-30
国家自然科学基金项目(40971277);国家水体污染与治理科技重大专项(2012ZX07101-009)
* 责任作者, 研究员, yechbj@163.com
叶 春(1970-),男,江西九江人,研究员,博士,主要从事湖泊富营养化控制和水生态系统修复.发表论文90余篇.
