介孔Ce1-xLaxO2复合氧化物的合成及其催化性能
2014-12-09马娟宁陈志刚张玉珠王盟盟
马娟宁,陈志刚,张玉珠,徐 政,王盟盟
(1.江苏大学材料科学与工程学院,镇江212013;2.苏州科技学院化学生物与材料工程学院,苏州215011)
0 引 言
CeO2独特的结构使其具有特殊的性能,在抛光、发光、紫外线吸收和催化等方面得到了广泛应用,可用于气体传感器、燃料电池、功能陶瓷等方面[1-10]。近年来,关于CeO2固溶体和复合氧化物提高催化性能的报道较多,如,刘成文等[11]采用柠檬酸溶胶-凝胶法和微波技术制备了Ce1-xFexO2复合氧化物,以甲烷催化燃烧为探针反应测定了催化剂的活性,结果说明Ce1-xFexO2固溶体的甲烷催化燃烧活性高于单组分CeO2的,且随着x的不同而变化,其中以Ce0.9Fe0.1O2固溶体的催化活性最高;单文娟等[12]采用溶剂热法经乙二醇水解,制备出了Ce-Cu(x)-O纳米晶体簇,该系列试样在CO催化氧化反应中具有较高的催化活性,在130℃左右CO的转化率为50%;Putna等[13]将少量氧化钐掺入介孔CeO2中用做燃料电池电极,该电极显示出了极好的催化活性;Reddy等[14]将镧掺入CeO2中,合成了 Ce0.8La0.2O1.8固溶体纳米材料,该纳米材料的化学储氧量较纯CeO2的有较大提高,且其在低温下的催化活性更高。目前,关于La3+掺杂CeO2的研究报道较少。鉴于此,作者采用溶剂诱导自组装法制备了介孔Ce1-xLaxO2复合氧化物,并研究了它的结构、形貌和催化性能。
1 试样制备与试验方法
1.1 试样制备
将1g三嵌段共聚物P123溶于15mL无水乙醇与5mL去离子水组成的混合溶液中,在常温下搅拌均匀后加入0.005mol的乙酸铈、乙酸镧混合物(乙酸镧分别为0,0.000 5,0.001,0.001 5mol),搅拌均匀后,转移至直径为10cm的玻璃培养皿中,得到乳白色溶胶薄膜;随后在40℃的烘箱中保温72h,取出后获得干凝胶;再在400℃下煅烧6h以去除模板剂,获得介孔Ce1-xLaxO2复合氧化物粉体。
保持其它合成参数不变,将乙酸铈、乙酸镧混合物改为纯0.005mol乙酸镧,合成参比La2O3产物。
1.2 试验方法
用D/max2500PC型X射线衍射仪(XRD)测介孔Ce1-xLaxO2复合氧化物的物相;用JEM-2100型透射电镜(TEM)观察Ce1-xLaxO2粉体的形貌并测粒径,工作电压为200kV;用ASAP-2010C型自动吸附仪在77K的液氮下进行吸附测定,根据测得的吸附等温曲线采用BET法计算比表面积,用BJH模型拟合吸附等温线得到纳米级孔径分布;在TP-5000型多用吸附仪上测纯CeO2、纯La2O3以及介孔Ce1-xLaxO2复合氧化物的H2-TPR(氢气程序控温还原)谱,升温速率为10℃·min-1,试样用量为100mg。
催化试验:取质量浓度为40mg·L-1的亚甲基蓝溶液400mL置于玻璃反应器中,再将它们一起置于XPA型系列光化学反应仪中,然后加入2mL质量分数为30%的H2O2溶液和0.2g介孔Ce1-xLaxO2复合氧化物做为催化剂,将功率300W的紫外灯插入玻璃反应器中进行光催化反应;每隔一段时间取样,经离心后取上层清液,用UV2450型紫外-可见分光光度计在664nm处测其吸光度,并根据式(1)计算脱色率D。
D=(1-A/A0)×100% (1)
式中:A0和A分别为处理前后亚甲基蓝溶液的吸光度。
另将纯CeO2作为催化剂进行催化试验,试验方法同上。
2 试验结果与讨论
2.1 XRD谱
众所周知,乙酸镧和乙酸铈加入P123+无水乙醇+去离子水的混合溶液中后会生成La2O3和CeO2。从图 1 可以看出,在 2θ为 28.6°,33.1°,47.4°,56.3°,69.5°,76.6°时 的 衍 射 峰 分 别 对 应CeO2的(111)、(200)、(220)、(311)、(400)和(331)晶面,与立方相CeO2的XRD特征衍射峰相吻合。这说明生成的La2O3进入到了CeO2晶格中形成了固溶体,也可能是生成的La2O3较少,低于XRD的检测范围而无法被检测出,具体原因还需更进一步研究。另外,随着镧含量的增加,衍射峰强度逐渐降低并宽化,这说明向CeO2中掺入少量La2O3对烧结过程具有抑制作用,可使CeO2晶粒尺寸减小;当x大于0.2时,随着镧含量的增加,Ce1-xLaxO2复合氧化物的晶粒尺寸反而不断增大。
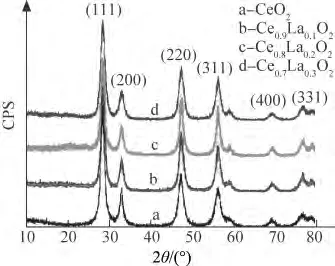
图1 介孔Ce1-xLaxO2的XRD谱Fig.1 XRD patterns of the mesoporous Ce1-xLaxO2
2.2 孔结构
由图2可知,介孔Ce1-xLaxO2复合氧化物的吸脱附等温线为IV型,带有H4型回滞环,是典型介孔材料的特征等温线;另外,它们的孔径分布较窄,集中分布在3.0nm左右。介孔Ce1-xLaxO2复合氧化物比表面积的平均值为90m2·g-1(图略)。
2.3 TEM形貌
从图3中可以看出,纯CeO2为蠕虫状多孔结构,孔道结构由堆积孔形成,其选区电子衍射花样为典型的单晶点阵结构。当x=0.1和x=0.2时,CeO2的蠕虫状孔结构没有改变,孔近似为二维六方结构,这与三嵌段共聚物P123在溶液中聚集形成的六方堆积结构相对应;不同的是x=0.2时选区衍射花样的点阵发生了畸变,这可能与镧的掺杂有关,因为La3+的半径比Ce4+大,掺杂时可能会造成晶格畸变,从而最终导致选区点阵发生畸变。当x=0.3时,从电子衍射花样可以看出,Ce0.7La0.3O2逐渐呈现向多晶演化的趋势,原因在于多余的La2O3可能以单相的形式在晶界处析出形成异质晶粒,产物为Ce1-xLaxO2固溶体和La2O3的复合物,影响原有的定向排列结构,使晶粒取向不再完全一致,逐渐呈现向多晶演化的趋势。
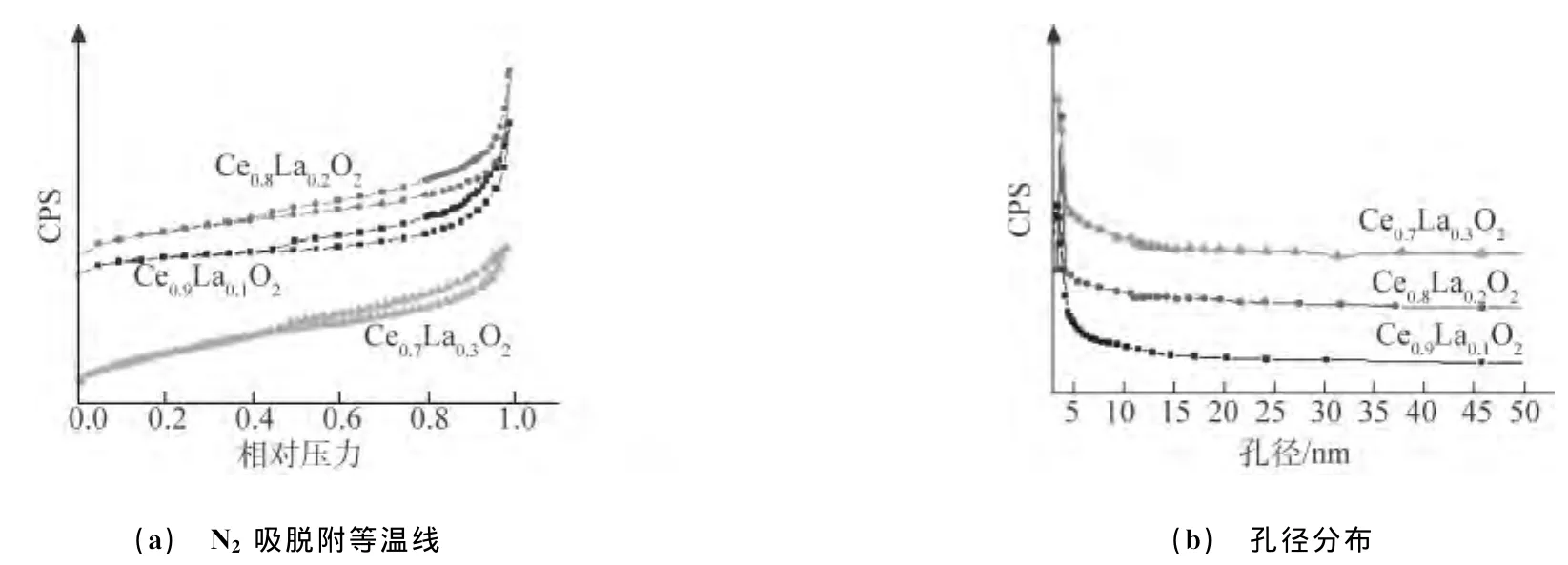
图2 介孔Ce1-xLaxO2复合氧化物的N2吸脱附等温线和孔径分布Fig.2 Nitrogen adsorption-desorption isotherm plots(a)and corresponding pore size distribution plots(b)of mesoporous Ce1-xLaxO2composite oxide materials

图3 介孔Ce1-xLaxO2复合氧化物的TEM形貌和电子衍射花样Fig.3 TEM morphology and electron diffraction patterns of mesoporous Ce1-xLaxO2composite oxide materials
2.4 H2-TPR谱
从图4可见,纯La2O3在650℃出现了尖锐的还原峰,说明其高温活性氧含量较高,储氧能力强。纯CeO2分别在450℃和760℃各出现了1个还原峰,450℃左右的还原峰归于表面氧的还原,760℃左右的还原峰对应于体相氧的还原。这是因为表面氧具有更高的活性,所以能在低温下被还原,而体相氧由于活性相对较低,故需在高温下还原。由于La2O3的掺 杂,Ce0.9La0.1O2在600 ℃ 出 现 了 还 原峰;另外,Ce0.9La0.1O2还原峰的面 积 比 纯 CeO2的大,固溶体提供了更多的低温还原氧,材料的低温催化 活 性 更 强。Ce0.8La0.2O2还 原 峰 的 面 积 与Ce0.9La0.1O2的相差不大,而 Ce0.7La0.3O2还原峰的面积比前两者的都大,且更为尖锐,同时表面氧和体相氧的还原峰温度都向低温方向移动,说明掺杂使得试样表面出现了更多的氧空位。
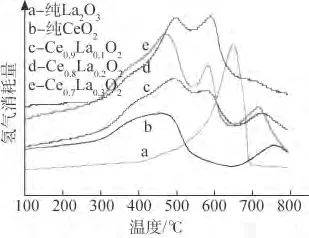
图4 纯La2O3、纯CeO2和介孔Ce1-xLaxO2复合氧化物的H2-TPR谱Fig.4 H2-TPR patterns of pure La2O3,pure CeO2 and mesoporous Ce1-xLaxO2composite oxide material
2.5 催化性能
由图5可知,纯CeO2的催化速率相对最低,反应65min时的脱色 率 才 为100%;Ce0.7La0.3O2的催化速率最快,反应30min时的脱色率几乎接近100%。可见,随着镧掺杂量的增加,Ce1-xLaxO2的催化速率也在增加。制得的Ce1-xLaxO2复合氧化物具有良好的吸附性能和较高的催化活性,这归因于它的结构和形貌,颗粒尺寸小、比表面积大、孔径分布均匀、氧空位多等都有利于它的催化活性。
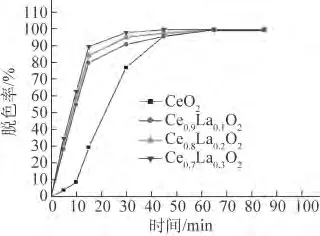
图5 纯CeO2和介孔Ce1-xLaxO2对亚甲基蓝溶液的脱色率Fig.5 Decolorizing rate of pure CeO2and mesoporous Ce1-xLaxO2 composite oxide materials on methylene blue solution
3 结 论
(1)以P123为模板,乙酸盐为原料,采用溶剂诱导自组装法合成了介孔Ce1-xLaxO2复合氧化物;当x=0.1和x=0.2时,产物为单一立方结构固溶体Ce1-xLaxO2,当x=0.3时产物为Ce1-xLaxO2固溶体和La2O3的复合物。
(2)镧的掺杂有利于提供更多的低温活性氧,镧含量越多,表面活性氧越多,固溶体材料的低温催化活性越高。
(3)镧含量越多,催化速率越高;反应30min后,Ce0.7La0.3O2对400mL 质 量 浓 度 为40mg·L-1亚甲基蓝溶液的脱色率几乎达到了100%。
[1]ZHANG Y,SI R,LIAO C,et al.Facile alcohothermal synthesis,size-dependent ultraviolet absorption,and enhanced CO conversiona ctivity of ceria nanocrystals[J].J Phys Chem:B,2003,107:10159-10167.
[2]VOHS J M,FENG T,WONG G S.Comparison of the reactivity of high-surface area,monolayer vanadia/ceria catalysts with vanadia/CeO2(111)model systems[J].Catal Today,2003,85(2/4):303-309.
[3]LAOSIRIPOJANA N,ASSABUMRUNGRAT S.Catalytic steam reforming of ethanol over high surface area CeO2:the role of CeO2as aninternalpre-reformingcatalyst[J].Appl Catal:B,2006,66:29-39.
[4]ZHAI Y Q,ZHANG S Y,PANG H.Preparation,characterization and photocatalytic activity of CeO2nanocrystalline using ammonium bicarbonate as precipitant[J].Mater Lett,2007,61:1863-1866.
[5]CAMPO B,MARíA V,IVANOVA S,et al.Selective hydrogenation of crotonaldehyde on Au/HAS-CeO2catalysts[J].J Catal,2006,242:162-171.
[6]KAODEE W,JONGSOMJIT B,ASSABUMRUNGRAT S,et al.Investigation of isosynthesis via CO hydrogenation over ZrO2and CeO2catalysts:effects of crystallite size,phase composition and acid-base sites[J].Catal Commun,2006,8(3):548-556.
[7]LIN S S,CHEN C L,CHANG D J,et al.Catalytic wet air oxidation of phenol by various CeO2Catalysts[J].Water Res,2002,36(12):3009-3014.
[8]FENG X D,SAYLE D C,WANG Z L,et al.Converting ceria polyhedral into single-crystal nanospheres[J].Science,2006,312:1504-1510.
[9]NORIYA I,WOOSUCK S,NORIMITSU M.Fast response of resistive-type oxygen gas sensors based on nano-sized ceria power[J].Sensors and Actuators:B,2003,93:449-453.
[10]BRETT D J,ATKINSON A,CUMMING D,et al.Methanol as a direct fuel in intermediate temperature(500-600 ℃)solid oxide fuel cells with copper based anodes[J].Chemical Engineering Science,2005,60:5649-5662.
[11]刘成文,罗来涛,赵旭.Ce1-xFexO2复合氧化物催化剂的制备及其对甲烷的催化燃烧性能[J].化学研究与应用,2007,19(4):401-404.
[12]单文娟,魏玲玲,董晓薇,等.类球形Ce-Cu(x)-O纳米晶体簇催化性能及表征[J].大庆石油学院学报,2011,35(2):82-85.
[13]MORI T,DRENNAN J,WANG Y R.Influence of nanostructure on electrolytic properties in CeO2based system[J].J Therm Anal Calorim,2002,70:309-319.
[14]BENJARAM,REDDY M,LAKSHMI K,et al.Novel nanocrystalline Ce1-xLaxO2-δ(x=0.2)solid solutions:structural characteristics and catalytic performance[J].Chem Mater,2010,22:467-475.
