放射线诱导的HtrA2基因表达对人葡萄膜黑色素OCM-1细胞的影响
2014-12-06雷荣李娟余天张帆
雷荣 李娟 余天 张帆
1.武汉爱尔眼科医院泪道科,湖北 武汉 430063;
2.华中科技大学同济医学院附属协和医院干细胞中心,湖北 武汉 430022;
3.华中科技大学同济医学院附属同济医院骨科,湖北 武汉 430030
葡萄膜黑色素瘤是人眼内肿瘤中最常见的恶性肿瘤之一[1],90%来源于人眼脉络膜[2]。随着近年来诊疗水平的不断提高,以保留眼球为前提的综合治疗已取得显著的疗效,其中放射治疗是葡萄膜黑色素瘤最常用的方法之一[3]。近年发现的Omi/HtrA2是存在于线粒体膜间隙的前凋亡分子,在促凋亡信号诱导下,Omi/HtrA2由线粒体释放到细胞质,并通过抑制凋亡蛋白抑制因子家族(inhibitor of apoptosis proteins,IAPs)、活化半胱氨酸-天冬氨酸蛋白酶和丝氨酸蛋白酶途径促凋亡[4]。早期生长反应基因1(early growth response-1,Egr-1)的调控序列中一段特定结构可感受细胞内外的理化刺激如自由基、电离辐射等[5],继而诱导下游基因表达。我们通过脂质体将pEgr1-HtrA2质粒转染入葡萄膜黑色素瘤细胞系OCM-1,结合放射线干预(radiation treatment,RT),诱导Omi/HtrA2表达,探讨通过诱导基因杀伤治疗葡萄膜黑色素瘤的可能。
1 材料和方法
1.1 质粒的构建
pIRES-Egr1(pEgr1)和pEgr1-HtrA2质粒根据孙教授等[6]的研究设计。pEgr1、pEgr1-H trA2和pCMV-HtrA2质粒由武汉晶赛公司构建、纯化并鉴定。
1.2 细胞培养和转染
人眼葡萄膜黑色素瘤OCM-1细胞本实验室常规保存,培养条件:DMEM/F12培养基(美国Invitrogen公司),添加10%胎牛血清(美国Hyclone公司),100 kU/L青霉素-G,100 mg/L链霉素(美国Gibco公司),在37 ℃,CO2体积分数为5%的培养箱中培养。
细胞接种于6 孔板,当细胞密度达到80%~90%时换成OPTI-MEM培养基,并用LipofectamineTM2000 (美国Invitrogen公司)分别转染质粒pEgr1、pCMV-HtrA2和pEgr1-HtrA2,转染步骤按说明书进行。转染4 h后换液,改用DMEM/F12培养基培养36 h用于相关指标检测。在浓度为600 μg/mL G418中培养筛选出稳定转染的质粒。
1.3 放射条件
采用西门子直线加速器的X射线照射(6 MeV X射线,距离100 cm,2 Gy/min)。
转染质粒的各组细胞培养48 h,给予不同剂量的放射照射,继续培养24 h后用于相关指标检测。移植瘤的局部给予放射线照射,隔日1次,共3次。
1.4 实时定量PCR
用TRIzol(美国Invitrogen公司)法提取总RNA。将100~500 ng总RNA用cDNA合成试剂盒(日本TOYOBO公司)反转录合成cDNA。实时定量PCR在LightCycler(Roche)机器上运行,并用SYBR Green Real-time PCR Master Mix-Plus(日本TOYOBO公司)试剂盒。PCR反应条件:95 ℃预变性10 min,95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸10 s,共40个循环。分别扩增HtrA2和内参GAPDH基因。HtrA2的上游引物为5’-CTAGCTAGCGCC ACCATGGCTGCGCCGAGGGC-3’,下游引物为5’-CGACGCGTTCATTCTGTGAC C T C A G G G G T C A C A-3’。G A P D H的 上 游 引 物 为5 ’ - G A A G G T G A A G G T C G G A G T C-3’,下游引物为5’-G A A G ATGGTGATGGGATTTC-3’。以GAPDH基因作为参照,利用ΔΔCT法计算相对变化量。
1.5 蛋白质印迹法(Western blot)检测HtrA2蛋白表达量
收集各组细胞用R I PA 裂解液(加拿大ProMab生物公司)提取总蛋白,用BCA法测定蛋白浓度。分别将提取的各个样品的50 μg蛋白行8%SDS-PAGE电泳。电转移印迹到PVDF膜,封闭后,分别加入Omi/HtrA2小鼠抗人抗体(美国Abcam公司,1∶500)、β-actin克隆抗体(美国Abcam公司,1∶333)、温育、洗涤、添加二抗(美国KPL公司,1∶3 000)。底物发光试剂盒SuperSignal蛋白质检测试剂盒购自Pierce公司。以β-actin作为参照,相对计算条带的灰度值。实验至少重复3次。
1.6 克隆形成实验
各组呈对数生长的单层细胞分别予以0、2、4、6、8、10 Gy剂量的X线照射。将各组照射后的细胞以适当数量接种到培养瓶中。培养2周后,固定,结晶紫染色细胞。在显微镜(低倍镜)计数>50个细胞的克隆数。最后计算克隆形成率。克隆形成率=克隆数/接种细胞数×100%。实验重复3次。
1.7 流式细胞仪检测细胞凋亡
采用Annexin Ⅴ-FITC/PI(美国Becton公司)双标记法进行流式细胞仪分析细胞凋亡。胰蛋白酶消化法收集各组细胞,80%乙醇4 ℃过夜。染色标记根据说明书步骤进行后立即上流式细胞仪检测。采用Cellq uest软件分析。实验重复3次。
1.8 动物实验
OCM-1细胞(含1×107细胞的0.2 mL无菌0.9%NaCl溶液悬液)注射入裸小鼠的右后肢皮下制作移植瘤模型,肿瘤体积达300 mm3的小鼠用于下一步实验。将移植瘤模型小鼠分为对照组、放射组、基因组以及基因放射组,每组10只。基因组和基因放射组移植瘤内注射pEgr1和pEgr1-HtrA2质粒(100 μL含20 μg质粒和40 μg LipofectamineTM2000的混合物)。放射组和基因放射组小鼠局部给予8 Gy和4 Gy照射,隔日1次,共3次。质粒分别从4个方向注入肿块,防止泄漏。小鼠于无菌环境下饲养。肿瘤体积运用公式0.54×长(mm)×宽(mm)×高(mm),电脑断层扫描测量后计算。肿瘤体积每周测2次。
1.9 统计学处理
2 结 果
2.1 不同X-ray剂量下HtrA2基因表达情况
将转染pEgr1、pEgr1-HtrA2或pCMV-HtrA2质粒的各组细胞培养48 h,给予0、2、4、8和12 Gy不同剂量的放射照射。24 h后检测HtrA2 mRNA表达。随着放射剂量的增加,pEgr1-HtrA2组HtrA2 mRNA表达较照射前增加,呈剂量依耐性,4 Gy时显著增加,在8 Gy时达到最高值,较照射前增加15倍(P<0.05),pCMVHtrA2组HtrA2 mRNA表达较照射前轻度下降,与放射剂量无明显关系,pEgr1组HtrA2 mRNA表达无明显变化(P>0.05,图1A)。Western blot检测8 Gy照射后的各组细胞HtrA2蛋白表达情况。pEgr1-HtrA2组HtrA2蛋白较照射前明显增加(P<0.05),pCMV-HtrA2组HtrA2蛋白较照射前无明显变化(P<0.05,图1B)。结果显示放射线能够有效启动Egr1以及其下游的基因表达。
2.2 HtrA2基因对放射敏感性的影响
检测转染不同质粒的OCM-1细胞在0、2、4、6、8和10 Gy不同剂量X射线照射后的克隆数,计算各组克隆形成率。可见pEgr1-HtrA2组和pCMV-HtrA2组随放射剂量增加克隆形成率下降,且均较pEgr1组低(P<0.05,图2)。说明转染pEgr1-HtrA2质粒后可增强OCM-1细胞放射敏感性。
2.3 流式细胞仪检测细胞凋亡
将转染pEgr1、pEgr1-HtrA2或pCMV-HtrA2质粒的各组细胞培养48 h或给予8 Gy放射照射后培养24 h,Annexin Ⅴ-FITC/PI双染流式细胞仪凋亡检测。pEgr1-HtrA2联合放射组和pCMVHtrA2联合放射组细胞凋亡率分别为(40.2±5.9)%和(37.7±6.0)%,较pEgr1、pEgr1-HtrA2及pEgr1联合放射组明显增加,差异有统计学意义(P<0.05)。pCMV-HtrA2组与pCMV-HtrA2联合放射组细胞凋亡率差异无统计学意义(P>0.05,图3)。
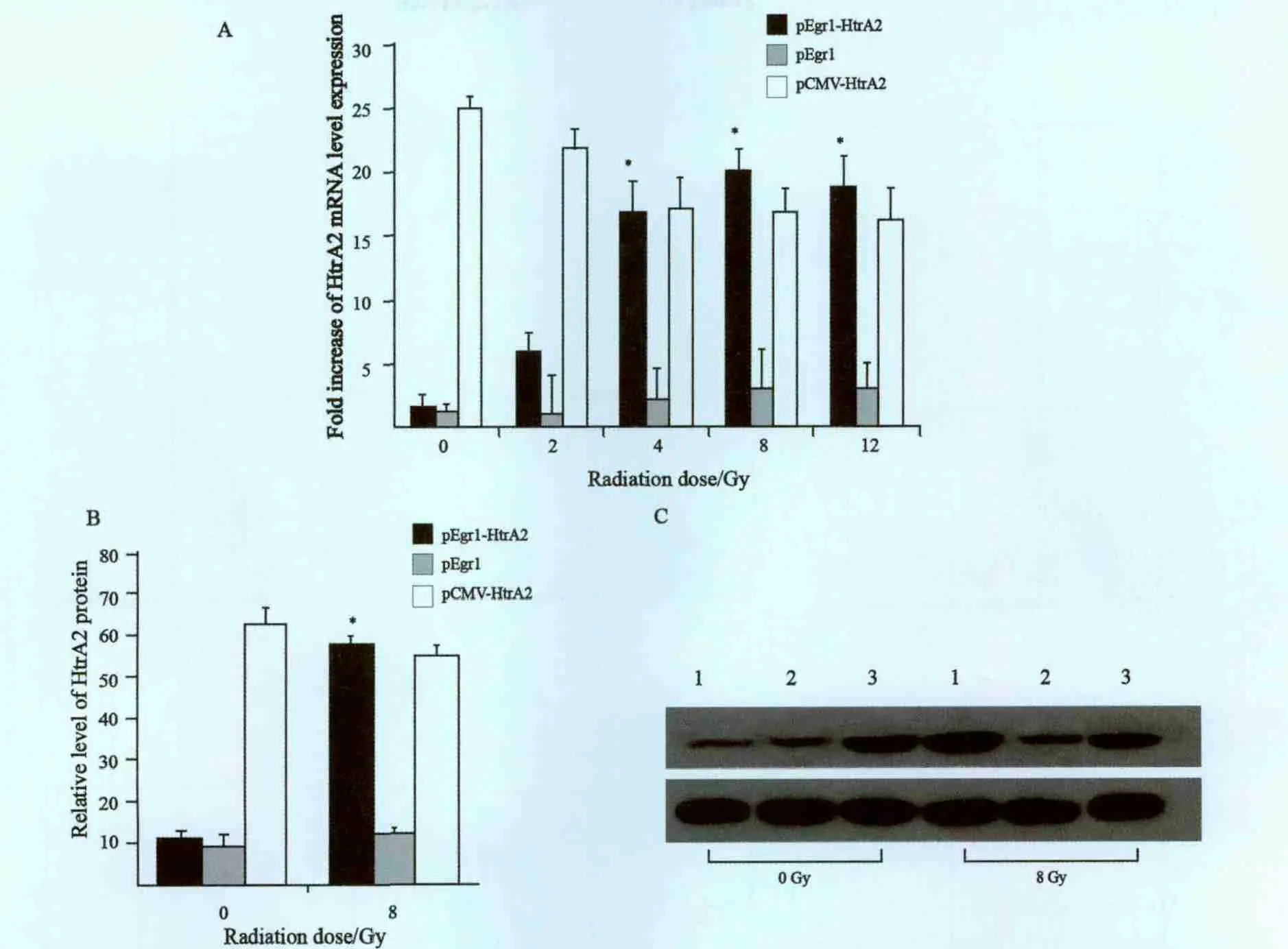
图1 qRT-PCR和Western blot法检测HtrA2 mRNA和蛋白表达Fig.1 Detection of mRNA and protein expression of HtrA2 by qRT-PCR and Western blot
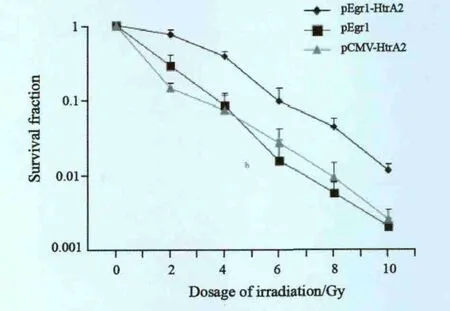
图2 克隆形成实验检测细胞生存率Fig.2 Clonogenic survival after various doses of irradiation exposure
2.4 动物实验
质粒分别注射入移植瘤模型局部后给予8或4 Gy的放射线照射,隔日1次,共3次,总剂量分别达24和12 Gy。定期记录肿瘤体积。pEgr1-HtrA2联合放射组第10天起肿瘤开始缩小,更长时间观察未见肿瘤体积增大,在40 d时有5只小鼠的移植瘤缩小至触摸不清,无法测量,与其他组比较,差异有统计学意义(P<0.05,图4A)。pEgr1和pEgr1-HtrA2组移植瘤快速生长,pEgr1联合放射和单纯放射组肿瘤早期暂时缩小,但从第20天开始迅速生长。
在pEgr1-HtrA2联合4 Gy放射组长时间观察未见移植瘤的体积增大,也未见肿瘤破溃、出血、结痂、死亡。30 d时1只实验小鼠的移植瘤缩小至触摸不清。在单纯4 Gy照射组,肿瘤体积继续增大(图4B)。说明较低剂量放射线结合基因能够达到抑制肿瘤生长的作用。
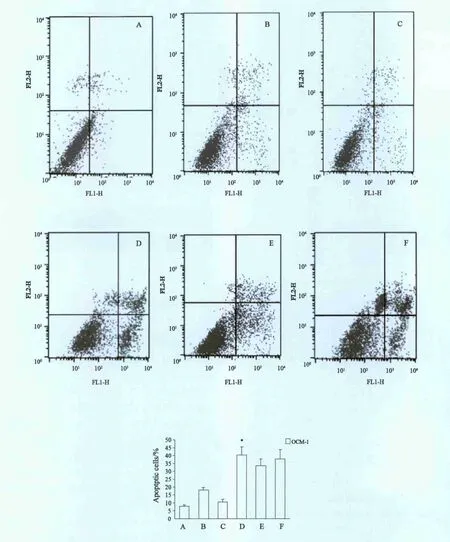
图3 流式细胞仪检测细胞凋亡Fig.3 Detection of the apoptosis by fl ow cytometry
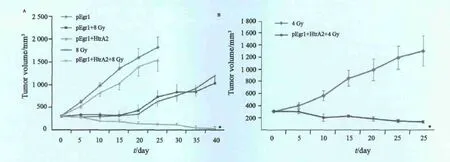
图4 动物实验中pEgr1-HtrA2联合放射对葡萄膜黑色素瘤的影响Fig.4 Effects of pEgr1-HtrA2 gene therapy combined with radiation in vivo
3 讨 论
肿瘤治疗的肿瘤基因-放射治疗是将经射线诱导表达并对肿瘤具有杀伤作用的基因转入肿瘤细胞,然后对肿瘤实施放疗,同时诱导基因表达,通过射线和基因的双重作用杀伤肿瘤,为解决肿瘤放疗的不良反应开辟了新途径[7]。Egr-1正是含有此类调控序列的基因的典型代表[8-9],属于立早基因家族,定位于5q31,mRNA全长310 bp,编码543个氨基酸,其序列中含有多个保守的CarG结构域,这些结构域可感受细胞内外的理化刺激如自由基、电离辐射等,继而诱导下游基因表达。Tsurushima等[10]将凋亡因子caspase-8与Egr-1启动子构造成一完整质粒后用于治疗恶性脑胶质瘤取得了满意的疗效,且效果可在时间和空间上受放射线调控。这种可控的基因放射治疗使得放疗的不良反应进一步降低,安全性进一步提高。
HtrA2是近年发现的一种前凋亡分子,在细胞内具有双重作用:①该分子存在于线粒体中并参与线粒体的正常生理代谢;②在外界刺激条件下,它从线粒体释放出来参与并促进细胞凋亡[11]。其途径包括:能与IAPs特异性结合,解除IAPs对半胱氨酸天冬氨酸蛋白酶的阻抑而激发凋亡,依赖其本身的蛋白激酶活性促进细胞凋亡,此外,HtrA2还参与肿瘤细胞的失巢凋亡[12]和肿瘤坏死[13]。
本研究选用这种前凋亡分子与Egr-1启动子成功构建pEgr1-HtrA2质粒,并与常规启动子pCMV-HtrA2质粒和空白质粒pEgr1对比。分别转染了上述3种质粒的OCM-1细胞在接受0、2、4、8、12 Gy剂量的放射线后,pEgr1-HtrA2组HtrA2 mRNA表达在8 Gy时达到高峰,我们认为可能Egr-1启动子在8 Gy时已达到最大效率,在8 Gy前HtrA2表达随放射剂量增加而增高,而pCMV-HtrA2组并无剂量依赖性。
总之,本实验结果发现,转染HtrA2前凋亡因子可在放射线作用下抑制葡萄膜黑色素瘤OCM-1细胞的生长,并在动物实验中取得了满意的效果。由Egr-1启动子构建的pEgr1-HtrA2质粒依赖放射线调控,可减少放射线剂量,增强放射敏感性,同时也提高了局部放疗的安全性。
[1]PAPASTEFANOU V P, COHEN V M.Uveal melanoma[J].J Skin Cancer, 2011, 573974.doi: 10.1155/2011/573974.Epub 2011 Jun 30.
[2]DAMATO B.Treatment of primary intraocular melanoma[J].Expert Rev Anticancer Ther, 2006, 6(4): 493-506.
[3]SUN Y, TRAN B N, WORLEY L A, et al.Functional analysis of the p53 pathway in response to ionizing radiation in uveal melanoma[J].Invest Ophthalmolvis Sci, 2005, 46(5): 1561-1564.
[4]VERHAGEN A M, SILKE J, EKERT P G, et a1.HtrA2 promotes cell death through its serine protease activity and its ability to antagonize inhibitor of apoptosis proteins[J].J Biol Chem, 2002, 2777(1): 445-454.
[5]DATTA R, RUBIN E, SUKHATME V, et al.Ionizing radiation activates transcription of the EGR1 gene via CarG elements[J].Proc Natl Acad Sci USA, 1992, 89(21): 10149-10153.
[6]SUN X F, HU X Y, BAI X J.Cloning and sequencing of mouse Omi/HtrA2 and construction of radiation-inducible expression plasmid pIRESEGRlp-Omi/HtrA2[J].Chin J Exp Surg, 2007, 24(3): 355-357.
[7]KEVIN R, MCELENY R, WILLIAM G, et al.Inhibitors of apoptosis proteins in prostate cancer cell lines[J].Prostate, 2002, 51(2): 133-140.
[8]MARPLES B, GRECO O, JOINER M C, et al.Molecular approaches to Chemoradiotherapy[J].Eur J Cancer, 2002, 38(2): 231-239.
[9]GRECO O, MARPLES B, DACHS G U, et al.Novel chimeric gene promoters responsive to hypoxia and ionizing radiation[J].Gene Ther, 2002, 9(20): 1403-1411.
[10]TSURUSHIMA H, YUAN X, DILLEHAY L E, et al.Radiation-inducible caspase-8 gene therapy for malignant brain tumors[J].Int J Radiat Oncol Biol Phys, 2008, 71(2): 517-525.
[11]SKORKO-GLONEK J, ZURAWA-JANICKA D, KOPER T, et al.HtrA protease family as therapeutic targets[J].Curr Pharm Des, 2013, 19(6): 977-1009.
[12]LIU Z, LI H, DEROUET M, et al.Oncogenic Ras inhibits anoikis of intestinal epithelial cells by preventing the release of a mitochondrial pro-apoptotic protein Omi/HtrA2 into the cytoplasm[J].J Biol Chem, 2006, 281(21): 14738-14747.
[13]OKADA M, ADACHI S, IMAI T, et al.A novel mechanism for imatinib mesylate-induced cell death of BCR-ABL-positive human leukemic cells caspase-independent, necrosis-like programmed cell death mediated by serine protease activity[J].Blood, 2004, 103(6): 2299-2307.
