ERCC1新抗体在非小细胞肺癌铂类用药分子诊断中的应用
2014-12-06罗静徐美青郭明发魏大中柳常青孙翔翔
罗静 徐美青 郭明发 魏大中 柳常青 孙翔翔
安徽医科大学附属省立医院胸外科,安徽 合肥 230001
肺癌是目前我国发病率和病死率最高的恶性肿瘤之一,约80%诊断为非小细胞肺癌(nonsmall cell lung cancer,NSCLC)。手术是Ⅰ~Ⅱ期及部分ⅢA期NSCLC患者主要的治疗方法之一,虽术后予以辅助化疗,但生存率改善不佳,有研究表明5年生存率仅改善5%[1-2],近年来,随着肺癌个体治疗的发展,为肺癌患者选择合适的化疗方案,从而提高疗效,延长生存期。DNA切除修复交叉互补基因1 (excision repair cross complementation group l,ERCC1)蛋白在DNA修复途径中起关键作用,其高表达与铂类药物的耐药性相关。以往研究中常采用抗体8F1检测ERCC1的表达,研究结果有正向的,也有反向的[3-4]。近来发现ERCC1抗体8F1有非特异性,同时也研制了ERCC1的新抗体4F9[5-6]。但该新抗体用于肿瘤临床标本的检测进而指导铂类用药的研究鲜见报道。为了明确ERCC1新抗体4F9在NSCLC患者铂类用药的指导作用,本研究采用ERCC1新抗体4F9免疫组化方法检测ERCC1在NSCLC组织中的表达,分析其与NSCLC临床和病理特征的关系,以及铂类化疗药物对患者的疗效和生存期的影响。
1 资料和方法
1.1 临床资料
收集2010年6月—2011年1月安徽省立医院胸外科手术治疗且术后行辅助化疗的Ⅰ~Ⅲ期NSCLC患者72例,其中男性42例,女性30例,年龄40~72岁;鳞癌38例,腺癌34例;临床Ⅰ期为30例,Ⅱ期为28例,Ⅲ期为14例;淋巴结未转移为32例,有转移为40例。采用GP方案(吉西他滨1 g/m²第1、8天+卡铂500 mg/m²)者24例,采用TP方案(多西他赛100 mg/m²+卡铂500 mg/m²)者32例,采用NP方案(长春瑞滨25 mg/m²第1、5天+卡铂500 mg/m²)者16例,连续4~6个周期。患者自手术后开始随访,末次随访时间至2013年7月30日。
1.2 实验步骤
取上述72例患者手术标本,经石蜡包埋,4 μm切片;经二甲苯,无水酒精脱蜡,水化组织切片;抗原修复暴露抗原决定族;3%H2O2处理内源性过氧化物酶10 min;封闭非特异,PBS洗3次,每次3 min;一抗ERCC1抗体克隆4F9(购自北京中衫公司,1∶100稀释),放入湿盒中于37 ℃ 1 h或4 ℃过夜温育,PBS洗3次,每次3 min;二抗(购自福州迈新公司,按说明书稀释)温育30 min,PBS洗3 min×5次;SP(购自福州迈新公司,按说明书稀释)37 ℃温育30 min;DAB显色系统显色,加滴苏木素染液复染后脱水、封片。
判定标准:采用组织化学评分法,采取10个高倍视野,计数肿瘤细胞的阳性比例,肿瘤细胞表达数1%~9%计分0.1;>9%~49%计分0.5;>49%计分1,并根据阳性细胞染色强度记分(0、1、2、3分),二者分数相乘为该标本的最终得分。≥1为高表达,<1为低表达。
1.3 预后评价
化疗疗效按RECIST 1.1标准评价,计算化疗有效率。计算中位生存期及2年生存率,生存期为治疗开始至死亡或随访结束的时间。
1.4 统计学处理
采用SPSS 13.0软件进行统计学分析。组间比较采用χ²检验,以Kaplan-Meier法进行生存分析,采用Log-rank比较生存率,P<0.05为差异有统计学意义。
2 结 果
2.1 ERCC1表达与NSCLC临床病理特征的关系
免疫组化检测结果显示,ERCC1蛋白阳性表达的NSCLC细胞核内出现棕黄色颗粒(图1),72例NSCLC患者中ERCC1高表达为55.5%(40/72)。χ²检验显示,ERCC1表达与年龄、性别、期别、病理类型、淋巴结转移均无明显相关性(P>0.05,表1)。
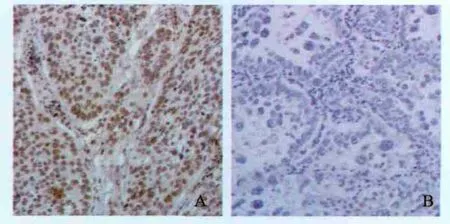
图1 免疫组化检测ERCC1在NSCLC中表达Fig. 1 ERCC1 expression detected by immunohistochemistry in NSCLC(DAB,×200)
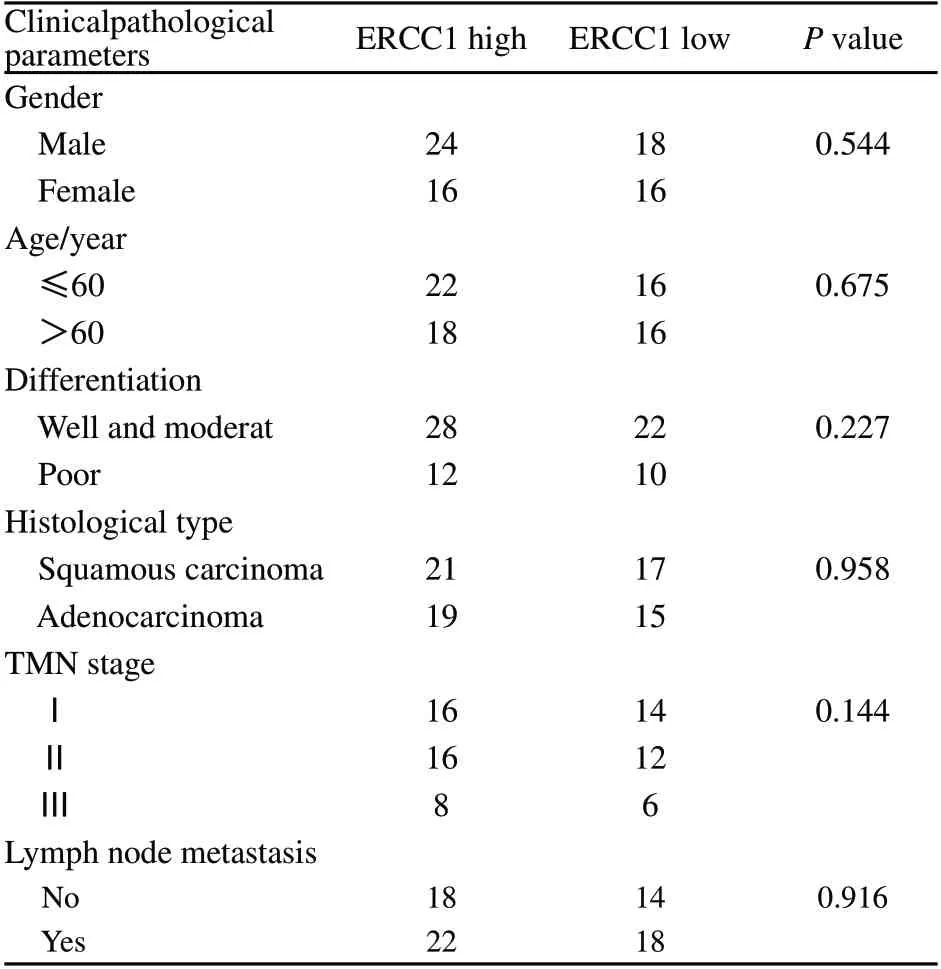
表1 ERCC1表达与NSCLC临床病理特征的关系 Tab. 1 Correlation between the expression of ERCC1 with the clinicopathological characteristics of NSCLC
2.2 ERCC1的化疗有效率
ERCC1高表达患者的化疗有效率为37.5%,低表达者为62.5%,差异有统计学意义(P=0.036,表2)。
2.3 ERCC1表达与生存期之间的关系
在40例ERCC1高表达患者中,中位总生存期为18.4个月,2年生存率为37.5%,32例ERCC1低表达的患者中,中位总生存期为22.9个月,2年生存率为46.9%,ERCC1低表达患者中位总生存期明显长于ERCC1高表达患者(P=0.046,图2)。Ⅰ期ERCC1高表达和低表达患者的中位生存期分别是32.4个月和31.1个月,Ⅱ期ERCC1低表达患者和高表达患者的中位生存期分别是24.6个月和21.5个月,Ⅲ期ERCC1低表达患者和高表达患者的中位生存期分别是18.4个月和14.3个月,Ⅱ期和Ⅲ期ERCC1阴性中接受铂类药物化疗的患者的中位生存期明显长于阳性患者。

表2 ERCC1的表达与化疗有效率Tab. 2 The Chemotherapy effi ciency related with ERCC1 expression
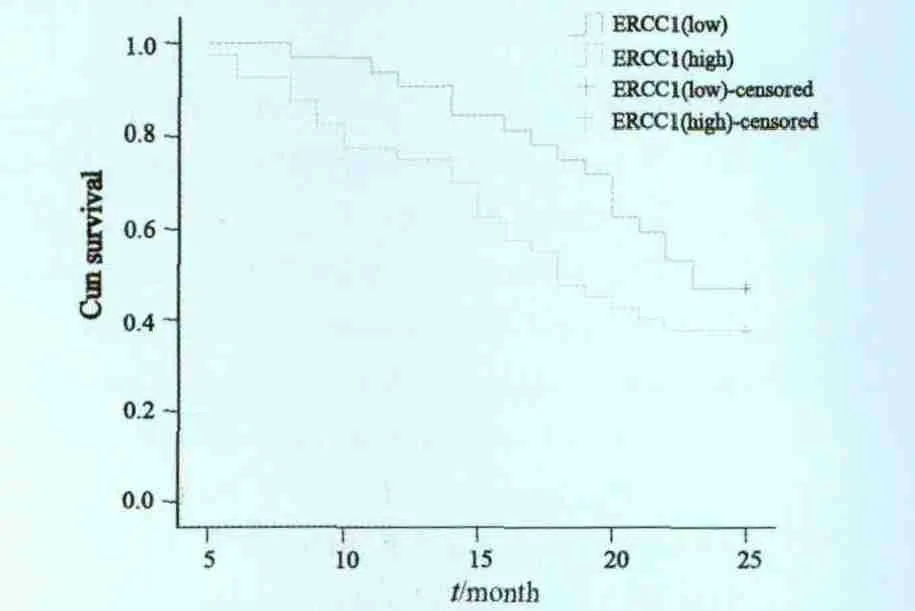
图2 ERCC1表达与总体生存期的关系Fig. 2 Kaplan-Meier plot of overall survival of NSCLC according to ERCC1 expression
3 讨 论
目前肺癌术后治疗以化疗为主,因患者个体间的差异、分子病理类型的不同,肺癌患者对标准化疗敏感性差异较大。因此近年来提出了针对不同患者进行个体化治疗的概念。通过检测药物靶标基因表达,制定个体化治疗方案,从而提高化疗效果,并判定预后。
ERCC1位于染色体l9ql3.2-13.3,全长15 kb,含l0个外显子,被转录加工为1.0 kb mRNA和1.1 kb mRNA,仅后者编码含297个氨基酸的蛋白质,是首个克隆的DNA损伤修复基因[7],是DNA损伤修复途径中最主要的基因之一,具有损伤识别和切除5’端的双重作用,在核苷酸切除修复中起到限速或调节的重要作用,是DNA修复的一个重要途径。铂类药物抗肿瘤作用的主要靶点为DNA,其细胞毒性主要在于与细胞核DNA结合,形成铂-DNA加合物,影响DNA复制转录,导致其致命损伤。ERCC1作为核苷酸切除修复的限速酶参与DNA的修复并且有可能作为使用铂类化疗药的预测的标志物[8],目前针对NSCLC的一线化疗方案是以铂类为主的联合化疗。Simon等[3]和Sarrier等[9]根据ERCC1表达水平预测铂类的疗效,结果表明ERCC1低表达者用铂类治疗,ERCC1高表达者用非铂类治疗,可以提高NSCLC治疗的有效率。Cobo等[10]的研究是第一次根据ERCC1 mRNA表达水平进行选择性应用铂类药物的Ⅲ期对照试验,结果提示,依据ERCC1 mRNA表达水平对顺铂进行选择性用药好于非选择顺铂/多西他赛的传统治疗,实验组客观缓解率、无进展生存期均高于对照组。但也有相反的研究结果,Bepler等[4]报道了依据ERCC1和RRM1表达水平选择用药的Ⅲ期前瞻性研究结果,检测的实验组(根据检测用药)与无检测的对照组(用吉西他滨/卡铂方案)在无病生存期上差异无统计学意义。但进一步分析却发现,在实验组和对照组中,ERCC1/RRM1均为表达低的患者都用了吉西他滨/卡铂治疗在无病生存期上差异有统计学意义。这些患者无论是分在实验组还是对照组,其无病生存期理应没有差异。因为其ERCC1/RRM1均为表达低、且均使用了吉西他滨/卡铂治疗,可以将他们看作是实验中的内对照。基于本是无差异的内对照却出现了有差异的情况,笔者认为该结果(检测的实验组与无检测的对照组在无病生存期上的差异无统计学意义)是假阴性,并分析了造成此结果的原因:①多单位间在收集标本和处理标本的差异;②所用的检测ERCC1的抗体8F1存在问题;③以往多采用批量处理标本,而该研究采用即时处理标本,也可造成结果的差异。
已发现ERCC1抗体8F1存在非特异性,除了ERCC1蛋白外,还识别细胞核膜蛋白PCYT1A[5-6]。为解决这一问题,有研究者制备了ERCC1的新抗体,4F9是其中之一[6]。但4F9应用于肿瘤临床标本的研究鲜见报道[5]。本研究采用ERCC1新抗体4F9免疫组化方法检测ERCC1在NSCLC肿瘤组织中的表达,分析其与NSCLC临床和病理特征的关系,以及对患者铂类化疗疗效和生存期的影响。发现ERCC1蛋白低表达的患者中位生存期及2年生存率明显好于高表达者(P<0.05),表明ERCC1新抗体4F9免疫组化检测对预测铂类化疗疗效的可行性。
[1]SOO R A, WANG L Z, THAM L S, et al. A multicentre randomised phase Ⅱ study of carboplatin in combination with gemcitabine at standard rate or fixed dose rate in fusion in patients with advanced stage non-small-cell lung cancer[J]. Ann Oncol, 2006, 17(7): 1128-1131.
[2]MOUNTAIN C F, DRESLER C M. Regional lymph node classification for lung cancer staging[J]. Chest, 1997, 111(6): 1718-1723.
[3]SIMON G, SHARMA A, LI X, et al. Feasibility and efficacy of molecular analysis directed individualized therapy in advanced non-small-cell lung cancer[J]. J Clin Oncol, 2007, 25(19): 2741-2746.
[4]BEPLER G, WILLIAMS C, SCHELL M, et al. Randomized international phase Ⅲ trial of ERCC1 and RRM1 expressionbased chemotherapy versus gemcitabine/carboplatin in advanced non-small-cell lung cancer[J]. J Clin Oncol, 2013, 31(19): 2404-2412.
[5]BAUMAN J E, AUSTIN M C, SCHMIDT R, et al. ERCC1 is a prognostic biomarker in locally advanced head and neck cancer: results from a randomised, phaseⅡtrial[J]. Br J Cancer, 2013, 109(8): 2096-2105.
[6]MA D, BARUCH D, SHU Y, et al. Using protein microarray technology to screen anti-ERCC1 monoclonal antibodies for specificity and applications in pathology[J]. BMC Biotechnol, 2012, 12: 88.
[7]REED E. Platinum-DNA adduct-nucleotide excision repair and platinum based anti-cancer chemotherapy[J]. Cancer Treat Rev, 1998, 24(5): 331-344.
[8]LEE H W, CHOIA Y W, HAN J H, et al. Expression of excision repair cross-complementation group 1 protein predicts poor outcome in advanced non-small cell lung cancer patients treated with platinum-based doublet chemotherapy[J]. Lung Cancer, 2009, 65(3):377-382.
[9]SARRIER C, HAURA E B, ROIG B, et al. Polymorphisms of the DNA genes ERCCl and lung cancer risk[J]. Cancer Epidemiol Biomarkers Prev, 2001, 10(2): 119-123.
[10]COBO M, ISLA D, MASSUFI B, et al. Customizing cisplatin based on quantitative excision repair cross-complementing l mRNA expression: a phase Ⅲ trial in non-small cell lung cancer[J]. J Clin Oncol, 2007, 25(19): 2747-2754.
