超声引导射频消融治疗肝脏恶性肿瘤302例肿瘤残留危险因素分析
2014-12-06花永强陈颢孟志强陈震林钧华刘鲁明朱晓燕沈晔华王鹏高惠峰解婧
花永强 陈颢 孟志强 陈震 林钧华 刘鲁明 朱晓燕 沈晔华 王鹏 高惠峰 解婧
复旦大学附属肿瘤医院中西医结合科,复旦大学上海医学院肿瘤学系,上海 200032
射频消融(radiofrequency ablation,RFA)1990年由Rossi等[1]首次报道应用于肝癌的治疗,由于具有微创、经济、有效等优势而受到广泛关注,疗效不断提高,目前已经应用于原发性肝癌和多种转移性肝肿瘤的微创治疗[2-8]。是否达到完全消融是影响RFA术后患者生存的重要因素[9],而影响消融效果的因素包括肿瘤大小、与周围的解剖关系、是否有门静脉癌栓、手术方式的选择及手术医师的熟练程度等[10-11]。许多学者就消融后肿瘤残留的危险因素展开研究,包括NCCN在内的许多指南也对消融后肿瘤残留的因素进行分析并提供了许多对策。本研究回顾性分析复旦大学附属肿瘤医院2010年1月—2013年3月接受RFA治疗的原发性肝癌和转移性肝癌患者302例,共消融691个肝内病灶,现对消融后肿瘤残留的因素进行分析和总结,供相关研究者参考。
1 资料和方法
1.1 诊断标准
原发性肝癌的诊断为肝脏占位病灶、肝外转移灶穿刺活检或手术切除组织标本,经病理组织学和(或)细胞学检查确诊为肝细胞肝癌,对不能获取病理学诊断的患者,需满足原发性肝癌临床诊断标准方可确诊[12]。转移性肝癌所有患者均经手术切除或穿刺活检获得病理组织学和(或)细胞学诊断。
1.2 一般资料
2010年1月—2013年3月复旦大学附属肿瘤医院中西医结合科共收治住院接受RFA治疗的肝癌患者302例,共消融691个肝内病灶。其中男性175例,女性127例;年龄23~79岁,平均(55.6±3.4)岁,≤60岁者188例,>60岁者114例;原发性肝癌患者144例,共300个病灶,转移性肝癌患者158例,共391个病灶;肿瘤位于肝左叶者52例,共68个病灶,肝右叶者250例,共623个病灶;肿瘤位置无特殊解剖关系者165例,共521个病灶,位于肝包膜表面、靠近肝内大血管及重要脏器等特殊解剖关系者137例,共170个病灶;肿瘤单发141例,2~3个121例,共323个病灶,>3个40例,共227个病灶;肿瘤最大直径≤3 cm者164例,共381个病灶,3~5 cm者112例,共282个病灶,>5 cm者26例,共28个病灶;联合包括肝动脉化疗栓塞术、瘤内酒精注射及放疗等其他局部治疗者226例,共527个病灶,未联合其他局部治疗者76例,共164个病灶(表1)。
1.3 RFA治疗方案的制定
所有患者均采用超声引导RFA治疗,以2%利多卡因消融进针部位皮下局部麻醉,同时配合吗啡术前肌肉注射预防疼痛,5-HT3受体拮抗剂术前静脉推注预防呕吐;使用奥林巴斯公司研发的多极RFA治疗仪OLYMPUS-CELON系统,根据肿瘤大小、数目和解剖位置选择不同规格的消融针和针数,对于形状不规则、直径较大及靠近重要组织器官的肿瘤,采用多层面、多角度、多点穿刺治疗。
1.4 其他局部治疗方案的制定
其他局部治疗方案主要包括肝动脉化疗栓塞术、瘤内酒精注射及放射治疗。肝动脉化疗栓塞术主要应用于病灶>3个且最大直径>3 cm及肿瘤单发或多发且最大直径>5 cm的患者;对于术后复查评价提示肿瘤有残留且符合上述对病灶数目和大小限制的患者也可选择肝动脉化疗栓塞术作为补充治疗;RFA术中如果超声提示肿瘤有残留且因为解剖位置、肿瘤大小等原因无法实现完全消融时可选择瘤内酒精注射;术后影像学检查提示肿瘤残留且最大直径>5 cm的患者可选择放射治疗。
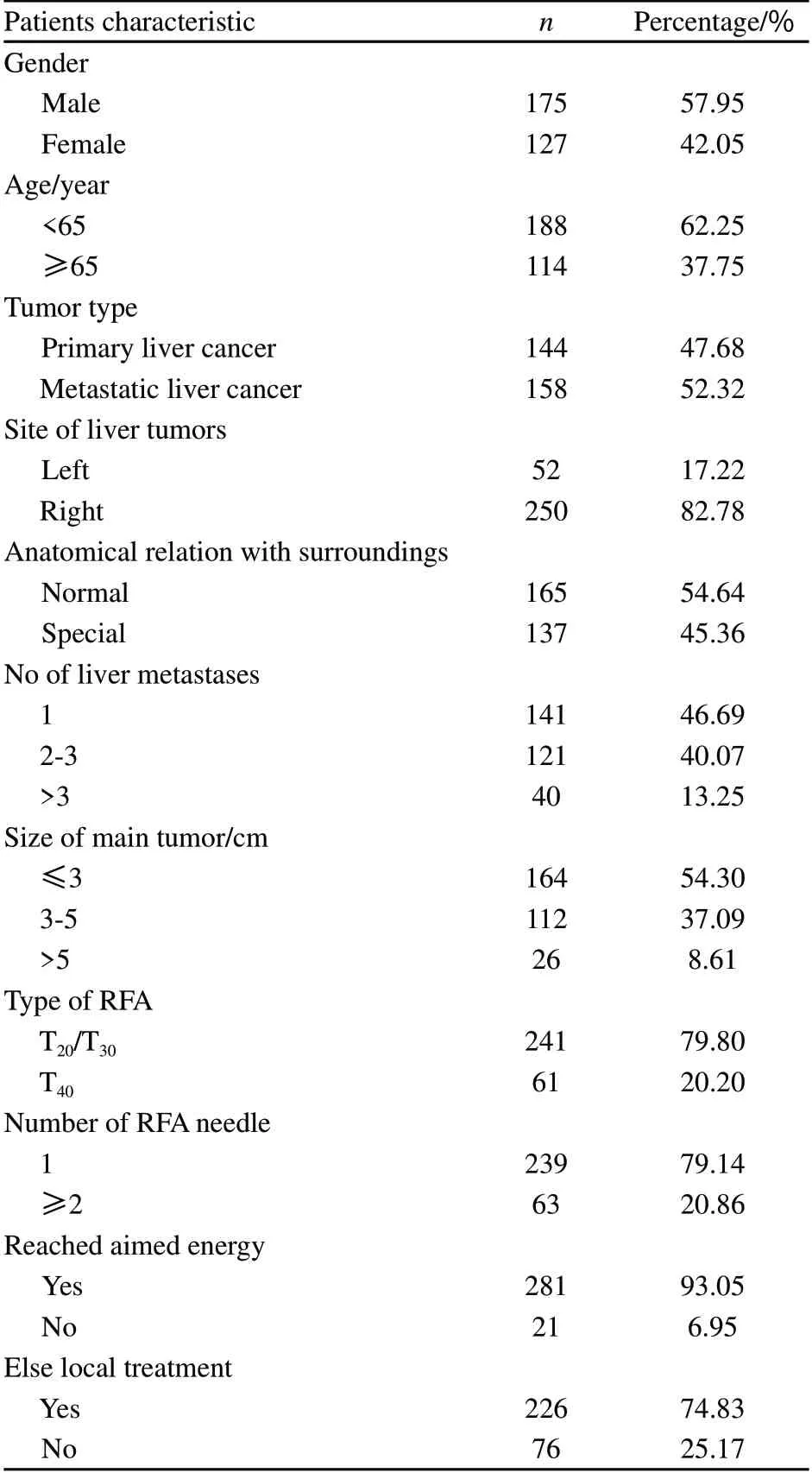
表1 302例接受RFA治疗患者的一般资料Tab. 1 Demographic and elinical eharacteristics of 302 patients received RFA treatment
1.5 随访及消融效果的评价
所有患者均定期随访,术后1个月复查CT、MRI、PET-CT或超声造影,完全消融的定义为消融区域超越肿瘤、边界清晰、动脉期射频位置无强化,完全毁损范围超过肿瘤边缘5~10 mm;部分消融定义为消融区周围动脉期仍有异常增强活性区。
1.6 统计学处理
采用SPSS 17.0统计软件进行统计学分析,单因素和多因素分析采用两分类Logistic Regression模型分析,P<0.05为差异有统计学意义。
2 结 果
2.1 RFA治疗情况
302例患者共消融691个肝内病灶,272例患者消融后复查评价为完全消融,完全消融率为90.07%,共有632个病灶评价为完全消融,完全消融率为91.46%,共有59个病灶有肿瘤残留,肿瘤残留率为8.54%。其中原发性肝癌患者消融300个病灶,转移性肝癌消融391个病灶,肿瘤残留率分别为8.60%和8.44%;病灶位于肝左叶68个,肝右叶623个,肿瘤残留率分别为10.29%和8.35%;单发肿瘤的肿瘤残留率为7.80%,2~3个为8.67%,>3个为8.81%;共有597个病灶采用T20或T30射频针治疗,残留率为8.38%,94个病灶采用T40射频针治疗,残留率为9.57%;564个病灶采用单针治疗,127个病灶采用2根及以上射频针治疗,肿瘤残留率分别为8.33%和9.45%;消融能量达到目标能量者624个病灶,未达到目标能量者67个病灶,残留率分别为8.33%和10.45%;最大直径<3 cm病灶381个,肿瘤残留率为6.30%,3~5 cm病灶282个,肿瘤残留率为9.57%,>5 cm病灶28个,肿瘤残留率为28.57%;位于肝实质内,周围无特殊解剖关系病灶521个,消融后残留36个,残留率为6.91%,周围有特殊解剖关系病灶170个,消融后残留23个,残留率为13.53%,其中以靠近肝内大血管和靠近胆囊的残留最为明显,残留率分别为17.14%和18.52%;除RFA之外联合其他局部治疗病灶527个,未联合其他局部治疗病灶164个,残留率分别为为7.02%和13.41%(表2)。
2.2 RFA术后肿瘤残留单因素和多因素分析
将可能与肿瘤残留有关的各临床因素包括性别、年龄、肿瘤类型、肿瘤位置、肿瘤与周围组织器官解剖关系、肿瘤数目、肿瘤大小、射频针型号、射频针数量、消融能量及RFA之外的其他局部治疗等进行单因素分析,结果显示性别、年龄、肿瘤类型、肿瘤位置及肿瘤数目、射频针型号、射频针数量和是否达到目标消融能量与消融术后肿瘤残留之间无直接相关性,而病灶靠近肝内大血管(P=0.001)、靠近胆囊(P=0.010)、肿瘤最大直径>5 cm(P=0.003)和未联合其他局部治疗(P=0.012)与RFA治疗后肿瘤残留有关(表2)。多因素分析结果显示,病灶靠近肝内大血管(P=0.039)、最大直径>5 cm(P=0.044)和未联合其他局部治疗(P=0.001)是RFA治疗后肿瘤残留的独立危险因素(表3)。
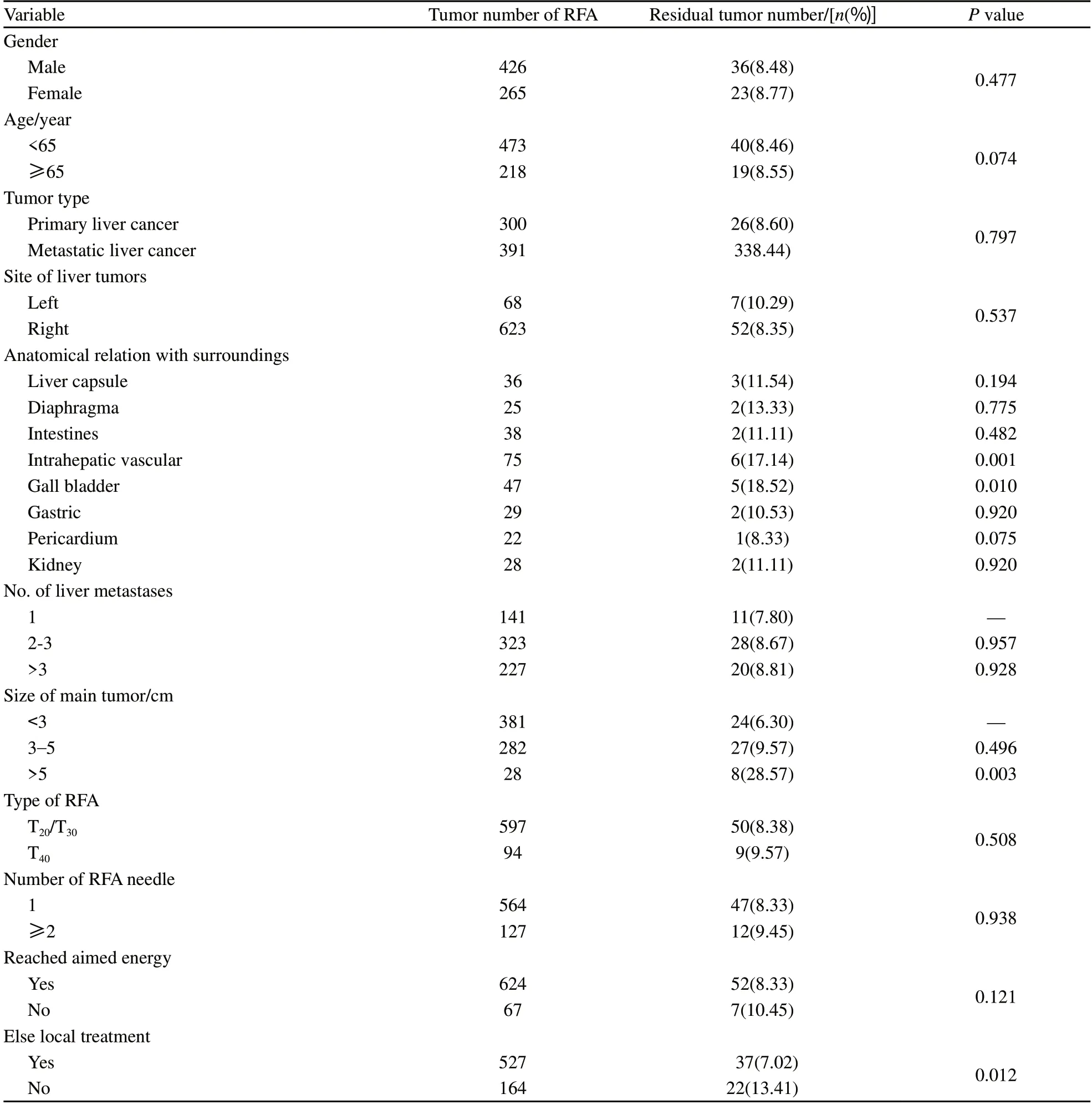
表2 302例肝癌患者射RFA后肿瘤残留单因素分析Tab. 2 Univariate analysis of 302 patients received RFA treatment
2.3 112例282个最大直径3~5 cm病灶射RFA术后肿瘤残留因素分析
现有的研究提示,当病灶最大直径<3 cm时,R F A 治疗因能达到满意的完全消融效果,其临床疗效与手术切除相当,当病灶直径>5 cm时,RFA治疗因不能获得足够的完全消融范围,因此并不作为推荐的局部治疗[13-14],对于直径3~5 cm的病灶,消融治疗可以作为治疗的选择之一,但在治疗方案的制定及联合其他局部治疗方面却没有统一的认识和规范。本研究分析了直径3~5 cm病灶消融后肿瘤残留的相关因素,其中共消融31个靠近肝内大血管病灶,肿瘤残留率为19.35%,而未靠近肝内大血管的251个消融病灶肿瘤残留率只有8.37%;239个联合其他局部治疗的病灶,消融后肿瘤残留率为8.37%,而未联合其他局部治疗的43个病灶肿瘤残留率为16.27%;单针消融213个病灶,≥2针消融69个病灶,肿瘤残留率分别为11.27%和4.35%;共消融肝左叶病灶29个,肝右叶病灶253个,肿瘤残留率分别为13.79%和9.09%。单因素分析结果显示,与所有病灶RFA后肿瘤残留相关因素相比,靠近肝内大血管和是否联合其他局部治疗仍然是肿瘤残留的相关因素;肿瘤位置和射频针数量的选择与直径为3~5 cm病灶RFA术后残留具有相关性。多因素分析显示,靠近肝内大血管(P=0.014)、单针射频(P=0.047)和未联合其他局部治疗(P=0.023)是直径3~5 cm病灶RFA术后肿瘤残留的独立危险因素(表4,图1,2)。
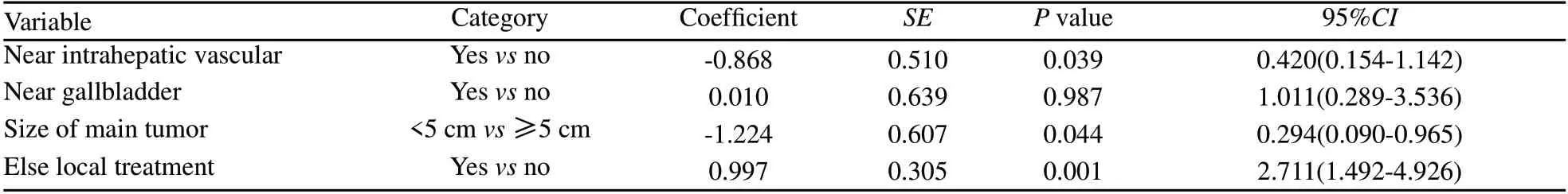
表3 302例肝癌患者射频消融术后肿瘤残留多因素分析Tab. 3 Multivariate prognostic analysis of 302 patients received RFA treatment
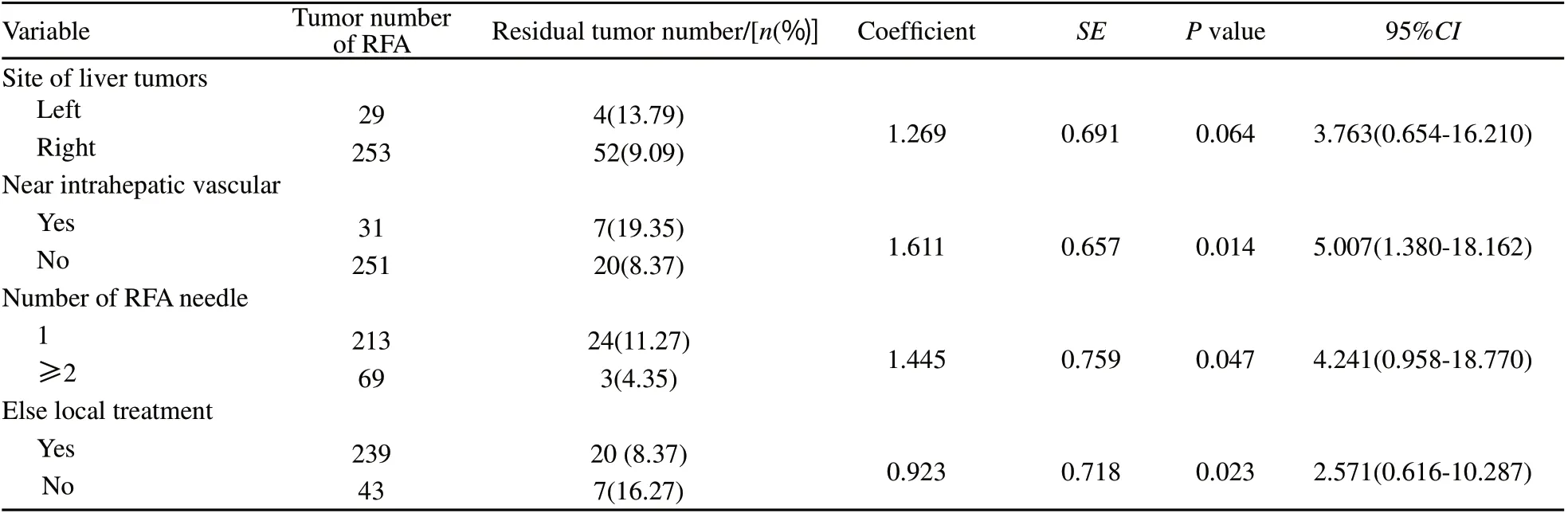
表4 112例肝癌患者直径3~5 cm病灶RFA术后肿瘤残留多因素分析Tab. 4 Multivariate prognostic analysis of 112 patients with tumors between 3-5 cm in diameter received RFA treatment

图1 直径3~5 cm肝脏肿瘤双针RFA典型病例Fig. 1 Typical case for double needles RFA for liver tumors 3-5 cm in diameter
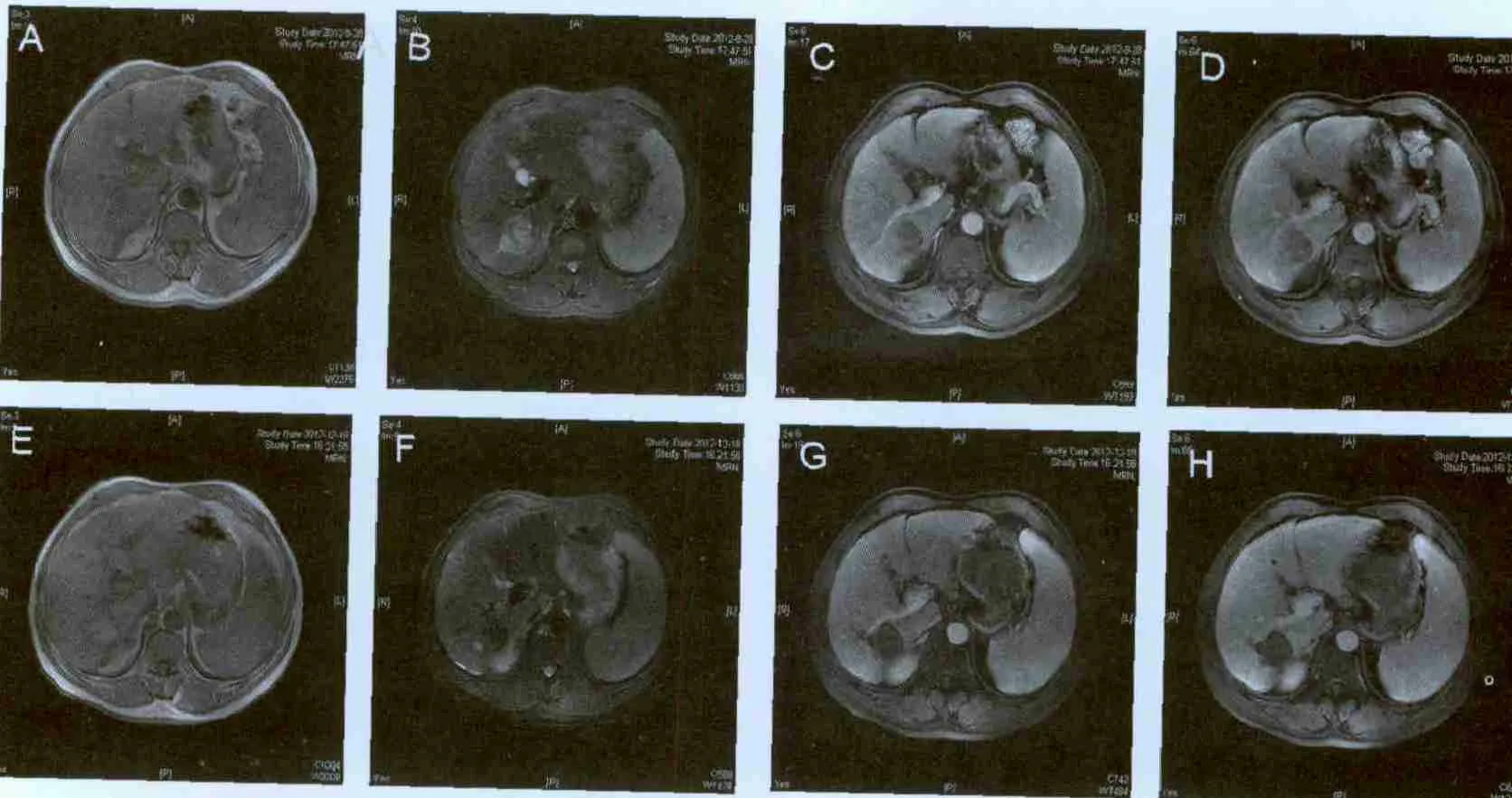
图2 直径3~5 cm肝脏肿瘤RFA联合TACE治疗典型病例Fig. 2 Typical case for RFA combined with TACE for liver tumors with 3-5 cm in diameter
3 讨 论
近年来,超声引导下经皮肝脏穿刺RFA治疗因靶向精准、创伤小、不良反应小、治疗可重复、病灶毁损完全等优点,在原发性肝癌和肝转移癌治疗中的地位越来越重要[2-5,7-8,15]。RFA治疗的目的是完全杀灭肿瘤,达到无肿瘤细胞残留,而肿瘤残留是影响消融术后患者生存的重要因素,如何在术中尽可能避免造成肿瘤残留的因素,对提高RFA的临床疗效具有积极意义。目前报道的影响消融效果的因素包括肿瘤大小、与周围的解剖关系、门静脉癌栓、手术方式、手术医师的熟练程度等[10-11],也包括美国肝脏病学会及中国抗癌协会肝癌专业委员会制定的许多指南,为解决此问题提供了具体的方案[13-14]。本研究对302例691个肝内病灶超声引导下RFA治疗后肿瘤残留的因素展开分析和讨论,希望能对RFA治疗方案的选择和制定提供有益借鉴。
关于RFA适应证的选择,肿瘤大小已经被证实并作为独立的相关因素得到了广泛的认可[11]。有研究显示,直径<3 cm的肝细胞肝癌经RFA治疗后,其完全消融率超过90%[16],将RFA作为首选方案治疗肝功能良好的小肝癌,其术后5年生存率可以与手术切除媲美,10年生存率超过30‰[17-19]。此外,有研究分析了248例肠癌肝转移患者经RFA治疗后预后影响因素。纳入分析的因素包括同步(异时性)转移,单(多)发转移,转移灶最大直径,是否存在肝外转移,结果显示肿瘤最大直径≤3 cm被证明是肠癌肝转移患者经RFA治疗后最有利的生存相关预后因素[11]。因此,RFA治疗目前主要推荐用于直径≤3 cm的肝癌[20]。
近年来,也有学者采用RFA治疗直径3~5 cm的肝癌,但目前的研究结果各不相同,仍存在分歧。争论主要集中在两个方面:第一,直径为3~5 cm的肿瘤是否可以接受RFA治疗;第二,如果接受RFA治疗,是否需要联合其他局部治疗。Chen等[21]的研究将180例直径≤5 cm的原发性肝癌患者随机分为外科手术组和局部消融治疗组,结果显示两者的4年生存率分别为64%和67%,4年无复发生存率为51.6%和46.4%,差异无统计学意义。但RFA治疗具有创伤性更小的优势。因此,消融治疗可以作为直径3~5 cm肝癌患者除手术切除之外的另一治疗选择。本研究结果显示,肿瘤直径>5 cm是RFA治疗后肿瘤残留的独立危险因素,3~5 cm和<3 cm肿瘤在术后肿瘤残留率上的差异并无统计学意义,验证了这一结论的正确性。Morimoto等[22]观察了单发的直径在3.1~5.0 cm的肝细胞肝癌分别接受RFA或RFA联合肝动脉化疗栓塞的效果,随访结果显示,RFA联合肝动脉化疗栓塞组和单纯RFA组消融部位复发率分别为39%和6%,联合治疗显示出更高的消融率。另外一项研究发现,对于直径≤5 cm的肝细胞肝癌,肝动脉化疗栓塞联合RFA与单纯RFA疗效相比,1、2和3年的无复发生存率分别为80%、45%、40%和64%、18%、18%,联合治疗表现出更高的完全消融率[23]。一项最新的随机对照研究比较了RFA联合或不联合肝动脉化疗栓塞治疗直径<7 cm的肝细胞肝癌的效果,结果显示RFA联合肝动脉化疗栓塞1、2和3年无复发生存率分别为79.4%、60.6%和54.8%,明显高于单独RFA组的66.7%、44.2%和38.9%,RFA联合肝动脉化疗栓塞在总生存期和完全消融率上均优于单独RFA[6]。根据上述的这些研究可以认为,对于直径3~5 cm的病灶,RFA治疗联合其他局部治疗,尤其是肝动脉化疗栓塞,可以提高局部消融率,应该作为推荐的治疗模式。本研究分析了112例共282个直径3~5 cm病灶RFA术后肿瘤残留的危险因素,多因素结果显示,除了多数文献研究中已被证实的肿瘤靠近肝内大血管和未联合其他局部治疗与消融术后肿瘤残留有关外,射频针数量的选择也是另外一个与肿瘤残留相关的独立危险因素,采取双针或多针治疗可以扩大消融范围而提高完全消融率,这是不同于以往文献报道的新发现,可以作为类似患者治疗方案制定的有益借鉴。
肿瘤位置是影响RFA效果的重要因素,一些研究者认为,肿瘤位置与术后局部复发密切相关[24-26],肿瘤边缘距离大血管或重要组织器官<5 mm被认为是高危位置,主要包括门静脉一级或二级分支、肝门部血管,肝静脉或下腔静脉,或距离重要组织器官(心脏、肺脏、胆管、右肾、腹壁或胃肠道),上述位置的肿瘤会增加RFA治疗的困难,同时增加不完全消融的概率并可能导致严重的并发症[25-27]。有研究分析了524例肝癌患者经RFA治疗后复发相关的因素,单因素分析显示肿瘤偏小、神经内分泌性肝转移、非肝包膜下、远离大血管的位置是低复发的保护因素,多因素分析显示肿瘤大小和手术是独立的复发相关的因素[28],另外一项研究显示,肿瘤最大直径>2 cm、靠近肝包膜是独立的局部复发危险因素[27],但也有研究结果显示,肿瘤位置对RFA的效果及术后复发并无影响,通过回顾性分析164例慢性肝硬化肝癌患者经皮RFA后复发因素,根据肿瘤位置分为高危险位置组和非高危险位置组,统计结果显示两组完全消融率分别为92.2%和95.5%,差异无统计学意义[29]。另有研究认为,经RFA治疗后肿瘤是否残留与是否能保证足够的消融边界关系更为密切,而与是否靠近大血管和肝脏表面并无直接相关[30]。本研究单因素和多因素分析结果均显示,肿瘤靠近肝内大血管是独立的影响消融效果的因素,而是否靠近肝包膜及其他重要组织器官对消融效果没有直接的影响,产生上述结果主要是因为血流引起的热沉效应是导致靠近血管的肿瘤消融后残留的重要原因[31]。解决这个问题的方法主要包括RFA联合瘤内无水酒精注射,通过局部溶液扩散可增加RFA的热效应,从而改善局部消融效果[32];联合肝动脉化疗栓塞,通过阻断肝脏血管血供,减少热量丢失,增加肿瘤毁损范围[33]。由此可见,对特殊部位的肿瘤,RFA联合其他局部治疗具有重要的价值,其部分原因是可以防止RFA热量丢失,扩大消融范围,提高完全消融率。
综合目前研究进展及本研究结果,超声引导RFA治疗肝肿瘤能够获得满意的消融效果,为了进一步提高消融效果,在制定消融方案时需考虑以下因素:肿瘤靠近肝内大血管是影响肿瘤残留的危险因素;对于最大直径>5 cm的患者,不推荐将RFA作为主要的治疗选择;对直径3~5 cm的肿瘤,联合其他局部治疗,尤其是肝动脉化疗栓塞可以进一步提高消融率;对于直径3~5 cm的肿瘤,采用双针或多针治疗可以进一步提高消融率,减少术后肿瘤残留。
[1]ROSSI S, FORNARI F, PATHIES C, et al. Thermal lesions induced by 480 KHz localized current field in guinea pig and pig liver [J]. Tumori, 1990, 76(1): 54-57.
[2]HIRAOKA A, HORIIKE N, YAMASHITA Y, et al. Efficacy of radiofrequency ablation therapy compared to surgical resection in 164 patients in Japan with single hepatocellular carcinoma smaller than 3 cm, along with report of complications [J]. Hepatogastroenterology, 2008, 55(88): 2171-2174.
[3]KUDO M. Radiofrequency ablation for hepatocellular carcinoma: updated review in 2010 [J]. Oncology, 2010, 78(Suppl 1): 113-124.
[4]PENG Z W, ZHANG Y J, CHEN M S, et al. Radiofrequency ablation as first-line treatment for small solitary hepatocellular carcinoma: long-term results [J]. Eur J Surg Oncol, 2010, 36(11): 1054-1060.
[5]MINAMI Y, KUDO M. Radiofrequency ablation of hepatocellular carcinoma: Current status [J]. World J Radiol, 2010, 2(11): 417-424.
[6]PENG Z W, ZHANG Y J, CHEN M S, et al. Radiofrequency ablation with or without transcatheter arterial chemoembolization in the treatment of hepatocellular carcinoma: a prospective randomized trial [J]. J Clin Oncol, 2012, 31(4): 426-432.
[7]PARK M J, KIM T H, LEE K M, et al. Radiofrequency ablation of metastatic liver masses: recurrence patterns and prognostic factors based on radiologic features [J]. Hepatogastroenterology, 2012, 60(123): 563-567.
[8]WENG M, ZHANG Y, ZHOU D, et al. Radiofrequency ablation versus resection for colorectal cancer liver metastases: a meta-analysis [J]. PLoS One, 2012, 7(9): e45493.
[9]LIN Y H, CHIOU Y Y, CHOU Y H, et al. Radiofrequency ablation for recurrent hepatocellular carcinoma in postresectional patients: prognostic factors analysis [J]. Eur J Gastroenterol Hepatol, 2011, 23(12): 1239-1244.
[10]WIGGERMANN P, PULS R, VASILJ A, et al. Thermal ablation of unresectable liver tumors: factors associated with partial ablation and the impact on long-term survival [J]. Med Sci Monit, 2012, 18(2): 88-92.
[11]VELTRI A, GUARNIERI T, GAZZERA C, et al. Long-term outcome of radiofrequency thermal ablation (RFA) of liver metastases from colorectal cancer (CRC): size as the leading prognostic factor for survival [J]. Radiol Med, 2012, 117(7): 1139-1151.
[12]中华人民共和国卫生部. 原发性肝癌诊疗规范(2011年版) [J]. 临床肿瘤学杂志, 2011, 16(10): 929-946.
[13]BRUIX J, SHERMAN M. Management of hepatocellular carcinoma: an update [J]. Hepatology, 2011, 53(3): 1020-1022.
[14]中国抗癌协会肝癌专业委员会, 中国抗癌协会临床肿瘤学协作专业委员会,中华医学会肝病学分会肝癌学组. 肝癌局部消融治疗规范的专家共识[J]. 中华肝脏病杂志, 2011, 19(4): 257-259.
[15]GIRELLI R, FRIGERIO I, GIARDINO A, et al. Results of 100 pancreatic radiofrequency ablations in the context of a multimodal strategy for stage Ⅲ ductal adenocarcinoma [J]. Langenbecks Arch Surg, 2013, 398(1): 63-69.
[16]POON R T, NG K K, LAM C M, et al. Effectiveness of radiofrequency ablation for hepatocellular carcinomas larger than 3 cm in diameter [J]. Arch Surg, 2004, 139(3): 281-287.
[17]高恒军, 陈敏山. 射频消融治疗肝癌的选择与其联合治疗方式 [J]. 中华肝脏病杂志, 2012, 20(4): 245-248.
[18]ROSSI S, DI STASI M, BUSCARINI E, et al. Percutaneous RF interstitial thermal ablation in the treatment of hepatic cancer [J]. AJR Am J Roentgenol, 1996, 167(3): 759-768.
[19]TATEISHI R, SHIINA S, TERATANI T, et al. Percutaneous radiofrequency ablation for hepatocellular carcinoma. An analysis of 1000 cases [J]. Cancer, 2005, 103(6): 1201-1209.
[20]DICK E A, TAYLOR-ROBINSON S D, THOMAS H C, et al. Ablative therapy for liver tumours [J]. Gut, 2002, 50(5): 733-739.
[21]CHEN M S, LI J Q, ZHENG Y, et al. A prospective randomized trial comparing percutaneous local ablative therapy and partial hepatectomy for small hepatocellular carcinoma [J]. Ann Surg, 2006, 243(3): 321-328.
[22]MORIMOTO M, NUMATA K, KONDOU M, et al. Midterm outcomes in patients with intermediate-sized hepatocellular carcinoma: a randomized controlled trial for determining the efficacy of radiofrequency ablation combined with transcatheter arterial chemoembolization [J]. Cancer, 2010, 116(23): 5452-5460.
[23]PENG Z W, ZHANG Y J, LIANG H H, et al. Recurrent hepatocellular carcinoma treated with sequential transcatheter arterial chemoembolization and RF ablation versus RF ablation alone: a prospective randomized trial [J]. Radiology, 2012, 262(2): 689-700.
[24]MULIER S, MULIER P, NI Y, et al. Complications of radiofrequency coagulation of liver tumours [J]. Br J Surg, 2002, 89(10): 1206-1222.
[25]LIVRAGHI T, SOLBIATI L, MELONI M F, et al. Treatment of focal liver tumors with percutaneous radio-frequency ablation: complications encountered in a multicenter study [J]. Radiology, 2003, 226(2): 441-451.
[26]KONG W T, ZHANG W W, QIU Y D, et al. Major complications after radiofrequency ablation for liver tumors: analysis of 255 patients [J]. World J Gastroenterol, 2009, 15(21): 2651-2656.
[27]KOMORIZONO Y, OKETANI M, SAKO K, et al. Risk factors for local recurrence of small hepatocellular carcinoma tumors after a single session, single application of percutaneous radiofrequency ablation [J]. Cancer, 2003, 97(5): 1253-1262.
[28]MULIER S, NI Y, JAMART J, et al. Local recurrence after hepatic radiofrequency coagulation: multivariate metaanalysis and review of contributing factors [J]. Ann Surg, 2005, 242(2): 158-171.
[29]FRANCICA G, PETROLATI A, DI STASIO E, et al. Effectiveness, safety, and local progression after percutaneous laser ablation for hepatocellular carcinoma nodules up to 4 cm are not affected by tumor location [J]. AJR Am J Roentgenol, 2012, 199(6): 1393-1401.
[30]KEI SK, RHIM H, CHOI D, et al. Local tumor progression after radiofrequency ablation of liver tumors: analysis of morphologic pattern and site of recurrence [J]. AJR Am J Roentgenol, 2008, 190(6): 1544-1551.
[31]LU D S, RAMAN S S, LIMANOND P, et al. Influence of large peritumoral vessels on outcome of radiofrequency ablation of liver tumors [J]. J Vasc Interv Radiol, 2003, 14(10): 1267-1274.
[32]SHANKAR S, VANSONNENBERG E, MORRISON P R, et al. Combined radiofrequency and alcohol injection for percutaneous hepatic tumor ablation [J]. AJR Am J Roentgenol, 2004, 183(5): 1425-1429.
[33]ELIAS D, GOHARIN A, EL OTMANY A, et al. Usefulness of intraoperative radiofrequency thermoablation of liver tumours associated or not with hepatectomy [J]. Eur J Surg Oncol, 2000, 26(8): 763-769.
