DNA甲基转移酶3B4过表达对293A细胞增殖影响及其机制的探讨
2014-12-06邹明新姜树原张姝闫少春邵国刘晓光
邹明新 姜树原 张姝 闫少春 邵国 刘晓光
1.包头师范学院生命科学与技术学院,内蒙古 包头 014030;
2.包头医学院生物医学研究中心及基础医学院,内蒙古 包头 014060
DNA甲基化在基因沉默,染色体重塑和基因组的稳定中有重要作用。异常的DNA甲基化是疾病发生的一个重要因素。催化D N A 发生甲基化的酶为D N A 甲基转移酶(DNA methyltransferase,DNMT),DNMT主要有DNMT1、DNMT3A和DNMT3B,其中DNMT3B有近40种异构体[1]。DNMT3B4是DNMT3B的一种异构体,与全长的DNMT3B1相比,缺少外显子10、22和23,由于22和外显子23编码保守模序Ⅸ和Ⅹ,因此DNMT3B4缺少模序Ⅸ和Ⅹ[2]。由于DNMT3B的甲基转移活性由保守模序Ⅰ、Ⅳ、Ⅵ、Ⅸ和Ⅹ组成,所以DNMT3B4应该缺乏DNA甲基转移酶的活性。
多种癌症都存在DNA甲基化异常的情况,癌症的一个重要特征是癌细胞基因组甲基化降低和抑癌基因启动子区局部的甲基化升高[3]。在多种癌症中都存在DNMT3B4表达异常的现象[2,4]。过表达DNMT3B4可以引起人上皮细胞卫星DNA去甲基化,有研究报道,过表达DNMT3B4在50 d时可以使细胞增殖速度加快[5],但并没有引起等位基因的不平衡的发生[2]。因此,长时间的过表达DNMT3B4对细胞周期的影响尚不清楚,本研究拟探讨长时间(300 d)过表达DNMT3B4对人胚肾细胞株293A细胞增殖的影响,同时观察其与细胞周期密切相关蛋白p21的表达情况。
1 材料和方法
1.1 细胞及载体
293A细胞购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所。pCMVDNMT3B4由本室构建。
1.2 试剂
RPMI-1640培养基购自GIBCO公司,无支原体新生牛血清购自杭州四季青生物工程公司,Fugene HD转染试剂盒购自Roche公司,G418和MTT购自Sigma公司,superscript Ⅲ购自Invitrogen公司,2×real-time PCR Mix购自南京凯基公司,兔源DNMT3B多克隆抗体购自Santa Cruz公司,兔源p21多克隆抗体购自Upstate公司,辣根过氧化物酶标记羊抗兔二抗购自北京博奥森生物技术有限公司。
1.3 细胞培养及转染
293A细胞于含10%新生牛血清的RPMI-1 6 4 0 培养基,3 7 ℃、C O2体积分数为5%的培养箱内培养。细胞增殖至8 0%时,按R o c h e 公 司F U G E N E H D 转 染 程 序,将 质粒pCMV-DNMT3B4转染293A细胞,同时采用空质粒pCMV-2B转染细胞作为对照,用700 μg/mL的G418筛选。筛选2周后挑选单克隆细胞通过real-time PCR鉴定是否为稳定表达的克隆株,将稳定表达的克隆株于350 μg/mL的G418维持培养300 d后进行实验。
1.4 稳定转染细胞的real-time PCR检测
TRIzol提取细胞总RNA,按superscript Ⅲ方法合成c D N A 第1 链。根据G e n B a n k序列,用P r i m e r p r e m i e r 5.0 软件分别设计DNMT3B,p21及内参β-actin基因的引物。引物由Invitrogen公司合成,引物序列DNMT3B顺义链:5’-AGGGAAGACTCGAT CCTCGTC-3’;DNMT3B反义链:5’-GTGT GTAGCTTAGCAGACTGG-3’;p21顺义链:5’-TGTCCGTCAGAACCCATGC-3’;p21反义链:5’-AAAGTCGAAGTTCCAT CGCTC-3’;β-actin顺义链:5’-AGGTGAAG GTCGGAGTCA-3’;β-actin反义链:5’-GGTC ATTGATGGCAACAA-3’。Real-time PCR:使用ABI的96孔板,每孔依次加入cDNA 1 μL,2×mix 12.5 μL,3’和5’端引物(5 μmol/L)各1 μL,无菌水9.5 μL,在ABI 7900 real-time PCR反应仪上反应,每个样本设3个复孔。反应参数:94 ℃预变性3 min,再进行92 ℃,30 s;54.5 ℃,35 s;72 ℃,30 s (40 cycles),最后72 ℃延伸5 min停止反应。
1.5 稳定转染细胞的蛋白印迹法(Western blot检测)
用RIAP缓冲液裂解细胞,用BCA试剂测定蛋白含量,加上样缓冲液调到各组蛋白量一致,10% SDS-PAGE,压缩胶20 mA,分离胶30 mA,电泳后400 mA转移至PVDF膜,预染蛋白marker确定蛋白分子量标准位置。用含10%脱脂奶粉TTBS液封闭,TTBS洗3次,每次10 min;加入1抗,4 ℃温浴过夜,TTBS洗3次,每次10 min;1∶10 000加入辣根过氧化物酶标记山羊抗兔二抗,37 ℃温浴1 h,TTBS洗3次,每次10 min;用Pierce公司的ECL试剂盒进行荧光显色反应。暗室中曝光、显影、定影。
1.6 MTT法检测细胞增殖
调节细胞至每孔5×103接种入96孔培养板,培养24 h后开始检测,连续检测4 d,每天随机选3个孔加入5 mg/mL的MTT 20 μL继续培养3 h,去上清液后加入150 μL DMSO振荡10 min后使用酶标仪检测,以490 nm波长处的吸光度(A)值代表细胞活力,以培养天数(d)为横坐标,以A值为纵坐标,绘制细胞生长曲线。
1.7 流式细胞术分析细胞周期
将细胞接种于6孔板中,当细胞生长到75%~80%时用磷酸缓冲液(phosphate-buffered saline,PBS)洗涤2次,然后细胞用0.5 mL的PBS悬浮,用4.5 mL的70%乙醇固定过夜。离心收集细胞并用0.2 mg/mL的propidium iodide (PI)、0.1%的Triton X-100和0.1 mg/mL RNase A室温避光处理30 min,用FACScan流式细胞仪分析DNA含量,每个样本计数1×104个细胞,测3个复孔。细胞周期的分布用ModFit 3.0程序分析。
1.8 甲基化特异PCR(MS-PCR)检测p21基因启动子区甲基化状态
使用康为公司基因组提取试剂盒从过表达D N M T 3 B 4 细胞及对照组细胞提取基因组DNA,依照Zymo research的EZ DNA Methylation-Gold™Kit方法将2 μg基因组DNA进行转换。p21基因启动子的MS-PCR有两套引物对甲基化的DNA进行研究(methylated MS-PCR和unmethylated MS-PCR)。p21甲基化引物顺义链:5’-TA C G C G A G G T TTCGGGATCG-3’;p21甲基化引物反义链:AAAACGACCCGCGCTCG-3’;p21非甲基化引物顺义链:TAT G T G A G G T T TTGGGATTGG-3’;p21非甲基化引物反义链:AAAAACAACCCACACTCAACC-3’[6]。20 μL反应体系中包括:100 ng亚硫酸氢盐处理的DNA,10 μL 2×PCR mix(TaKaRa)和特异引物(0.2 μmol/L)。PCR反应条件如下:95 ℃预变性10 min;95 ℃变性60 s,61℃复性60 s,72 ℃延伸60 s,共35循环;最后72 ℃延伸5 min。9 μL的PCR产物在2.0%琼脂糖凝胶上电泳,通过溴化乙锭(ethidium bromide)染色观察结果,甲基化和非甲基化p21基因启动子区的产物为133 bp[6]。
1.9 数据处理
Real-time检测中DNMT3B的CT值通过β-actin的CT值均一化,即ΔCT=CTDNMT−CTβactin,而DNMT3B mRNA相对丰度值以ΔΔCT值(DD value)表示,ΔΔCT=2−ΔCT。用Bandscan分析软件对Western Blot结果图像作半定量分析,Western blot结果以DNMT3B4条带光密度值/β-actin条带光密度值计算。
1.10 统计学处理
用SPSS 10.0数据统计软件ANOVA和Tukey对组间数据进行处理和分析,数值以±s 表示。P<0.05为差异有统计学意义。
2 结 果
2.1 高表达DNMT3B4的293A 细胞系的建立
与转染空载体p C M V-2 B 的2 9 3 A 细胞(293A-vector)相比,转染pCMV-DNMT3B4的2株高表达DNMT3B4的细胞(293A-DNMT3B4-1和293A-DNMT3B4-2)在mRNA及蛋白水平上都表达升高,D N M T 3 B 4 m R N A 在293A-DNMT3B4-1和293A-DNMT3B4-2中表达增加近(77.0±1.3)倍和(61.0±1.8)倍(P=0.008 3和P=0.009 5,图1A)。在293A-vector中检测不到DNMT3B4蛋白,而293A-DNMT3B4-1和293A-DNMT3B4-2则可见明显的DNMT3B4蛋白条带(图1B)。
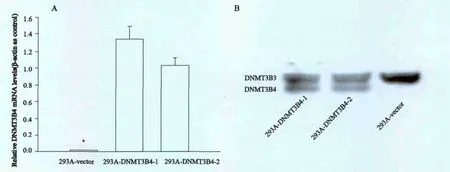
图1 pCMV-2B和pCMV-DNMT3B4稳定转染的293A细胞Fig.1 pCMV-2B and pCMV-DNMT3B4 were stable transfected into 293A cells
2.2 DNMT3B4对293A细胞增殖的影响
稳定转染的细胞株培养300 d后,在接种于96孔板的第4天内检测细胞生长,结果293A-DNMT3B4-1和293A-DNMT3B4-2的A值分别是293A-vector的(58.92±3.47)%和(68.82±5.64)%(P=0.004 9和P=0.007 8,图2)。提示长时间过表达DNMT3B4的293A细胞增殖能力明显降低。
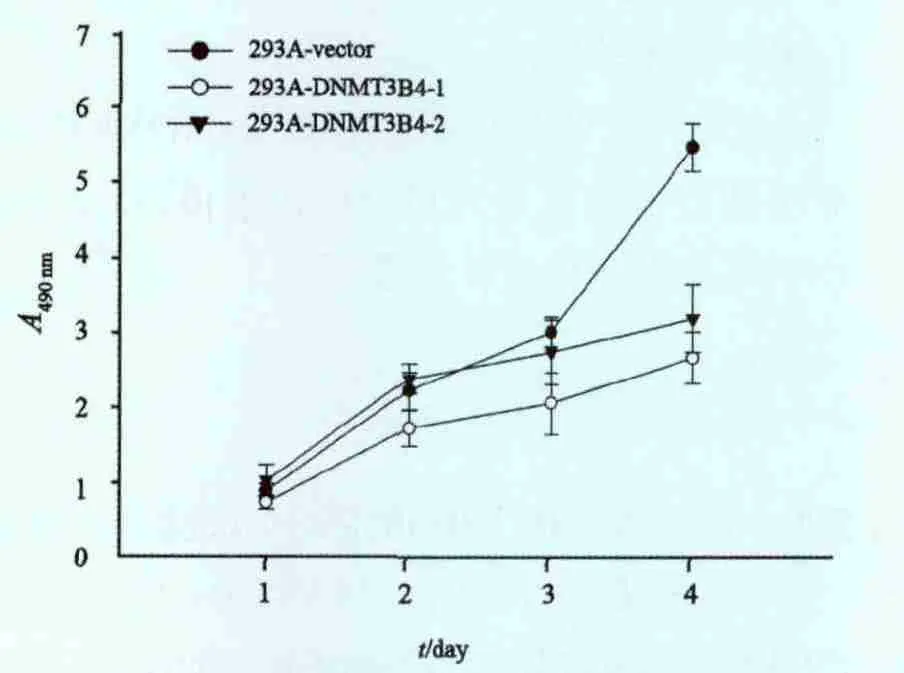
图2 MTT法分析DNMT3B4过表达293A细胞增殖Fig.2 MTT analysis of the proliferation of DNMT3B4 overexpression cells
2.3 DNMT3B4对293A细胞周期的影响
用流式细胞仪分析PI染色的细胞发现,293A-DNMT3B4-1和293A-DNMT3B4-2的S期细胞比例分别为(35.88±2.00)%和(37.00±1.79)%,而293A-vector为(40.44±0.91)%,过表达DNMT3B4使S期细胞比例下降(P=0.029和P=0.036,图3)。
2.4 DNMT3B4对293A细胞p21表达的影响
使用real-time PCR对p21的mRNA水平进行分析,p21 mRNA的相对丰度值用p21 mRNA与β-actin mRNA的比值表示,293A-vector的相对度值为0.06±0.01,293A-DNMT3B4-1和293A-DNMT3B4-2的相对丰度值分别为0.42±0.14和0.40±0.11,较293A-vector增高了6.77和6.45倍,过表达DNMT3B4增高p21 mRNA水平(P=0.038和P=0.044,图4A)。
使用Western blot对p21蛋白水平进行分析,相对分子质量为21×103的条带在各株细胞都可以检测到(图4B),以p21条带的A值与β-actin条带的A的比值代表p21蛋白的相对丰度,293A-vector的p21蛋白相对丰度值为0.15±0.03,293A-DNMT3B4-1和293A-DNMT3B4-2的分别为0.37±0.08和0.38±0.09,过表达 DNMT3B4使293A细胞p21蛋白增加2倍以上(P=0.041和P=0.047,图4C)。
2.5 DNMT3B4 对293A细胞p21基因启动子区甲基化的影响
使用MS-PCR技术对2株过表达DNMT3B4的293A细胞和293A-vector细胞的p21基因启动子的甲基化和非甲基化状态进行分析,结果显示,过表达DNMT3B4的293A细胞和293A-vector细胞p21基因启动子区均为甲基化状态,过表达DNMTD3B4没有改变p21基因启动子区甲基化状态(图5)。

图3 流式细胞仪分析细胞周期进程Fig.3 FACScan fl ow cytometer analysis of the cell cycle progress

图4 p21在DNMT3B4过表达细胞中的表达Fig.4 p21 expression in DNMT3B4 overexpression cells
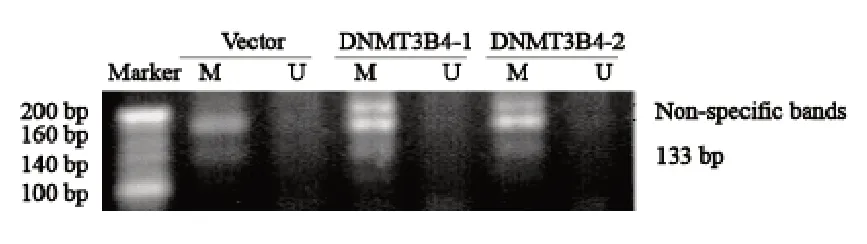
图5 p21的MS-PCR产物电泳图Fig.5 Electrophoresis of MS-PCR products for p21 in agarose gel
3 讨 论
DNMT3B4过表达可以改变细胞的增殖情况,3BKO细胞过表达DNMT3B3Δ5可以提高克隆形成率[1]。Saito等[2]发现转染DNMT3B4后细胞的增殖率增加将近一倍。而在本研究中,过表达DNMT3B4的293A细胞增殖率为293-vector的60%~70%。Saito等[2]诱导DNMT3B4表达50 d来研究其增殖情况,这时细胞等位基因不平衡的现象还没有出现,而本研究中稳定表达DNMT3B4的293A细胞表达DNMT3B4长达300 d左右。DNMT3B4过表达的时间不同可能是两项研究结果差异的原因。
Saito等[2]研究发现将DNMT3B4过表达于293A细胞中,过表达50 d后会使卫星DNA 2出现低甲基化的情况,而卫星DNA 2的低甲基化是染色体不稳定的重要原因。在复制过程中,过量的DNMT3B4蛋白可能在新合成的DNA链屏蔽DNMT1获得CpG二核苷酸[7]。本研究结果显示,过表达DNMT3B4会使293A细胞的增殖受到抑制,主要原因可能是过表达DNMT3B4使其他有活性的DNMT3B的异构体与DNMT3A结合的机会减少,这将导致DNA甲基化的从头合成受到抑制。同时,过表达DNMT3B4使DNMT1结合CpG二核苷酸受到屏蔽,使DNA维持甲基化的受到抑制[7]。由于DNA甲基化的从头合成和维持合成都受到了抑制,使细胞的增殖受到了抑制。
DNMTs与p21的表达关系密切[8-9]。p21是调节细胞周期的一种细胞周期素激酶的抑制剂,上调p21抑制细胞增殖[10],p21可以通过抑制细胞周期素激酶和增殖核抗原(PCNA)来诱导G1期阻滞导致细胞进入不了S期[11]。本研究显示过表达DNMT3B4诱导p21表达增加,但这种诱导是不依赖于p21基因启动子区甲基化的改变来进行的[12]。其原因可能是DNMT3B4过表达引起染色体不稳定或DNA甲基化受阻,DNMTs抑制剂可以上调p21的表达原因也是如此[11],其作用机制不是通过p21基因启动子区甲基化变化,而可能是通过DNA damage/ATM/p53途径来实现的[13]。
本研究探讨了长时间(3 0 0 d)过表达DNMT3B4对293A细胞增殖的影响,同时探讨了p21在其中的作用,由于p21的表达变化不是由于其基因启动子区甲基化的改变引起的,我们将进一步使用诸如敲除p53基因等其他的方法来确定过表达DNMT3B4对293细胞增殖的分子机制。
[1]GOPALAKRISHNAN S, VAN EMBURGH B O, SHAN J, et al.A novel DNMT3B splice variant expressed in tumor and pluripotent cells modulates genomic DNA methylation patterns and displays altered DNA binding[J].Mol Cancer Res, 2009, 7(10):1622-1634.
[2]SAITO Y, KANAI Y, SAKAMOTO M, et al.Overexpression of a splice variant of DNA methyltransferase 3b, DNMT3b4, associated with DNA hypomethylation on pericentromeric satellite regions during human hepatocarcinogenesis[J].Proc Natl Acad Sci U S A, 2002, 99(15):10060-10065.
[3]PEEDICAYIL J.The role of DNA methylation in the pathogenesis and treatment of cancer[J].Curr Clin Pharmacol, 2012, 7(7):333-340.
[4]SU X, LV C, QIAO F, et al.Expression pattern and clinical significance of DNA methyltransferase 3B variants in gastric carcinoma[J].Oncol Rep, 2010, 23(3):819-826.
[5]KANAI Y, SAITO Y, USHIJIMA S, et al.Alterations in gene expression associated with the overexpression of a splice variant of DNA methyltransferase 3b, DNMT3b4, during human hepatocarcinogenesis[J].J Cancer Res Clin Oncol, 2004, 130(11):636-644.
[6]PALANI M, DEVAN S, ARUNKUMAR R, et al.Frequency variations in the methylated pattern of p73/p21 genes and chromosomal aberrations correlating with different grades of glioma among south Indian population[J].Med Oncol, 2011, 28(Suppl 1): 445-452.
[7]KUBAREK L, JAGODZINSKI P P.Epigenetic upregulation of CXCR4 and CXCL12 expression by 17 betaestradiol and tamoxifen is associated with formation of DNA methyltransferase 3B4 splice variant in Ishikawa endometrial adenocarcinoma cells[J].FEBS Lett, 2007, 581(7):1441-1448.
[8]BILLAM M, SOBOLEWSKI M D, DAVIDSON N E.Effects of a novel DNA methyltransferase inhibitor zebularine on human breast cancer cells[J].Breast Cancer Res Treat, 2010, 120(3):581-592.
[9]RAJENDRAN G, SHANMUGANANDAM K, BENDRE A, et al.Epigenetic regulation of DNA methyltransferases: DNMT1 and DNMT3B in gliomas[J].J Neuro-oncol, 2012, 104(2):483-494.
[10]SPERKA T, SONG Z, MORITA Y, et al.Puma and p21 represent cooperating checkpoints limiting self-renewal and chromosomal instability of somatic stem cells in response to telomere dysfunction[J].Nat Cell Biol, 2011, 14(1):73-79.
[11]SORIA G, GOTTIFREDI V.PCNA-coupled p21 degradation after DNA damage: The exception that confirms the rule? [J].DNA Repair, 2010, 9(4):358-364.
[12]M I L U T I N O V I C S, K N O X J D, S Z Y F M.D N A methyltransferase inhibition induces the transcription of the tumor suppressor p21(WAF1/CIP1/sdi1) [J].J Biol Chem, 2000, 275(9):6353-6359.
[13]BOUMBER Y, ISSA J P.Epigenetics in cancer: what's the future? [J].Oncology, NY, 2011, 25(3):220-226, 228.
