2型糖尿病患者胰高血糖素水平与血清C反应蛋白的关系
2014-12-04武鑫李明珍孙丽荣
武鑫 李明珍 孙丽荣
一般认为,胰岛素抵抗与胰岛素分泌缺陷是2型糖尿病发病机制的两个要素,而对胰高血糖素在糖尿病中的作用考虑的较少。近几年随着对胰高血糖素的研究逐渐增多,发现胰岛α细胞的病理改变及胰高血糖素分泌紊乱在糖尿病发病中有很重要的作用,但影响胰高血糖素分泌的因素尚不十分清楚。本研究通过分析2型糖尿病患者胰高血糖素与血清C反应蛋白(SCRP)及胰岛素抵抗相关指标的关系,初步探讨影响胰高血糖素水平的因素。
1 资料与方法
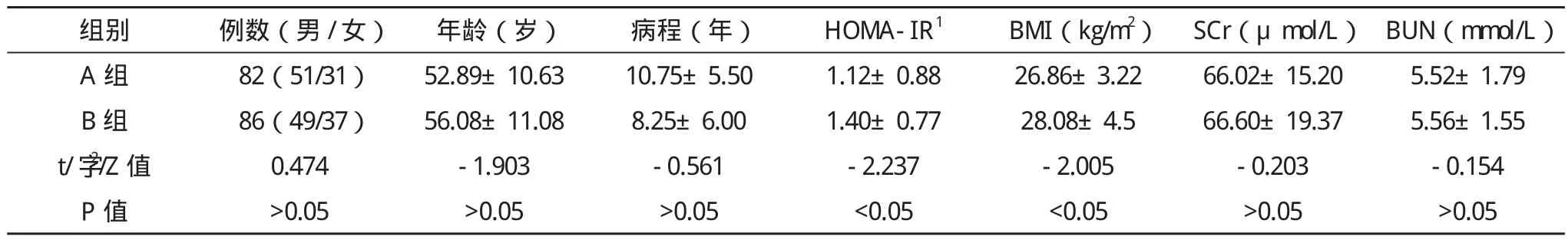
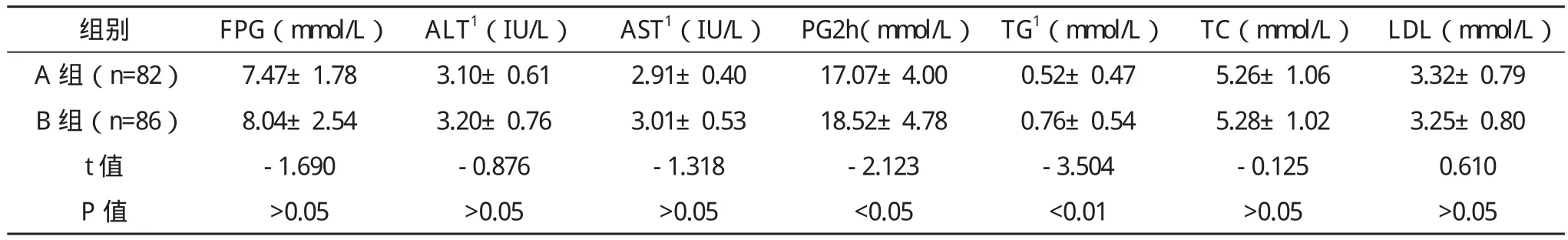
1.1 一般资料 收集2012年10月-2013年4月于天津医科大学代谢病医院住院的2型糖尿病患者168例,2型糖尿病诊断符合1999年世界卫生组织(WHO)标准。排除严重心、肝、肾功能不全、脑血管疾患、糖尿病急性并发症,感染和感染相关性疾病,所有患者均未使用二肽基肽酶4抑制剂、胰高血糖素样肽-1类似物及其受体激动剂。根据SCRP水平分为两组:A组(0 1.2 方法 收集所有患者的身高、体重,计算体重指数(BMI);口服75 g葡萄糖耐量试验空腹、120 min血糖[使用ROCHE MODULARP800全自动生化分析仪(德国)、己糖激酶法测定],空腹胰岛素[采用ROCHE E170电化学发光仪(德国)、电化学发光法测定],空腹、30 min、120 min胰高血糖素(采用放射免疫非平衡法测定);SCRP、血脂[甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)]、肝功能、肾功能指标(日立7600A-020全自动分析仪测定);用稳态模型评价胰岛素抵抗指数(HOMA-IR),HOMA-IR=(空腹血糖×空腹胰岛素)/22.5。 1.3 统计学处理 所有数据均采用SPSS 17.0医学统计软件进行分析处理。计量资料组间均数比较采用独立样本t检验或秩和检验,计数资料进行 字2检验。各变量间相关关系采用Pearson相关分析及多元逐步回归分析。以P<0.05为差异有统计学意义。 2.1 两组一般资料比较 两组患者的年龄、性别分布、病程、TC、LDL-C、空腹血糖(FPG)、丙氨酸氨基转移酶(ALT)、门冬氨酸氨基转移酶(AST)、血肌酐(SCr)、血尿素氮(BUN)比较差异均无统计学意义(P>0.05);与A组相比,B组的HOMA-IR、BMI、糖负荷后2 h血糖(PG2h)、TG均明显升高,两组比较差异有统计学意义(P<0.05),见表1。 表1 两组患者一般资料比较 续表1 2.2 两组间空腹、30 min、120 min胰高血糖素比较 与A组相比,B组空腹、30 min、120 min胰高血糖素均升高,两组比较差异均有统计学意义(P<0.05),见表2。 表2 两组间空腹、30 min、120 min胰高血糖素比较(±s)pg/mL 表2 两组间空腹、30 min、120 min胰高血糖素比较(±s)pg/mL 组别 空腹 30 min 120 min A 组(n=82) 86.49±7.08 125.46±20.27 153.53±50.73 B 组(n=86) 94.66±19.68 137.17±34.07 175.25±74.39 t值 -3.613 -2.629 -2.211 p值 <0.01 <0.05 <0.05 按SCRP水平的四分位数进行分层后,空腹、30 min、120 min胰高血糖素随着SCRP水平的升高从1组到4组依次升高,差异均有统计学意义(P<0.05)。从1组到4组:空腹胰高血糖素依次为:(86.84±6.41)pg/mL、(88.16±9.98)pg/mL、(92.50±21.00)pg/mL、(95.82±19.53)pg/mL;30 min胰 高 血糖素依次为:(124.55±20.02)pg/mL、(127.57±20.93)pg/mL、(133.30±33.46)pg/mL、(141.27±36.44)pg/mL;120 min 胰高血糖素依次为:(146.06±50.59)pg/mL、(162.68±79.91)pg/mL、(163.85±49.87)pg/mL、(186.84±72.17)pg/mL。 2.3 Pearson相关分析 SCRP与空腹、30 min、120 min胰高血糖素、HOMA-IR及TG均呈正相关(r分别为0.203、0.236、0.221、0.158、0.315,P<0.01或 P<0.05),空腹胰高血糖素与HOMA-IR呈正相关(r=0.212,P<0.01)。 2.4 多元逐步回归分析 以病程、年龄、BMI、HOMA-IR、SCRP、TG为自变量,分别以空腹、30 min、120 min胰高血糖素为因变量进行多元逐步回归分析,结果显示HOMA-IR、SCRP是影响空腹胰高血糖素水平的独立相关因素(标准化β分别为0.190、0.220,均P<0.05),SCRP是影响30 min、120 min胰高血糖素水平的独立相关因素(标准化β分别为0.238、0.254,均 P<0.01)。 以往普遍认为,胰岛素抵抗与胰岛β细胞功能缺陷是2型糖尿病发病的重要病理生理机制,而对胰高血糖素在糖尿病中的作用考虑的较少。近几年随着对肠促胰素的研究不断增多以及调节胰岛α细胞功能药物的出现,愈来愈多的研究表明,除β细胞外,α细胞的病理改变及胰高血糖素的分泌异常也参与了2型糖尿病的发生发展[1]。但引起胰高血糖素分泌异常的原因尚不完全清楚。 本研究发现,与SCRP正常组相比,SCRP升高组的多时相胰高血糖素水平均升高,随着SCRP水平的升高多时相胰高血糖素水平均升高,且SCRP为多时相胰高血糖素水平的独立相关因素,这强烈提示SCRP水平与2型糖尿病患者胰高血糖素有密切关系。 SCRP是一种由肝脏产生并分泌的蛋白质,是全身炎症反应的敏感性标志物,患慢性炎症疾病时体内SCRP浓度会持续升高。此外,近几年有研究显示SCRP可作为对一些疾病,如急性心肌梗死、急性脑梗死早期诊断和预测的一项敏感指标[2-3]。有关健康人群SCRP浓度日间及季节变异的研究显示,SCRP没有季节和周期变化。因此,SCRP作为慢性炎症疾病的预报因子很有价值。其表达受多种促炎因子的调控,如IL-6、TNF-α等可刺激肝脏合成SCRP。目前普遍认为,2型糖尿病是一种低度慢性炎症性疾病,有研究显示炎症与胰岛素抵抗有密切关系[4]。Fagerberg等[5]发现SCRP引起胰岛素抵抗是由TNF-α等促炎因子所介导的。由于炎症因子可干扰胰岛素经胰岛素受体(IR)/受体底物(IRS)/磷脂酰肌醇-3-激酶(PI3-K)信号通路下传,从而使胰岛素的正常生理作用减弱[6]。本研究Pearson相关分析也显示SCRP与HOMA-IR呈正相关,证实了炎症与胰岛素抵抗有关。 胰岛素是影响胰高血糖素分泌的主要因素,胰岛β细胞分泌胰岛素后通过旁分泌作用抑制胰岛α细胞胰高血糖素的分泌。目前有研究发现胰岛α细胞同样具有IR、IRS及PI3-K等下游信号分子的表达[7-8]。胰岛素通过作用于此途径抑制胰高血糖素的合成及释放[9-10]。由此推测,SCRP影响胰高血糖素水平的原因如下,炎症因子可能通过干扰胰岛α细胞胰岛素信号转导通路使胰岛素抑制胰高血糖素合成及分泌的作用减弱,即引起胰岛α细胞胰岛素抵抗,从而引起胰高血糖素分泌增多[11-12]。其具体机制有待相关基础研究进一步证实。 本研究结果显示,空腹胰高血糖素与HOMA-IR呈正相关,即胰岛素敏感性与空腹胰高血糖素呈反比关系,与既往文献报道相似[13]。此外,多元线性逐步回归分析进一步发现,HOMA-IR是影响空腹胰高血糖素水平的独立相关因素,推测胰岛素抵抗与空腹胰高血糖素水平有关。 综上所述,本研究发现,2型糖尿病患者胰高血糖素水平升高与体内慢性炎症有一定关系,空腹胰高血糖素水平与胰岛素抵抗有关,这可能是影响糖尿病患者血糖控制的原因之一,且本研究中也发现SCRP升高组的糖负荷后2 h血糖较SCRP正常组升高,提示随着SCRP水平的升高,患者血糖已受到影响。有研究表明餐后高血糖对心血管疾病的产生有密切影响[14]。因此,在临床工作中,为了更有效地促进血糖达标及预防相关并发症的发生,除合理使用降糖药物以外,还要加强对2型糖尿病患者体内炎症的监测及调控,并注意改善胰岛素抵抗状态。 [1]George C, Lochner A, Huisamen B.The efficacy of prosopis glandulosa as antidiabetic treatment in rat models of diabetes and insulin resistance[J].J Ethnopharmacology, 2011, 137(1): 298-304. [2]李淑敏.心肌肌钙蛋白I联合超敏C-反应蛋白检测诊断急性心肌梗死的应用与临床研究[J].中国医学创新,2013,10(10):6-7. [3]蔡莉莉.急性脑梗死患者血浆同型半胱氨酸和高敏C-反应蛋白检测的临床意义[J].中国医学创新,2012,9(11):86-87. [4]盛志新,谢丹红,孙辽,等.2型糖尿病患者血浆炎症因子水平与糖代谢及胰岛素抵抗的关系[J].中国糖尿病杂志,2010,18(4):25-27. [5]Fagerberg B, Beher C J, Wikstrand J, et al.C-reactive protein and tumor necrosis factor-alpha in relation to insulin-mediated glucose uptake, smoking and atherosclerosis [J].Scand J Clin Lab Invest,2008, 68(7):534-541. [6]Hotamisligil G S.Inflammation and metabolic disorders[J].Nature,2006, 444(7121):860-867. [7]Diao J, Asghar Z, Chan C B, et al.Glucose-regulated glucagonssecretion requires insulin receptor expression in pancreatic alpha-cell[J].J Biol Chem, 2005, 280(39):33487-33496. [8]Kaneko K, Shirotani T, Araki E, et al.Insulin inhibits glucagon secretion by the activation of PI3-kinase in In-R1-G9 cells[J].Diabetes Res Clin Pract, 1999, 44(2): 83-92. [9]Leung Y M, Ahmed I, Sheu L, et al.Insulin regulates islet a1pha-cell function by reducing KATP channel sensitivity to ATP inhibition[J].Endocrinology, 2006, 147(5):2155-2162. [10]Araujo E P, Amara1 M E, Souza C T, et al.Blockade of IRSl in isolated rat pancreatic islets improves glucose-induced insulin secretion[J].FEBS Lett, 2002, 531(3):437-442. [11]Tsuchiyama N, Takamura T, Ando H, et al.Possible role of α-cell insulin resistance in exaggerated glucagon responses to arginine in type 2 diabetes[J].Diabetes Care, 2007, 30(10):2583-2587. [12]Kawamori D, Kurpad A J, Hu J, et al.Insulin signaling in α cells modulates glucagon secretion in vivo[J].Cell Metab, 2009, 9(4):350-361. [13]Larsson H, Ahren B.Islet dysfunction in insulin resistance involves impaired insulin secretion and increased glucagon secretion in postmenopausal women with impaired glucose tolerance[J].Diabetes Care, 2000, 23(5): 650-657. [14]茹鲜古丽·托呼提.浅谈餐后高血糖对心血管疾病的影响[J].中国医学创新,2012,9(27):123-124.2 结果

3 讨论
