哈茨木霉LTR-2对椒样薄荷耐盐生理特性的影响
2014-12-03李哲郭凯吴晓青陈泉李纪顺杨合同
李哲,郭凯,吴晓青,陈泉,李纪顺,杨合同,2*
(1.山东省科学院生物技术研究中心,山东省应用微生物重点实验室,山东济南250014;2.山东理工大学生命科学学院,山东淄博250049)
土壤盐渍化是影响植物生长的主要逆境因素之一。NaCl是盐渍化土壤中最主要的成分,对植物造成的伤害是多方面的。NaCl胁迫下,植物会出现营养失衡和渗透功能受损,活性氧过量产生导致膜完整性的破坏,进而引起光合电子传递系统失活、激素平衡破坏、生物量积累下降、蛋白质变性、核酸断裂,甚至细胞死亡[1-2]。植物通过限制盐分的过量吸收和调节抗氧化系统等途径来减轻或抵御NaCl胁迫对细胞的伤害[3-4]。
木霉菌(Trichoderma spp.)作为生防菌株已得到广泛认可,其对植物病原真菌的拮抗机制包含竞争作用、重寄生作用及抗生作用等。近年来越来越多的报道指出,木霉菌还能提高宿主植物耐受非生物胁迫的能力[5]。如哈茨木霉(Trichoderma harzianum)1295-22能够提高氧化胁迫下甜玉米种子活力[6]。哈茨木霉DIS 219b定殖可可树苗后,增加了幼苗生长、改变了基因表达,并在分子、生理和表型水平上增强了叶片对干旱胁迫的抗性[7]。对生长在金属污染土壤的树苗接种哈茨木霉T22,植物干重明显增加[8]。Qi等[9]研究发现,棘孢木霉(Trichoderma asperellum)Q1对于200 mmol/L NaCl胁迫下的黄瓜幼苗具有明显的促生作用。Hermosa[10]等将哈茨木霉的Thkel1基因转到拟南芥中表达,增强了拟南芥对盐胁迫和渗透胁迫的耐受力。哈茨木霉LTR-2由本实验室从蔬菜植物根系土壤中筛选获得,对多种植物病原真菌具有强烈的拮抗作用,取得了良好的社会经济效益[11~14]。课题组最近的研究发现,LTR-2菌株具有较强的NaCl耐受性,且利用LTR-2孢子液处理椒样薄荷植株能够缓解NaCl胁迫对其根系发育的抑制作用,而且LTR-2的这种缓解NaCl胁迫的作用可能是通过促进一氧化氮的产生来实现的[15]。
椒样薄荷(Mentha piperita L.,peppermint)为唇形科薄荷属多年生草本植物,是天然香料,香气纯正,清爽宜人,广泛用于日用化妆品、医药和糖果食品,具有巨大的经济价值[16-17]。本实验室在盐渍化土壤经多年驯化筛选出了抗盐椒样薄荷品系——科院1号,适合在黄河三角洲地区盐渍土壤上大规模推广种植。课题组还首次开展了椒样薄荷响应NaCl胁迫的生理特性的研究,发现其能够耐受约150 mmol/L NaCl的胁迫,在该浓度下,椒样薄荷植株能正常生长[18]。
目前国内外对椒样薄荷等芳香植物的研究与开发主要聚焦于精油组分的分析和提取,而对其耐盐特性研究较少。国内外对木霉菌增强植物耐盐性及其作用机理方面也尚缺乏系统研究。本实验以椒样薄荷为试材,通过木霉菌接种实验,对NaCl胁迫下哈茨木霉LTR-2对椒样薄荷耐盐生理特性的影响进行了研究,探讨了LTR-2接种苗耐受NaCl胁迫的生理生化基础,旨在为椒样薄荷在盐碱地区的引种及木霉菌剂的开发应用提供理论和实验依据。
1 材料与方法
1.1 实验材料与仪器
实验所用椒样薄荷为本实验室在盐渍化土壤多年驯化筛选出的抗盐品系 (科院1号)。在人工气候室内于光暗周期为10/14 h,昼夜温度为26/20℃,空气相对湿度为50% ~70%的条件下,大量培养椒样薄荷植株。选取生长期(10叶期)一致的植株,从植株顶端选择大小相近的一对叶,连同茎(约4 cm)切割后移入Hoagland营养液中培养至生根 (根长至0.8 ±0.2 cm)。
哈茨木霉LTR-2为本实验室筛选保存的品种。将LTR-2于PDA平板上涂布分生孢子,28℃培养5 d至木霉产生大量的绿色分生孢子。用灭菌生理盐水洗涤,制成分生孢子悬浮液,其含量为109cfu/mL。
1.2 实验处理
向铺有两层滤纸的烧杯中,分别加入1 mL浓度为105个/mL的木霉孢子悬液。将打孔后的泡沫板放置在烧杯中,移入生长良好、大小一致的椒样薄荷植株,由泡沫板支撑,使其不定根与滤纸完全接触,共培养24 h。随后加入含200 mmol/L NaCl的Hoagland营养液,其后视为处理起始时间。每天分别补充2 mL营养液。
1.3 椒样薄荷植株生长状况的测定
分别取不同处理后的椒样薄荷植株地上部,利用电子天平(FA1004N,上海精密科学仪器有限公司)称量鲜重。然后选取椒样薄荷的叶片 (从下向上数第3对叶),利用LI-COR LI-3100C叶片面积测量仪(LICOR,美国)来测定叶片面积。
1.4 Pn 值测量
分别取不同处理后的椒样薄荷叶片,用便携式LI6400(LI-COR,美国)光合速率测定仪来测量Pn值。LI6400装有6400-15叶室 (直径1.0 cm),使用人工光源,光照强度为250 μmol photons·m-2·s-1的饱和光。内置浓度为500 mg/m3CO2注入系统控制叶室。
1.5 叶绿素荧光参数的检测
采用Imaging-PAM便携式叶绿素荧光仪(Walz,德国),测定不同实验组椒样薄荷叶片的叶绿素荧光参数。测定前,将叶片放置到暗适应夹中适应25~30 min。测定时,将叶片放置到样品室,打开检测光,测定初始荧光;然后照射饱和脉冲光,每2.5 s一个脉冲,测定荧光参数Fv/Fm。
1.6 叶绿素含量的检测
按张宪政的方法[19],取一定量叶片,置于刻度试管中,加10 mL丙酮∶乙醇提取液(V∶V=1∶1),黑暗处理过夜,利用酶标仪Infinite 200(Tecan,瑞典)分别测定A645和A663。按下列公式计算叶绿素含量:
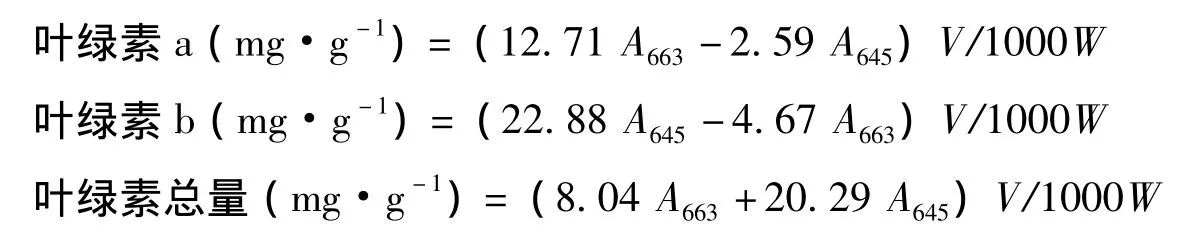
式中,V为提取液体积,单位为mL;W为材料重,单位为g。
1.7 H2O2组织染色
采用二氨基苯胺(3,3-diaminobenzidine,DAB)染色的方法,DAB能够与H2O2反应生成棕红色聚合物[20]。配制100 mL 1 mg/mL的DAB溶液,取经不同处理的椒样薄荷叶片,用打空器钻取数个叶圆片,放入小烧杯中,加入适量DAB溶液,真空渗入10 min,暗下放置8 h以上,期间要经常振荡。拿出培养皿,照光约1 h,至红棕色斑点出现,用蒸馏水冲洗叶圆片,加入适量脱色液(75%乙醇+5%甘油),在80℃水浴中进行脱色,至叶片不含叶绿素。脱色后的叶片用相机拍照。
1.8 H2O2含量的定量检测
利用定量检测试剂盒进行检测(浙江碧云天生物科技公司)。本试剂盒利用H2O2氧化二价铁离子产生三价铁离子,然后和xylenol orange在特定的溶液中形成紫色的产物(A560),从而实现对H2O2浓度的测定。具体实验操作依照试剂盒说明书进行。
1.9 MDA含量与抗氧化能力的检测
MDA含量测定采用Zhang等[21]的方法,总抗氧化能力采用FRAP法检测[22],过氧化氢酶(CAT)和超氧化歧化物酶(SOD)活力的检测分别采用Chance[22]和张宪政[19]的方法。
1.10 质膜和液泡膜H+-ATPase活性的检测
利用蔗糖密度梯度离心法分别制备椒样薄荷质膜微囊和液泡膜微囊,并利用考马斯亮蓝法[23]测定其蛋白含量,随后利用分光光度法测定质膜和液泡膜H+-ATPase的水解活性。质膜H+-ATPase的水解活性用该酶水解ATP释放的 Pi量表示,即在反应液中缺少与存在0.1 mmol/L正钒酸钠时所释放的Pi量之差[23]。液泡膜H+-ATPase的水解活性用保温介质中有或无50 mmol/L KNO3时所释放的Pi量的差值表示[24]。
1.11 Na+/H+逆向转运蛋白 (Na+/H+antiporter)活性的检测
应用蔗糖密度梯度离心法制备椒样薄荷液泡膜微囊,并利用考马斯亮蓝法[23]测定液泡膜微囊的蛋白含量。向反应体系中依次加入1 μmol/L吖啶橙和40 μg液泡膜微囊,抽吸混匀,然后向其中添加5 mmol/L Tris-L-乳酸钾,利用吖啶橙作为荧光探针,通过荧光分光光度计监控跨膜pH值梯度的变化,根据荧光强度的恢复程度判断并表示Na+/H+逆向转运蛋白的活性。荧光监测参数为:激发光波长495 nm,发射光波长530 nm[25]。
1.12 数据处理
数据均用SPSS和Origin统计软件进行分析和制图,计算各处理性状的平均数、标准差,并进行显著性分析。
2 结果与分析
2.1 NaCl胁迫下哈茨木霉LTR-2对椒样薄荷生长状况的影响
植物生长状态和生物量是植物对盐胁迫反应的综合体现,是植物耐盐性的直接指标[2]。实验结果显示,在不加NaCl胁迫的情况下,经LTR-2处理的椒样薄荷比未经LTR-2处理的椒样薄荷的鲜重以及叶片面积略有增长(图1)。在200 mmol/L NaCl处理下,未经LTR-2处理的椒样薄荷的鲜重以及叶片面积呈现出明显的下降,处理12 d后,其鲜重以及叶片面积分别降至了同期对照的62.1% ±3.1%和60.3% ±2.6%(图1B,C)。而经LTR-2处理的椒样薄荷植株,200 mmol/L NaCl处理造成的鲜重以及叶片面积的下降得到了明显的缓解,处理12 d后,其鲜重以及叶片面积仍有明显的增长,分别为同期对照的88.5% ±4.3%和85.1% ± 5.1%,比同期的LTR-2未处理组高29.8% ± 3.3%和29.3% ± 2.9%(图1B,C)。
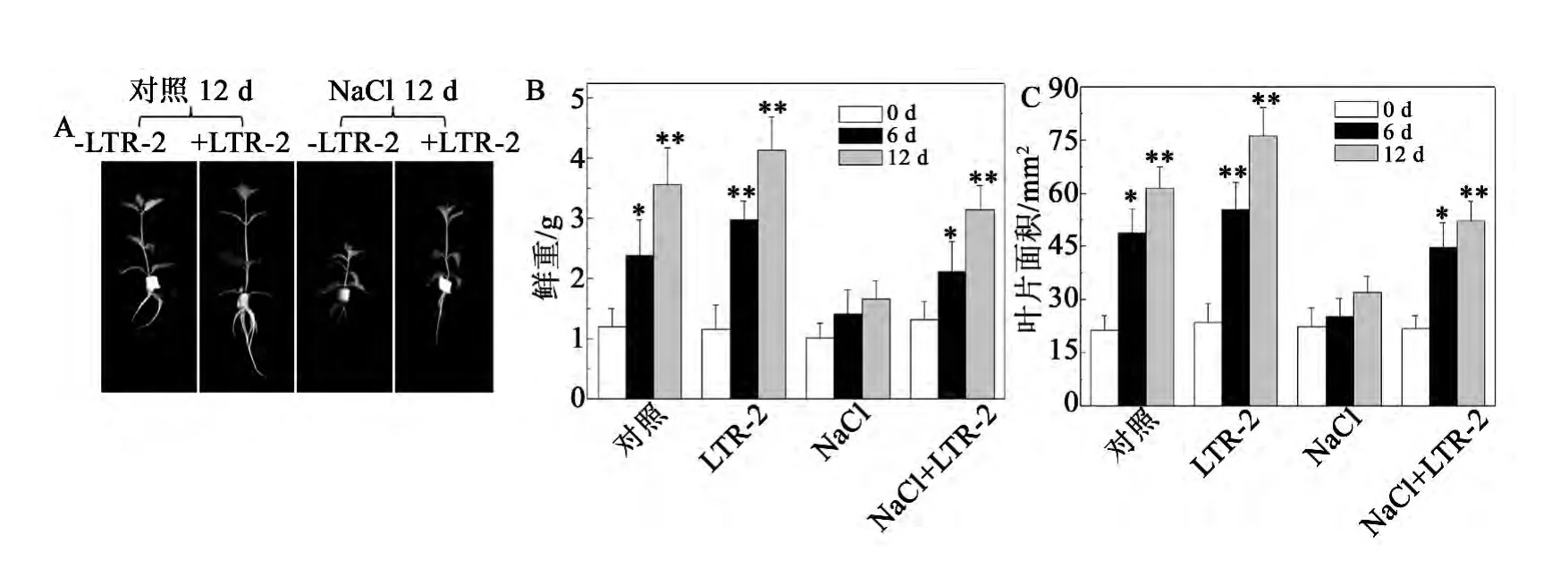
图1 NaCl胁迫下哈茨木霉LTR-2对椒样薄荷生长的影响Fig.1 Impact of LTR-2 on the growth of peppermint under NaCl stress
2.2 NaCl胁迫下哈茨木霉LTR-2对椒样薄荷光合活性的影响
NaCl胁迫对植物生长和代谢的影响是多方面的,尤以对光合作用的影响最为突出[26]。如图2所示,在200 mmol/L NaCl处理下,未经LTR-2处理的椒样薄荷叶片的叶绿素含量和净光合速率呈现出明显的下降,处理12 d后,其叶绿素含量和Pn值分别降至同期对照的56.5% ±4.1%和44.3% ±5.3%(图2B,C)。而经LTR-2处理的椒样薄荷植株的叶绿素含量和Pn值虽也有下降,但下降的程度明显降低,200 mmol/L NaCl处理12 d后,分别为同期对照的70.2% ±7.1%和68.1% ±6.8%,比同期的 LTR-2未处理组高11.1% ± 1.2%和19.5% ± 1.9%(图2B,C)。
PSII是光合系统中最敏感的组分,NaCl胁迫下,植物进行光合作用受到伤害的最初部位是与PSII紧密联系的[26]。荧光参数Fv/Fm反映了PSII的最大量子产量,能够反映PSII的光化学效率及活性。叶绿素荧光检测实验结果显示,在200 mmol/L NaCl处理下,未经LTR-2处理的椒样薄荷叶片的Fv/Fm值出现明显的下降,处理12 d后,降至了同期对照的81.9% ±6.6%(图2D)。而经LTR-2处理的椒样薄荷叶片的Fv/Fm值虽也有下降,但下降的程度明显降低,200 mmol/L NaCl处理12 d后,为同期对照的92.4% ±2.1%,且比同期的LTR-2未处理组高11.5% ± 1.3%(图2D)。
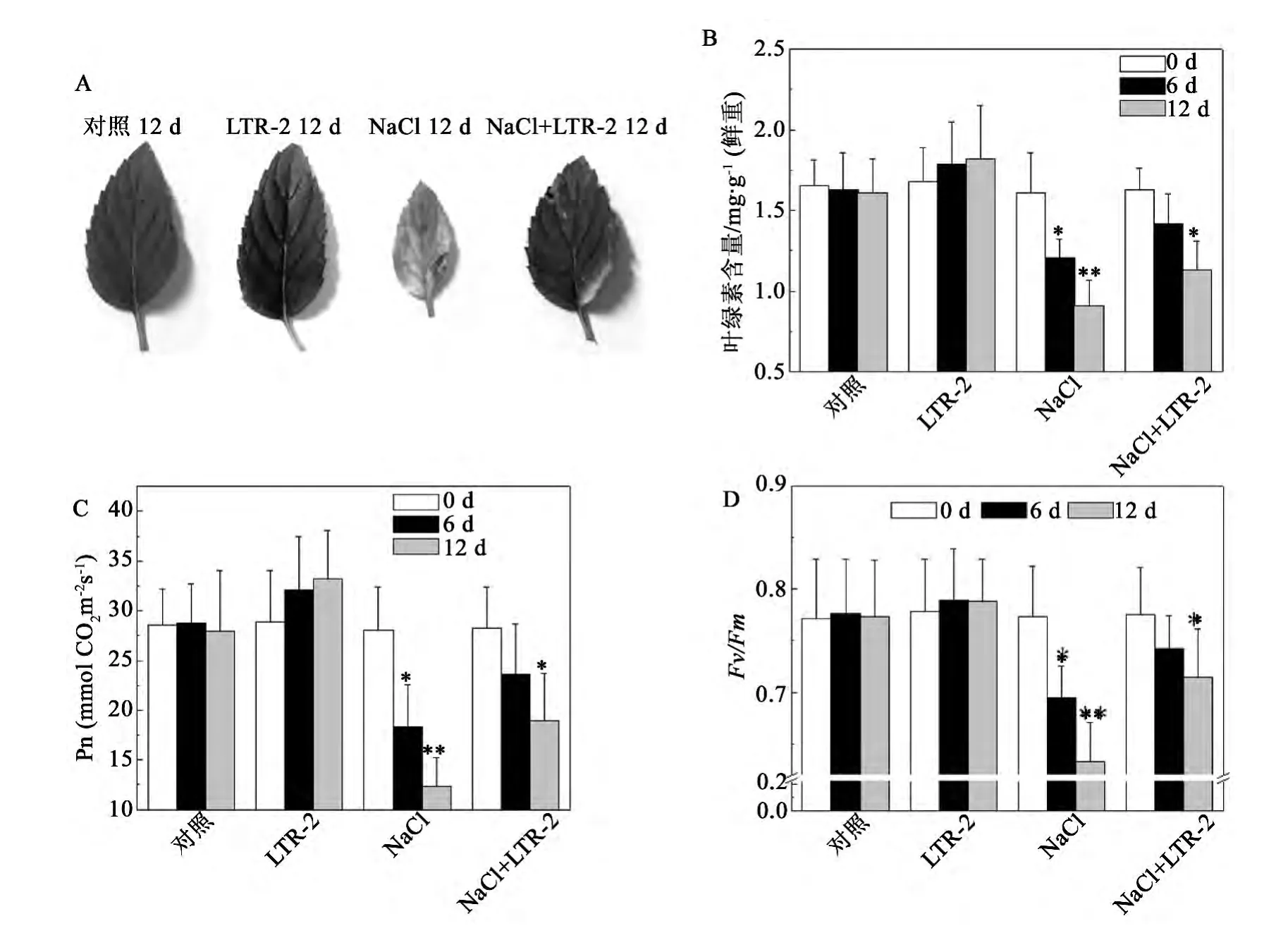
图2 NaCl胁迫下哈茨木霉LTR-2对椒样薄荷光合活性的影响Fig.2 Impact of LTR-2 on photosynthetic activity of peppermint under NaCl stress
2.3 NaCl胁迫下哈茨木霉LTR-2对椒样薄荷抗氧化能力的影响
NaCl胁迫对植物的伤害很大程度是由于诱导产生活性氧 (reactive oxygen species,ROS),引起氧化胁迫,破坏生物膜,导致膜脂质过氧化造成的[3]。我们利用H2O2定量检测试剂盒测定了NaCl胁迫诱导的椒样薄荷细胞内H2O2含量的变化。实验结果显示,在200 mmol/L NaCl处理下,未经LTR-2处理的椒样薄荷细胞内H2O2的含量显著升高,在处理12 d时,H2O2的含量为同期对照的5.3倍(图3A,B)。而在经LTR-2处理的椒样薄荷中,200 mmol/L NaCl处理造成的细胞内H2O2含量的增加得到了明显的缓解,处理12 d后,H2O2含量为同期对照的3.1倍,比同期的LTR-2未处理组降低了42.4% ±5.5%(图3A,B)。
MDA是膜脂过氧化的主要产物,其含量的变化在一定程度上反映了逆境胁迫对植物的伤害,其含量的多少代表了细胞膜脂过氧化的水平[20]。实验结果显示,在200 mmol/L NaCl处理下,未经LTR-2处理的椒样薄荷MDA的含量显著升高,处理12 d后,MDA的含量为同期对照的1.9倍(图3C)。而在经LTR-2处理的椒样薄荷中,200 mmol/L NaCl处理造成的MDA含量的增加得到了明显的缓解,处理12 d后,MDA含量为同期对照的1.5倍,比同期的LTR-2未处理组降低了48.7% ±6.7%(图3C)。
植物减轻或抵御NaCl胁迫对细胞的伤害的途径之一,是调节抗氧化系统来清除活性氧积累[3]。总抗氧化能力的检测结果表明,在经LTR-2处理后,椒样薄荷的总抗氧化能力显著提高,在200 mmol/L NaCl处理6 d和12 d后,总抗氧化能力比同期对照分别增加了171.7%和167.1%,且比同期的LTR-2未处理组分别增加了15.7% ± 3.2% 和 46.3% ± 6.1%(图 3D)。
随后,我们也检测了NaCl胁迫下LTR-2对椒样薄荷中CAT和SOD活性变化的影响。实验结果显示,在200 mmol/L NaCl处理下,未经LTR-2处理的椒样薄荷CAT和SOD活性呈现出先上升后下降的趋势 (图3E,F)。而在经LTR-2处理的椒样薄荷中,CAT活性在200 mmol/L NaCl处理6 d和12 d后,分别为同期对照的2.4倍和2.1倍,且比同期的LTR-2未处理组分别增加了了35.3% ± 3.3% 和74.2% ± 5.1%(图3E);SOD活性在200 mmol/L NaCl处理6 d和12 d后,分别为同期对照的1.7倍和1.6倍,且比同期的LTR-2未处理组分别增加了19.1% ± 2.7% 和50.6% ± 4.1%(图3F)。
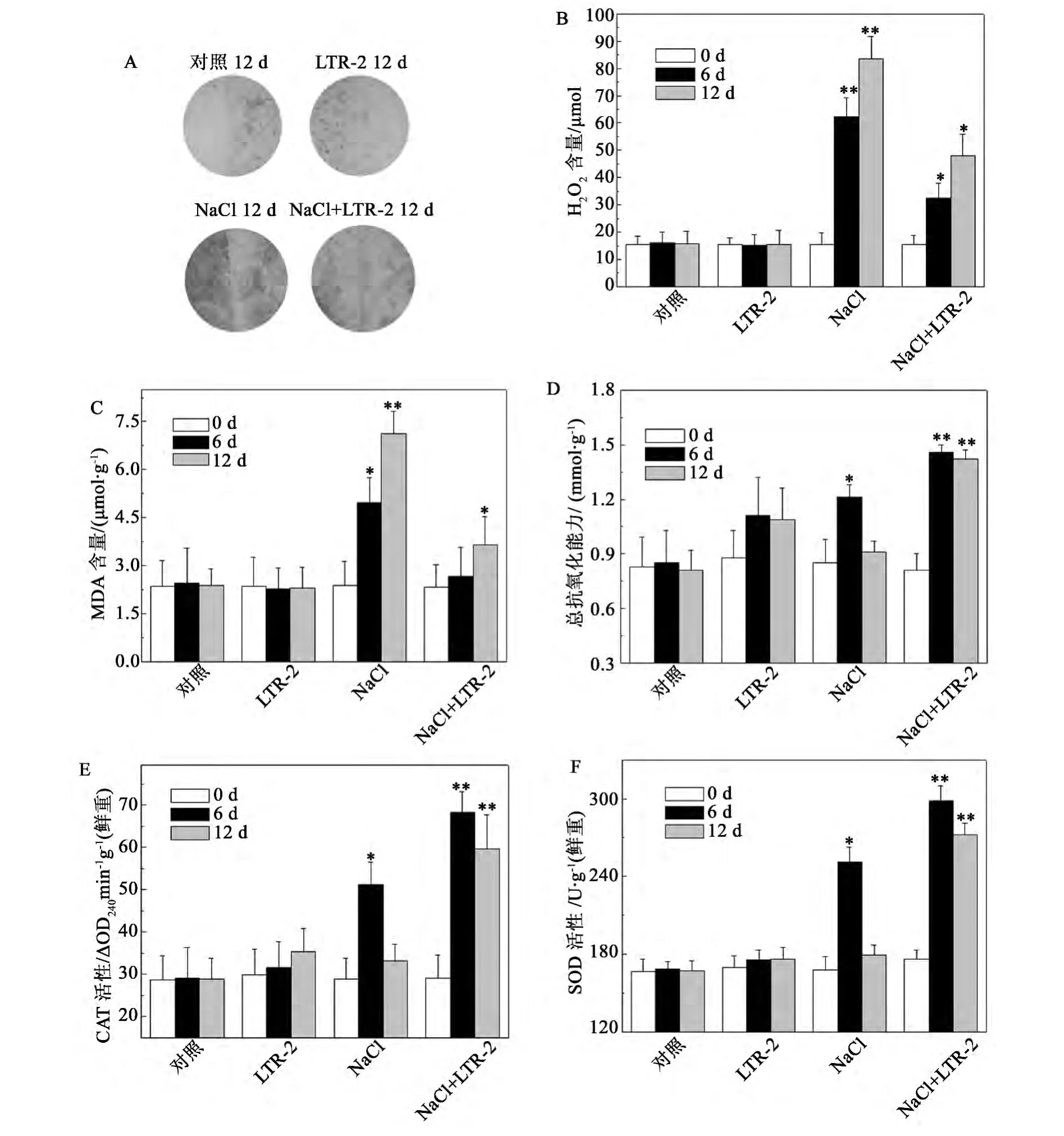
图3 NaCl胁迫下哈茨木霉LTR-2对椒样薄荷氧化损伤及抗氧化活性的影响Fig.3 Impact of LTR-2 on oxidative damage and antioxidant activity of peppermint under NaCl stress
2.4 NaCl胁迫下哈茨木霉LTR-2对椒样薄荷离子转运通道活性的影响
植物能够通过调节盐分的吸收和分布来抵御NaCl胁迫对细胞的伤害,细胞膜和液泡膜H+-ATPase以及Na+/H+逆向转运蛋白等离子转运通道在调节离子、溶质转运,参与建立和维持细胞离子稳态中起着重要的作用,是植物耐盐机制的重要组成部分[24-25]。活性检测的实验结果显示,在未经LTR-2处理的椒样薄荷中,200 mmol/L NaCl处理引起了细胞膜和液泡膜H+-ATPase以及Na+/H+逆向转运蛋白活性的提高,处理6 d后,它们的活性分别为同期对照的2.5、3.7和5.8倍(图4A,B,C)。而在经LTR-2处理的椒样薄荷中,细胞膜和液泡膜H+-ATPase以及Na+/H+逆向转运蛋白的活性更加显著地提高,在200 mmol/L NaCl处理6 d,它们的活性分别为同期对照的3.8、5.7 和9.5 倍 (图4A,B,C)。
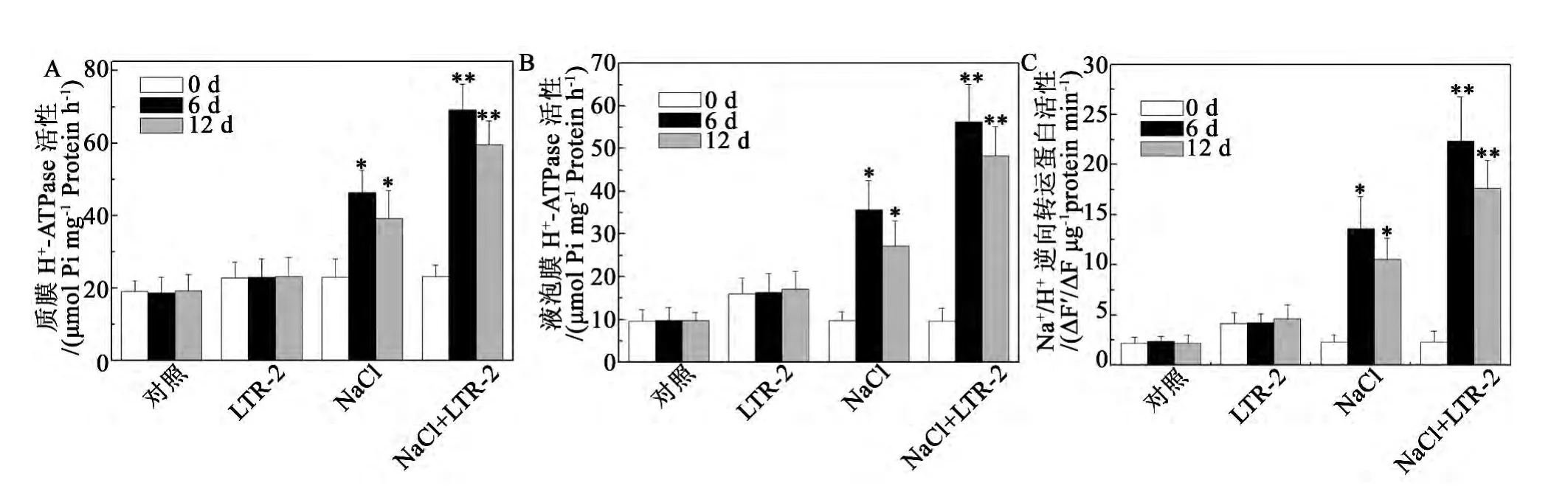
图4 NaCl胁迫下哈茨木霉LTR-2对椒样薄荷离子通道活性的影响。Fig.4 Impact of LTR-2 on ion channel activity of peppermint under NaCl stress
3 讨论
最近一些研究表明,木霉菌能赋予宿主植物耐受非生物胁迫的能力,并在缓解强胁迫的环境压力,如干旱、盐碱、低温以及重金属污染等发面发挥了重要作用[6-10]。我们的研究结果表明,LTR-2有效缓解了NaCl胁迫诱导的椒样薄荷生长抑制和光合损伤,增强了PSII的光化学效率及活性。
一般认为NaCl胁迫影响农林作物生长的主要原因是由高浓度Na+的渗透和离子胁迫综合效应造成的[3-4],通过限制盐分的过量吸收和调节抗氧化系统来清除活性氧积累等途径能够抵御NaCl胁迫对细胞的伤害[2-3]。
NaCl胁迫可以引起植物体内活性氧的过量产生,导致膜完整性的破坏,进而引起植物生长的抑制甚至死亡[1]。增强植物耐盐性的重要途径之一就是提高植物体内抗氧化系统的活性,增强抗氧化代谢水平[3]。之前的报道发现哈茨木霉1295-22能够提高甜玉米种子抵抗氧化胁迫的能力[6],而哈茨木霉T22能够通过减少植株衰老和胁迫过程中细胞内脂质过氧化物的含量来缓解氧化损伤[27]。Brotman等[28]的研究也指出木霉与植物根系定植后可以通过激活抗氧化系统来提高植物的耐盐性。我们的研究结果表明,LTR-2通过提高椒样薄荷体内抗氧化酶的活力来清除活性氧的积累,进而增强了椒样薄荷的耐盐性。
高盐条件下由于盐分吸收过多,会造成植物体内Na+过量积累,对细胞内的酶类和膜系统造成伤害,同时对其他离子的吸收产生拮抗作用,导致植物体内离子不平衡,从而引发生理生化代谢的紊乱[23]。细胞膜和液泡膜H+-ATPase以及Na+/H+逆向转运蛋白在植物耐盐中起着重要的作用,它们能够促进Na+的外排和区室化[24-25]。有益微生物调节宿主微生物和植物体内的离子平衡的研究已有报道。Li等[29]发现盐胁迫下Paxillus involutus strains MAJ和NAU能够调节宿主微生物细胞中的K+/Na+平衡。Brotman等[28]的研究指出定植在植物根部的木霉菌株Trichoderma asperelloides T203能够增强与离子平衡调节相关基因的表达。我们的研究结果表明LTR-2能够提高椒样薄荷细胞膜和液泡膜H+-ATPase以及Na+/H+逆向转运蛋白等离子转运通道的活性,进而调节盐分的吸收和分布,减轻离子毒害。
总之,本文初步探讨了LTR-2接种的椒样薄荷耐受NaCl胁迫的生理生化基础,为椒样薄荷在盐碱地区的引种及木霉菌剂的开发应用提供了理论和实验依据。
[1]KATSUHARA M,KAWASAKI T.Salt stress induced nuclear and DNA degradation in meristematic cells of barley roots[J].Plant& Cell Physiology,1996,37(2):169-173.
[2]PARIDA A K,DAS A B.Salt tolerance and salinity effects on plants:A review [J].Ecotoxicology and Environmental safety,2005,60(3):324-349.
[3]GOSSETT D R,MILLHOLLON E P,LUCAS M C.Antioxidant response to NaCl stress in salt-tolerant and salt-sensitive cultivars of cotton[J].Crop Science,1994,34:706-714.
[4]ZHENG Q S,LIU L,LIU Y L,et al.Effects of salt and water stresses on osmotic adjustment and osmotic accumulation in a loevera seedling[J].Journal of Plant Physiology and Molecular Biology,2003,29(6):585-588.
[5]MASTOURI F,BJÖRKMAN T,HARMAN G E.Seed treatment with Trichoderma harzianum alleviates biotic,abiotic,and physiological stresses in germinating seeds and seedlings[J].Biological Control,2010,100:1213-1221.
[6]BJÖRKMAN T,BLANCHARD L M,HARMAN G E.Growth enhancement of shrunken-2(sh2)sweet corn by Trichoderma harzianum 1295-22:effect of environmental stress[J].Journal of American Society for Horticultural Science,1998,123(1):35-40.
[7]BAE H,SICHER R C,KIM M S.The beneficial endophyte Trichoderma hamatum isolate DIS 219b promotes growth and delays the onset of the drought response in Theobroma cacao[J].Journal of Experimental Botany,2009,60(11):3279-3295.
[8]ADAMS P,DE-LEIJ F A A M.LYNCH J M.Trichoderma harzianum Rifai 1295-22 mediates growth promotion of Crack Willow(Salix fragilis)Saplings in both clean and metal-contaminated soil[J].Microbial Ecology,2007,54:306-313.
[9]QI W Z,ZHAO L.Study of the siderophore-producing Trichoderma asperellum Q1 on cucumber growth promotion under salt stress[J].Journal of Basic Microbiology,2013,53(4):355-364.
[10]HERMOSA R,BOTELLA L,KECK E,et al.The overexpression in Arabidopsis thaliana of a Trichoderma harzianum gene that modulates glucosidase activity,and enhances tolerance to salt and osmotic stresses[J].Journal of Plant Physiology,2011,168(11):1295-1302.
[11]杨合同,唐文华,李纪顺,等.绿色木霉LTR-2菌株的紫外线诱变改良[J].中国生物防治,2004,20(3):182-186.
[12]杨合同,唐文华,RYOER M,et al.木霉对棉花枯萎病菌和黄萎病菌的作用机理[J].山东科学,2005,18(3):9-15.
[13]陈凯,杨合同,李纪顺,等.绿色木霉菌LTR-2孢子提取物的抑菌活性及化学成分分析[J].微生物学通报,2007,34(3):455-458.
[14]杨合同,唐文华,宋家华.绿色木霉菌LTR-2对小麦纹枯病菌的作用机制[M]//植物病害研究与防治.北京:中国农业科技出版社,1998:504-507.
[15]曲乐.外源NO、哈茨木霉LTR-2对NaCl胁迫下椒样薄荷根系生长及氧化损伤的影响[D].淄博:山东理工大学,2012.
[16]陈小军.椒样薄荷高产栽培技术[J].农村科技,2008(7):72-73.
[17]姜殿勤,姜滨,张俭卫.野薄荷实用价值及人工栽培[J].特种经济动植物,2008(1):36-37.
[18]张侠,宋莉璐,任艳,等.椒样薄荷对NaCl胁迫的生理响应[J].安徽农业科学,2009,37(13):5967-5969.
[19]张宪政.植物生理学实验技术[M].沈阳:辽宁科学技术出版社,1989.
[20]张丽丽,马殿荣,林志强,等.耐盐杂草稻幼苗对NaCl胁迫响应及其生理基础[J].华北农学报,2010,25(4):123-129.
[21]ZHANG X,ZHOU S X,FU Y C,et al.Identification of a drought tolerant introgression line derived from Dongxiang common wild rice(O.rufipogon Griff.)[J].Plant Molecular Biology,2006,62(1/2):247-259.
[22]CHANCE B,MAEHLY A C.Assays of catalase and peroxidase[M]//Methods of Enzymology New York:Academic Press,1995:55,764-775.
[23]SUN J,CHEN S L,DAI S X,et al.NaCl-induced alternations of cellular and tissue ion fluxes in roots of salt-resistant and saltsensitive Poplar Species[J].Plant Physiology,2009,149:1141 –1153.
[24]QIU N W,CHEN M,GUO J R,et al.Coordinate up-regulation of V-H+-ATPase and vacuolar Na+/H+antiporter as a response to NaCl treatment in a C3 halophyte Suaeda salsa[J].Plant Science,2007,172:1218-1225.
[25]OLIAS R,ELJAKAOUI Z,LI J,et al.The plasma membrane Na+/H+antiporter SOS1 is essential for salt tolerance in tomato and affects the partitioning of Na+between plant organs[J].Plant Cell and Environment,2009,32(1):904-916.
[26]LIU J,SHI D C.Photosynthesis,chlorophyll fluorescence,inorganic ion and organic acid accumulations of sunflower in responses to salt and salt-alkaline mixed stress[J].Photosynthetica,2010,48(1):127-134.
[27]MASTOURI F,BJORKMAN T,HARMAN G E.Seed treatment with Trichoderma harzuanum alleviates biotic,abiotic,and physiological stresses in germinating seeds and seedlings[J].Biological Control,2010,100(11):1231-1221.
[28]BROTMAN Y,LANDAU U,CUADROS-INOSTROZA A,et al.Trichoderma-plant root colonization:escaping early plant defense responses and activation of the antioxidant machinery for saline stress tolerance[J].PLos Pathogens,2013,9(3):e1003221.doi:10.1371/journal.ppat.1003221.
[29]LI J,BAO S Q,ZHANG Y H,et al.Paxillus involutus strains MAJ and NAU mediate K+/Na+homeostasis in Ectomycorrhizal Populus × canescens under sodium chloride stress[J].Plant Physiology,2012,159(4):1771-1786.
