甘草酸标准样品的研制
2014-12-03王岱杰周晓晶王尉于金倩王晓李强耿岩玲DanStaerk
王岱杰,周晓晶,王尉,于金倩,王晓,李强,耿岩玲* ,Dan Staerk
(1.山东省分析测试中心,山东济南250014;2.北京理化分析测试中心,北京100089)
甘草是我国常用大宗药材,为豆科植物甘草(Glycyrrhiza uralensis Fisch.)、胀果甘草(Glycyrrhiza inflata Bat.)或光果甘草(Glycyrrhiza glabra L.)的干燥根和根茎,具有补脾益气、清热解毒、祛痰止咳、缓急止痛以及调和诸药之功效。它用于脾胃虚弱,倦怠乏力,心悸气短,咳嗽痰多,脘腹、四肢挛急疼痛,痈肿疮毒和缓解药物毒性、烈性[1]。甘草具有抗寒、耐热、耐旱以及抗盐碱等优良特性,适生性和抗逆性强,生命力旺盛,为我国干旱、半干旱地区重要的植物资源之一。甘草酸(glycyrrhizic acid)又名甘草甜素(结构式见图1),属于三萜类化合物,是甘草中重要的化学成分,也是药典中规定的甘草、炙甘草、甘草流浸膏和甘草浸膏质量控制的重要指标[2-3]。甘草酸具有抗病毒、镇咳祛痰、抗炎和保肝等功效[4-14],其甜度高(甜度为蔗糖的200~300倍)、热能低且安全无毒,广泛应用于食品、饮料、医药、化妆品和烟草等行业。截至目前,我国尚无甘草酸标准样品,市场上销售的甘草酸对照品纯度也参差不齐。因此,为了满足药材及成药分析检测及质量控制工作的需求,保证检测结果的准确性、可比性和溯源性,本文制备了甘草酸标准样品。
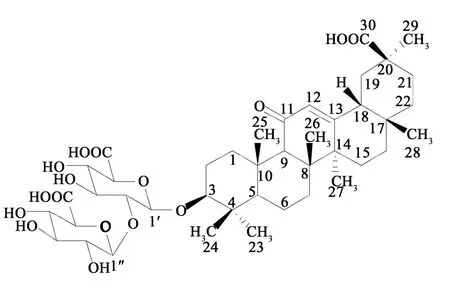
图1 甘草酸的化学结构式Fig.1 Chemical structure of glycyrrhizic acid
1 实验部分
1.1 仪器
旋转蒸发仪R-3(瑞士BUCHI公司);SCIENTZ-10N冷冻干燥仪(宁波新芝生物科技股份有限公司);Agilent 1260高效液相色谱仪(美国Agilent公司);Agilent 6520 Q-ToF液质联用仪(美国Agilent公司);WRS-1B数字熔点仪(上海精密科学仪器有限公司);UV-2550型紫外可见分光光度计(日本岛津公司);INOVA 600 MHz核磁共振波谱仪(美国Varian公司);Agilent 6520 Q-ToF液质联用仪(美国Aglient公司);Vario EL III全自动元素分析仪(德国ELEMENTAR公司)。
1.2 原料与试剂
柱色谱用硅胶、薄层色谱用硅胶GF254板(青岛海洋化工厂);HPLC用乙腈、甲醇为色谱纯(美国天地公司);乙酸乙酯、丁酮、甲酸、氯仿、甲醇、盐酸等均为分析纯(天津市广成化学试剂有限公司);水为去离子水;10%甘草酸提取物(甘肃泛植生物科技有限公司)。
1.3 样品制备
质量分数10%甘草酸提取物水溶解,稀盐酸调pH值至2.0,过滤沉淀,室温晾。硅胶柱色谱进行分离,氯仿/甲醇梯度洗脱,分部收集甘草酸组分,薄层色谱跟踪监测。较纯组分放置于通风橱内,乙醇重结晶,过滤并干燥。
1.4 纯度分析方法
等度HPLC分析条件:C18(250 mm×4.6 mm,5 μm)色谱柱;流动相:乙腈-0.5%乙酸水溶液(38:62,V/V);流速:1.0 mL/min;柱温:30℃;运行时间:30 min;检测波长:237 nm。
梯度HPLC分析条件:C18(250 mm×4.6 mm,5 μm)色谱柱;流动相:A为乙腈,B为0.5%乙酸水溶液;梯度洗脱:0~20 min,38%A;20 ~40 min,38%A ~100%A;40 ~50 min,100%A;流速:1.0 mL/min;柱温:30℃;运行时间:50 min;检测波长:237 nm。
薄层色谱条件:乙酸乙酯-水-甲酸(6:1:1,V/V)和氯仿-甲醇-甲酸(4:1:1,V/V),荧光检测和硫酸乙醇显色剂检测。
MS条件:ESI电喷雾离子源,毛细管电压4.0 kV;载气:普氮;载气流速:10 L/min;载气温度:300℃,扫描范围为m/z=100~1000。
1.5 结构表征
采用UV、IR、MS和NMR等方法对甘草酸进行结构表征。
1.6 均匀性检验
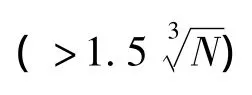
1.7 稳定性检验
考察两周内甘草酸样品甲醇、乙腈两种溶剂的稳定性。甘草酸样品于2~8℃保存,以2年为期,对制备的甘草酸样品每6个月取样检验,按1.4等度HPLC分析,以面积百分比读取样品的纯度值,每份试样以测定5次的平均值为其定值结果,用t检验对数据进行统计分析[15]。
1.8 定值
按照标准样品工作导则,采用多个实验室协作实验定值,参加实验室的数目为8个[15-18]。随机抽取24瓶样品,每个定值实验室送3瓶,每瓶平行测定2次。定值实验室将样品配成一定浓度的溶液,高效液相色谱仪测定,采用峰面积归一化法进行纯度定值。
2 结果与讨论
2.1 纯度分析
分别采用等度和梯度HPLC对甘草酸样品进行洗脱,DAD检测器进行3D扫描,扣除溶剂峰,扫描色谱图未见明显杂质色谱峰。237 nm检测波长下,对甘草酸样品色谱峰进行面积归一化定量,扣除溶剂峰,等度和梯度HPLC纯度分别为99.32%和99.35%。从薄层色谱图看,乙酸乙酯-水-甲酸(6:1:1,V/V)和氯仿-甲醇-甲酸(4:1:1,V/V)展开体系的Rf值分别为0.85和0.64,荧光检测和硫酸乙醇显色剂检测未见明显杂质。通过考察甘草酸正离子模式和负离子模式的总离子流图,未见明显杂质峰。
2.2 结构表征
采用UV,IR,MS和NMR 等方法对甘草酸进行结构鉴定,数据如下。UV λEtOHmax:237.2 nm;IR υcm-1max:3 398(νOH),2 949(νCH),1 715(νC=O),1 656(νC=C),1 455,1 370(νCH),1 080,1 045(νCO);ESI-MS:m/z 823.412 0[M+H]+,845.393 2[M+Na]+,821.387 3[M -H]-。1H 和13C-NMR数据见表1、表2。以上数据与文献[19]比较,确定为甘草酸(Glycyrrhizic acid)。
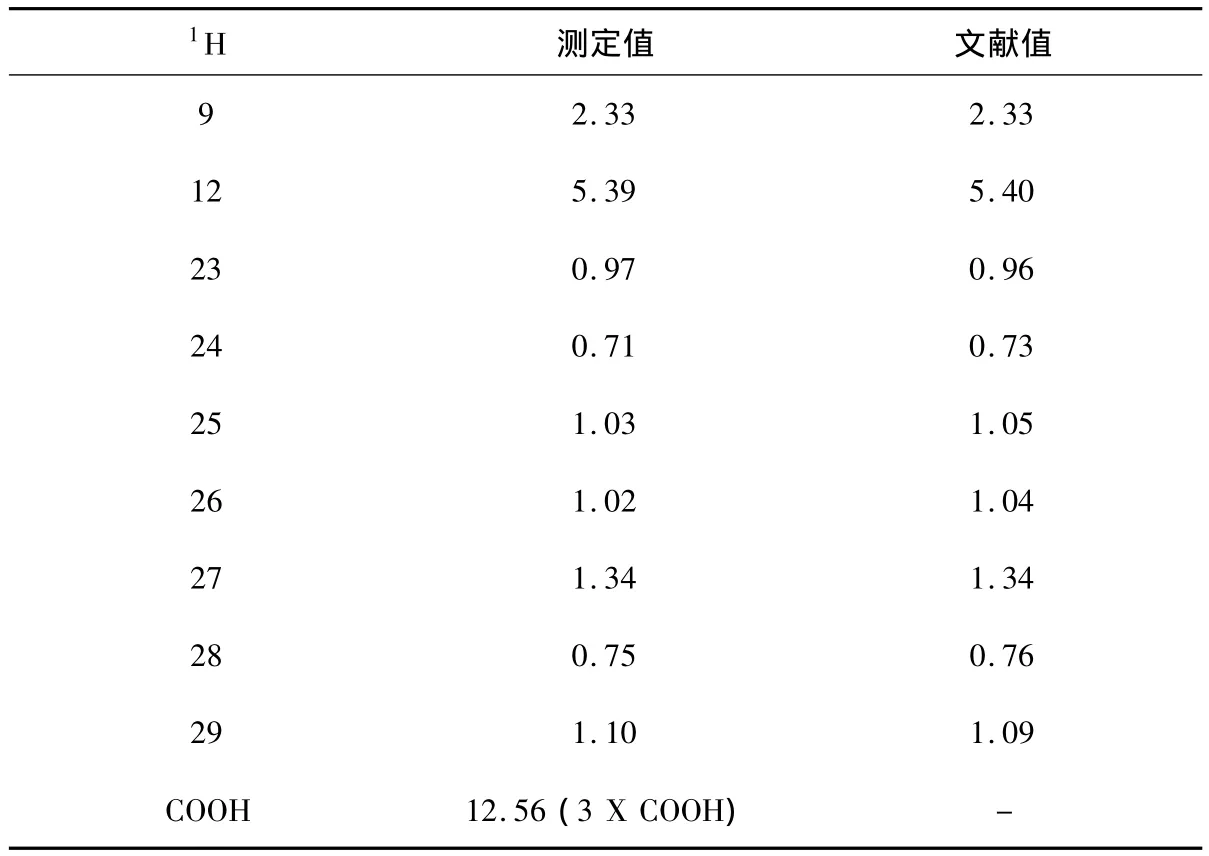
表1 甘草酸的核磁共振氢谱数据(氘代溶剂DMSO-d6)Table 1 The1H-NMR data of glycyrrhizic acid(DMSO-d6)
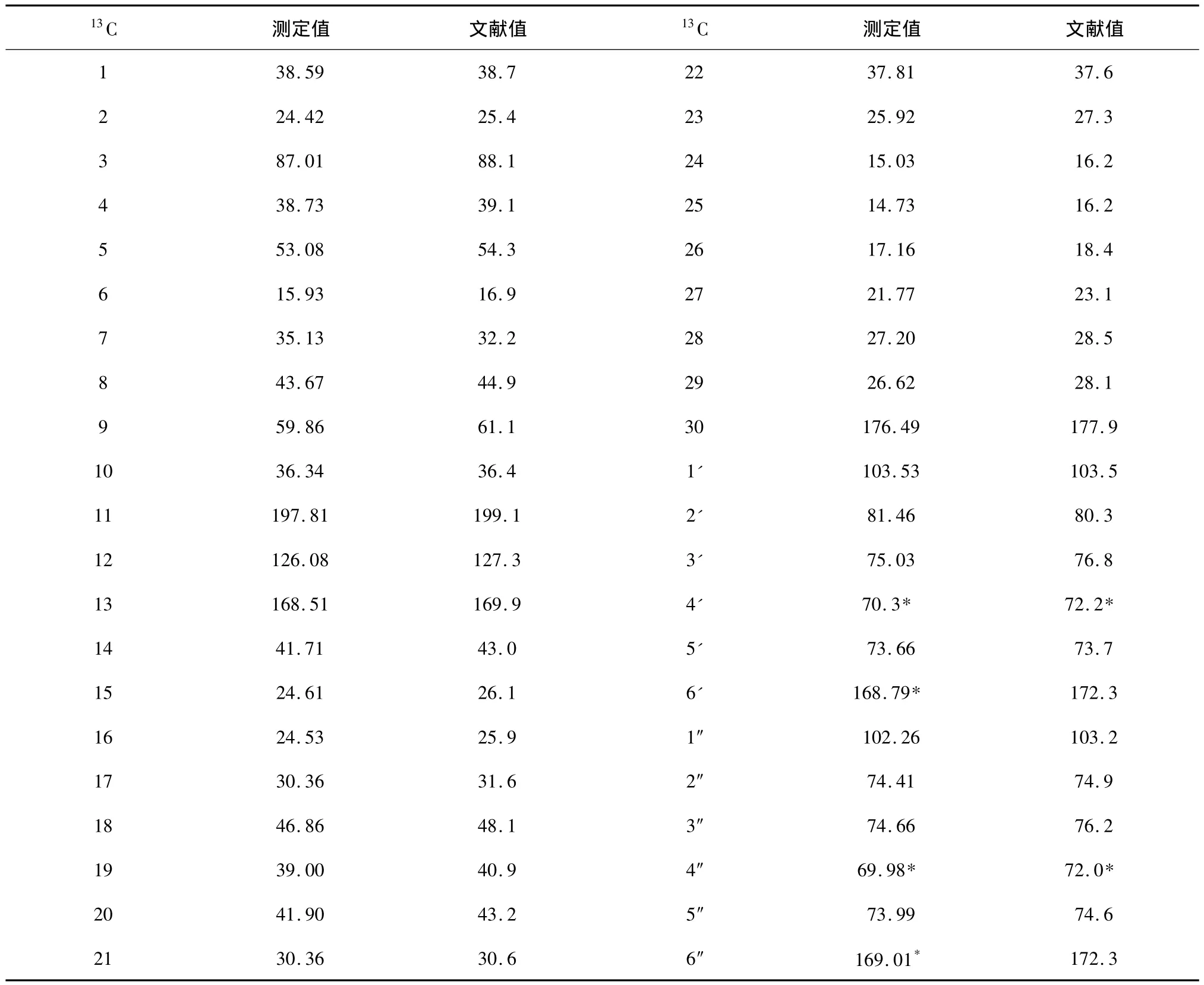
表2 甘草酸的核磁共振碳谱数据(氘代溶剂DMSO-d6)Table 2 The13C-NMR data of glycyrrhizic acid(DMSO-d6)13C
2.3 均匀性检验
以F检验,确定甘草酸标准样品的均匀性数据是否附合正态分布。其结果见表3~5。
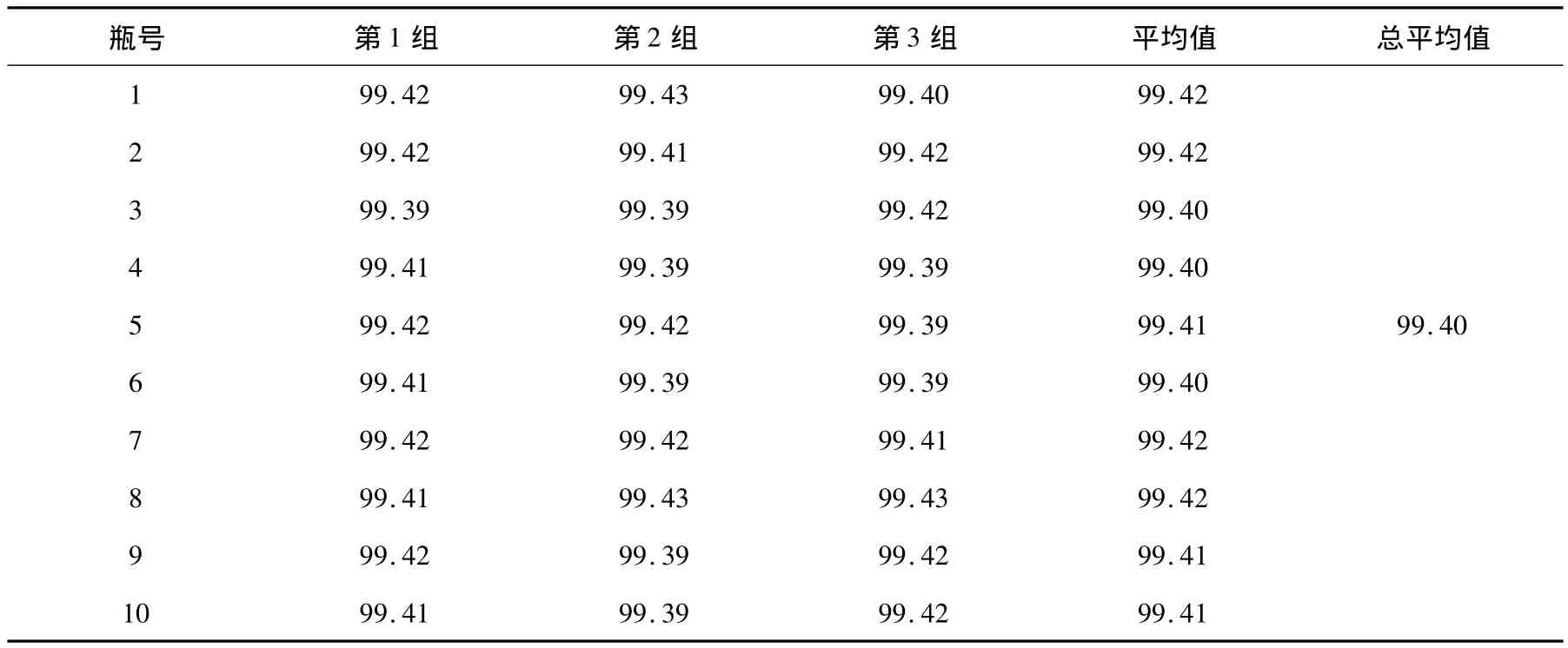
表3 均匀性检验结果(%)Table 3 Homogeneity test result(%)
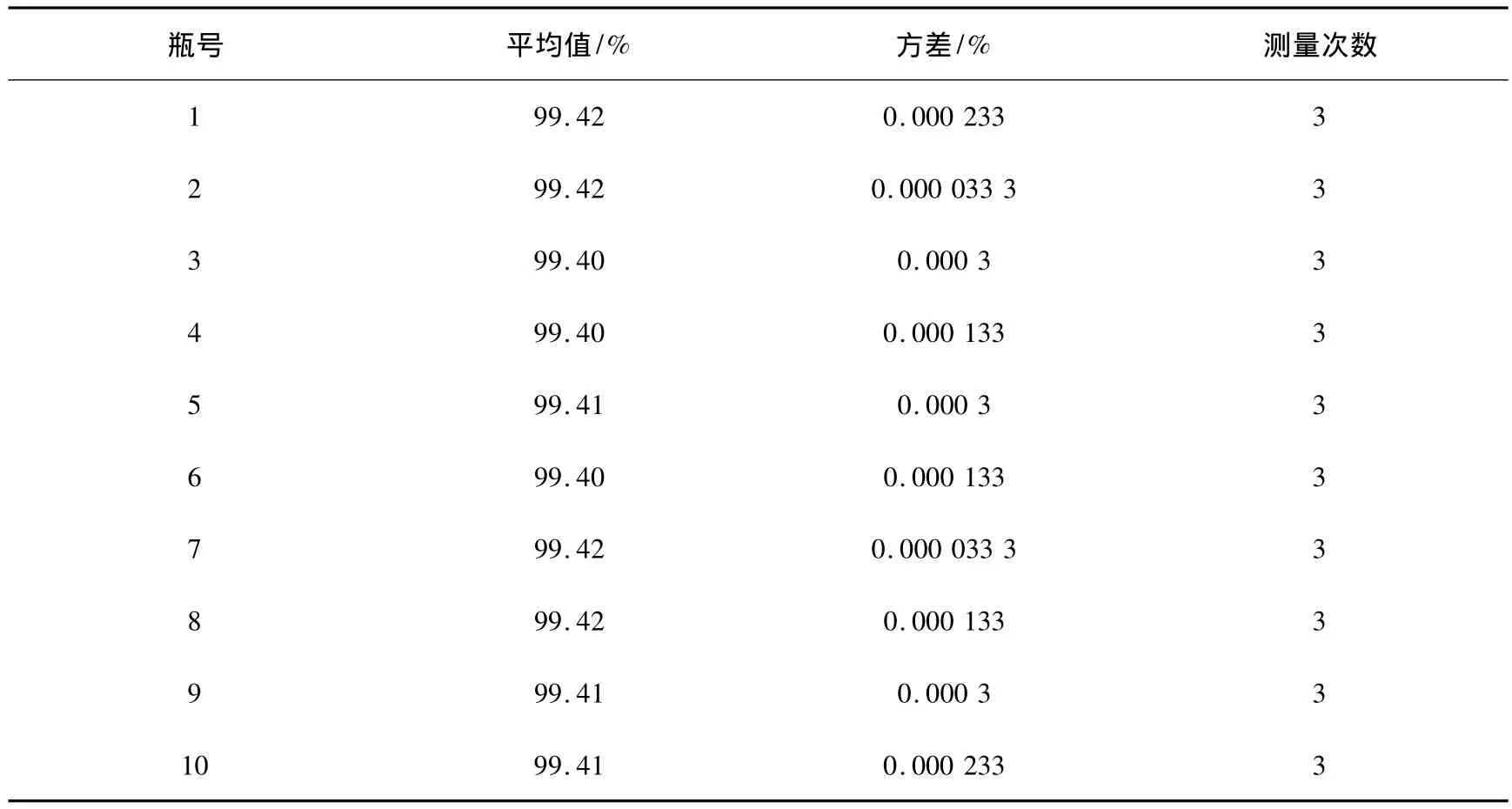
表4 每瓶的平均值、方差和测量次数Table 4 Mean value,variance and measurement numbers for every bottle

表5 均匀性研究的方差分析结果Table 5 Variance analysis of homogeneity test
瓶间方差用下式计算
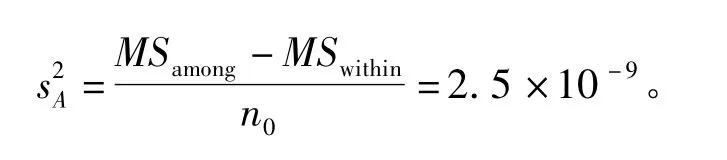
瓶间标准偏差为
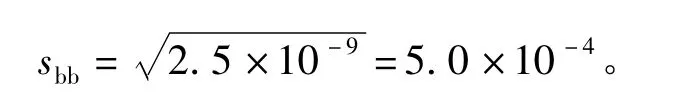
重复性标准偏差可由MSwithin计算

均匀性引入的不确定度为
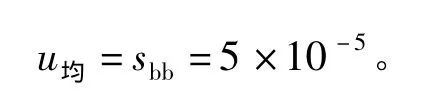
从表5可见,以 υ1(即组间)=9及 υ2(即组内)=20查 F界值表,得 F0.05(9,20)=2.94,由于F=MS间/MS内=1.41<F0.05(9,20),因此研制的甘草酸标样样品是均匀的。
2.4 稳定性检验
用t检验对数据进行统计分析,采用直线作为经验模型,观察斜率值是否有显著变化,以此对标准样品的稳定性变化进行预测,稳定性检验结果见表6。
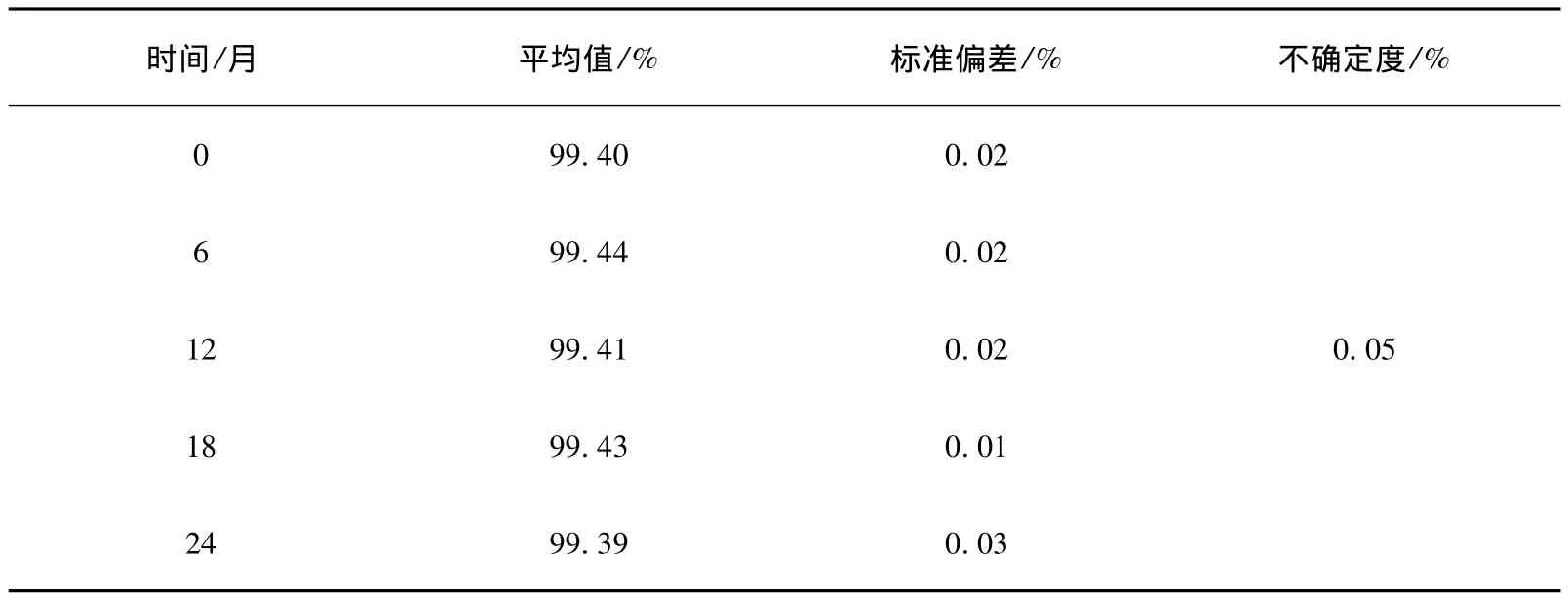
表6 稳定性检验结果Table 6 Stability test result
斜率按下式计算
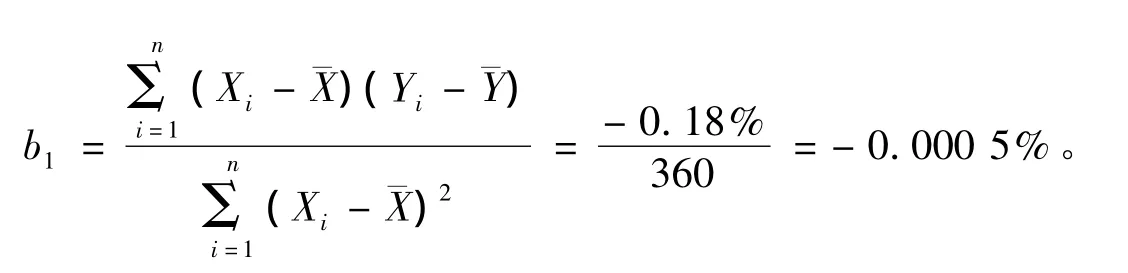
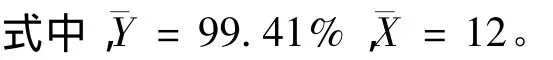
截距由下式计算
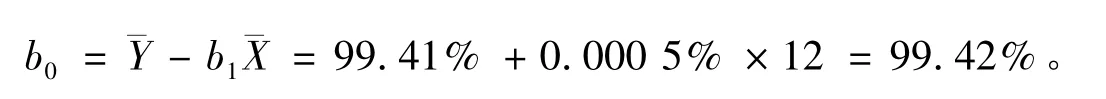
直线上的点的标准偏差可由下式计算
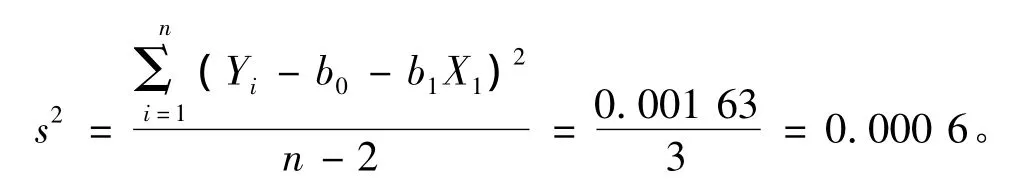
则s=0.03%,与斜率相关的不确定度用下式计算
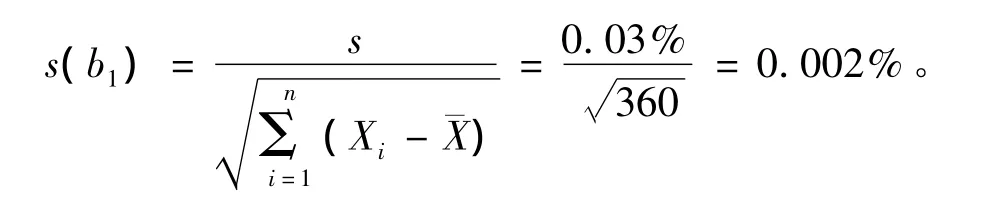
自由度为n-2和p=0.95(95% 置信水平)的分布t因子为
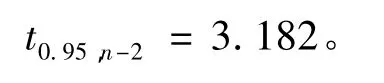
由于
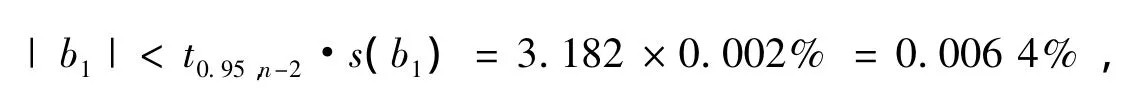
即|b1|<0.006 4%,因此斜率的变化不显著,即甘草酸标准样品在2年内未观测到明显的不稳定性。
稳定性的不确定度。
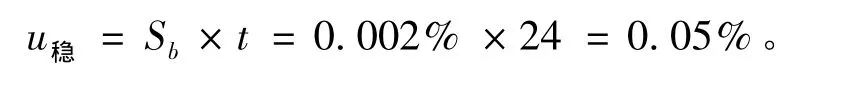
2.5 定值
根据高效液相色谱法峰面积归一法所得全部测定结果,计算出甘草酸标准样品的标准值。定值结果见表7。
根据表7数据计算测定结果的总平均值
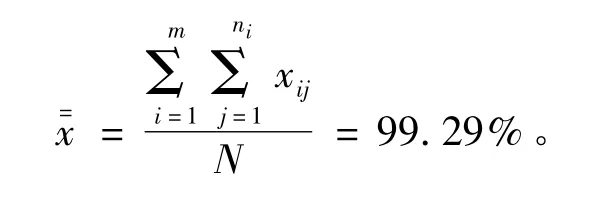
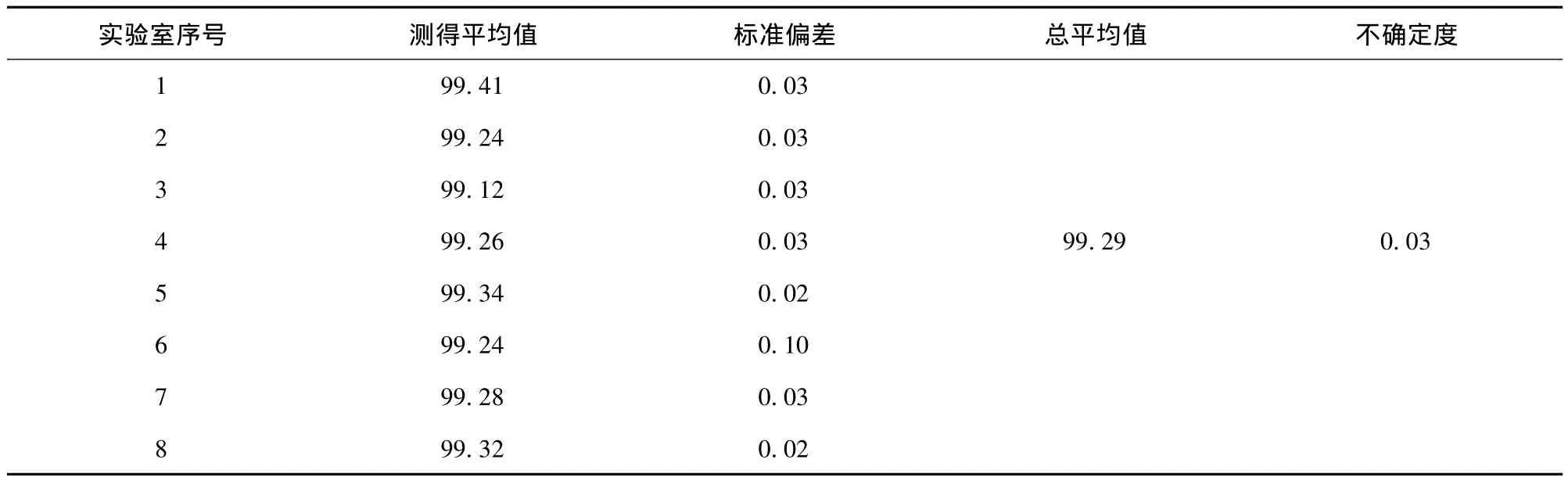
表7 甘草酸纯度定值结果及不确定度(%)Table 7 Purity certification results of glycyrrhizic acid and its uncertainty(%)
实验室平均值的标准偏差
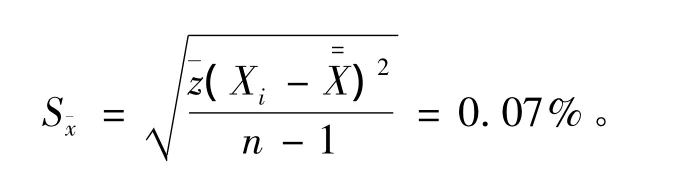
总平均值标准偏差
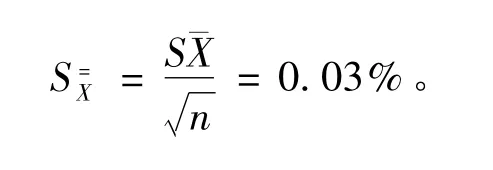
多家定值引入的不确定度
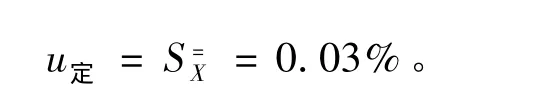
研制的标准样品定值结果的不确定度由以下几部分组成:
(1)均匀性检验引入的不确定度;
(2)稳定性检验引入的不确定度;
(3)多家定值引入的不确定度。
各不确定度分量互不相关,因此合成不确定度
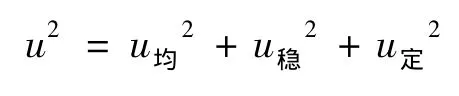
代入数据计算得u=0.005 9%。
置信区间95% 时,k=2,则扩展不确定度U=2 u=0.005 9% ×2=0.12%。
3 结论
本研究针对甘草酸缺乏国家实物标样的现状,进行了甘草酸标准样品的研制。根据GB/T15000.3-2008标准样品工作导则,对制备的样品进行了均匀性、稳定性及定值研究。制备出标准值为99.29%、扩展不确定度(95%置信区间)为0.12%的甘草酸标准样品,建立了甘草酸标准样品的制备方法,该标准样品符合国家一级标准样品的技术规范要求,填补了国内该领域的研究空白。该标准样品的研制可满足甘草药材及成药分析检测、质量控制工作的需求,为其检测结果的准确性、可比性和溯源性提供技术支撑和量值溯源保证。
[1]国家药典委员会.中华人民共和国药典2010年版一部[M].北京:化学工业出版社,2010:80-81.
[2]国家药典委员会.中华人民共和国药典2010年版一部[M].北京:化学工业出版社,2010:81.
[3]国家药典委员会.中华人民共和国药典2010年版一部[M].北京:化学工业出版社,2010:376.
[4]SUI X W,YIN J C,REN X F.Antiviral effect of diammonium glycyrrhizinate and lithium chloride on cell infection by pseudorabies herpesvirus[J].Antiviral Res,2010,85(2):346 -353.
[5]HARADA S.The broad anti-viral agent glycyrrhizin directly modulates the fluidity of plasma membrane and HIV-1 envelope[J].Biochem J,2005,392(1):191-199.
[6]RAHMAN S,SULTANA S.Glycyrrhizin exhibits potential chemopreventive activity on 12-O-tetradecanoyl phorbol-13-acetateinduced cutaneous oxidative stress and tumor promotion in swiss albino mice[J].J Enzym Inhib Med Chem,2007,22(3):363-369.
[7]郑虎占,董泽宏,余靖.中药现代研究与应用[M].北京:学苑出版社,1997:1256-1279.
[8]吕小华,吴铁,覃冬云.甘草酸防治小鼠哮喘的作用及其免疫学机理探讨[J].时珍国医国药,2006,17(8):1434-1435.
[9]吕小华,吴铁,覃冬云.甘草酸对哮喘小鼠气道炎症及磷脂酶A2活性的影响[J].时珍国医国药,2007,18(10):2379.
[10]LEE C H,PARK S W,KIM Y S,et al.Protective mechanism of glycyrrhizin on acute liver injury induced by carbon tetrachloride in mice[J].Biol Pharm Bull,2007,30(10):1898 -1904.
[11]YOSHIDA T,ABE K,IKEDA T,et al.Inhibitory effect of glycyrrhizin on lipopolysaccharide and d-galactosamine-induced mouse liver injury[J].Eur J Pharmacol,2007,576(1/2/3):136 -142.
[12]TANG B,QIAO H,MENG F,et al.Glycyrrhizin attenuates endotoxin-induced acute liver injury after partial hepatectomy in rats[J].Braz J Med Biol Res,2007,40(12):1637 -1646.
[13]ABE K,IKEDA T,WAKE K,et al.Glycyrrhizin prevents of lipopolysaccharide/D-galactosamine-induced liver injury through down-regulation of matrix metalloproteinase-9 in mice[J].J Pharm Pharmacol,2008,60(1):91 -97.
[14]陈云华,万新,孙建宁,等.甘草酸、甘草苷、异甘草素对醋氨酚人肝细胞损伤模型的保护作用比较[J].中国实验方剂学杂志,2012,18(4):245-248.
[15]GB/T 15000.3-2008,标准样品工作导则(3)标准样品定值的一般原则和统计方法[S].
[16]GB/T15000.1-1994,标准样品工作导则(1)在技术标准中陈述标准样品的一般规定[S].
[17]GB/T15000.2-1994,标准样品工作导则(2)标准样品常用术语和定义[S].
[18]GB/T 8170-2008,数值修约规则与极限数值的表示和判定[S].
[19]李文,沙沂,陈丽霞,等.甘草酸二铵18位差向异构体的核磁共振研究[J].沈阳药科大学学报,2005,22(4):273-278.
