天津汉族胎儿D18S53、D18S59和D18S488 3个STR基因座遗传多态性研究*
2014-12-03李晓洲史云芳岳天孚
李晓洲 刘 静 史云芳 琚 端 李 岩 张 颖 岳天孚
18-三体综合征(edwards syndrome,ES)是人类常见的染色体病,无法治疗,只能通过产前诊断避免患儿出生,但传统的产前诊断方法操作复杂,技术要求高,培养时间长,不能满足产前诊断需要。且目前产前诊断的需求增大较快,因此快速产前诊断方法的建立迫在眉睫。短串联重复序列(short tandem re⁃peat,STR)的多态性较丰富,定量荧光聚合酶链式反应(quantitative fluorescence polymerase chain reac⁃tion,QF-PCR)灵敏、快捷且自动化的特点[1],两者结合可作为快速基因诊断染色体数目异常的首选方法。但由于国内缺乏18号染色体STR基因座的遗传学信息,因此很难实现对ES快速基因诊断,尤其限制其在产前诊断中的应用。本研究应用QF-PCR技术研究天津汉族胎儿18号染色体上D18S53、D18S59和D18S488 3个STR基因座遗传多态性,为ES的快速产前基因诊断提供实验依据。
1 对象与方法
1.1 研究对象 64例绒毛和374例羊水样本取自2004年4月—2009年10月于我院产前诊断中心就诊的438例高危妊娠妇女,孕周8~24周,均签署产前诊断知情同意书。
1.2 方法
1.2.1 DNA提取 取绒毛0.5~1 mg或羊水1 mL,按本室常规方法提取DNA。
1.2.2 引物选择 根据NCBI的UniSTS数据库(http://www.ncbi.nlm.nih.gov/unists),选择 D18S53、D18S59和 D18S488 3个STR基因座并确定引物序列。正向引物5′端均由荧光染料 5-羧基-荧光素(caboxyfluorescein-5-succimidyl ester,FAM)标记,引物序列由北京鼎国生物技术有限责任公司合成,见表1。
1.2.3 PCR 扩增 PCR 反 应 体 系 25 μL:1×PCR buffer,dNTPs 0.2 mmol/L,Taq酶0.04 U/μL,模板DNA约0.6 ng,引物浓度为0.12 μmol/L。PCR扩增条件:预变性94℃2 min;变性94℃30 s,退火52℃30 s,延伸72℃1 min,共35个循环;延伸72℃10 min,4℃保存。
1.2.4 PCR扩增产物检测 PCR反应结束后,4%聚丙烯酰胺凝胶电泳检测扩增产物,ABI PRISM 377自动测序仪扫描电泳图,用GeneScan 3.1软件进行数据提取,安装胶图的Matrix文件,选择合适内标并设置合适的分析参数,打开Binthere软件,设置片段大小范围,并把GeneScan 3.1软件分析得到的数据导入,得到胶图对应的峰图及相关数据。根据分子内标记电泳位置,分析出电泳的DNA片段的大小及荧光信号峰面积。将等位基因片段由小到大顺序排列并编号,据此得到各样本的基因型。
1.3 统计学方法 数据用SPSS 13.0软件进行分析,验证是否符合H-W平衡定律(P>0.05)。对表现为杂合子的个体,统计其峰面积比值的均数、标准差及95%参考值范围。采用PowerStatsV12软件进行统计分析,分别计算3个STR基因座的观察杂合度(heterozygosity of observation,Ho)、多态信息量(polymorphism information content,PIC)、个体识别率(proba⁃bility of discrimination power,DP)、非父排除率(probability of exclusion,PE)等群体遗传学数据。
2 结果
2.1 3个基因座基因频率分布 438例样本均扩增成功。D18S53 STR基因座共发现15种等位基因,片段长度为161~185 bp,由小到大依次命名为1~15,共发现52种基因型,分布符合H-W定律(χ2=23.94,P=1.00)。D18S59 STR基因座共发现13种等位基因,片段长度为128~152 bp,由小到大依次命名为1~13,共发现47种基因型,分布符合H-W定律(χ2=52.10,P=0.19)。D18S488 STR基因座共发现15种等位基因,片段长度为236~264 bp,由小到大依次命名为1~15,共发现42种基因型,分布符合H-W定律(χ2=45.11,P=0.23)。3个STR基因座等位基因频率见表2,基因座电泳图,见图1。438例样本的3个STR基因座共1 067个样本表现为杂合子,2个峰的峰面积比值为0.50~1.76,x=1.06,s=0.21,95%CI:0.65~1.47,见图2~4。
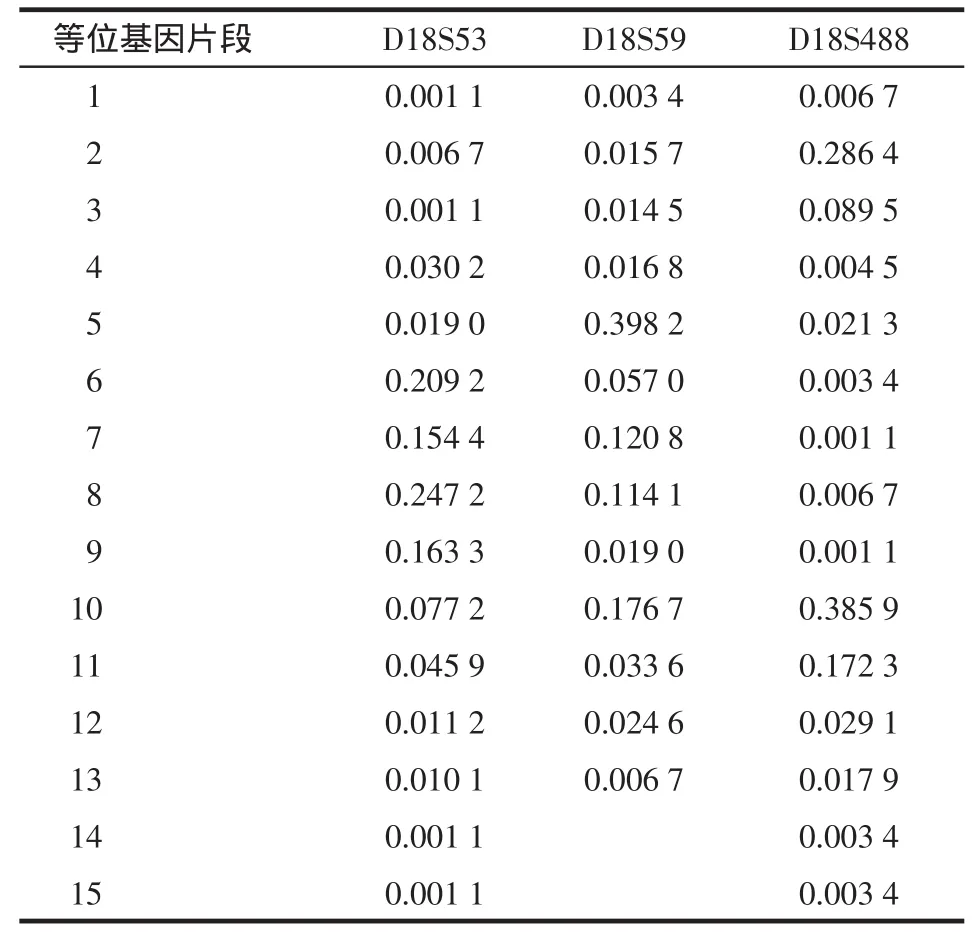
Table 2 The allele frequencies of STR loci D18S53,D18S59 and D18S488表2 D18S53、D18S59和D18S488 STR基因座等位基因频率
2.2 遗传多态性统计 天津汉族胎儿D18S53、D18S59和D18S488 3个STR基因座Ho、PIC、DP和PE等群体多态性数据见表3。
3 讨论
STR基因座即微卫星DNA,重复次数通常为15~30次。一般1个STR基因座有十几个等位基因片段,其长度范围约在400 bp以下,其核心序列多为(TG)n、(AAT)n、(GATA)n等,以(CA)n最常见,多存在于非翻译区及内含子中。由于STR基因座的高度多态性及孟德尔共显性遗传等特点使其广泛用于基因作图、筛选目的基因、遗传病连锁分析、群体遗传学研究、法医个体识别和亲权鉴定等方面。1991年Ed⁃wards等[2]首次应用STR-PCR建立第二代DNA指纹技术用以诊断X染色体单体疾病。1993年Mansfield等[3]首先以STR基因座作为21号染色体的遗传标记,用QF-PCR对唐氏综合征患者进行基因诊断,此后陆续有学者利用STR基因座的独特优势进行染色体数目异常诊断。

Table 1 The characteristics of STR loci D18S53,D18S59and D18S488表1 D18S53、D18S59和D18S488基因座特征

Figure 1 Electrophoresis result of D18S53,D18S59 and D18S488 STR loci图1 D18S53、D18S59和D18S488 3个STR基因座电泳图
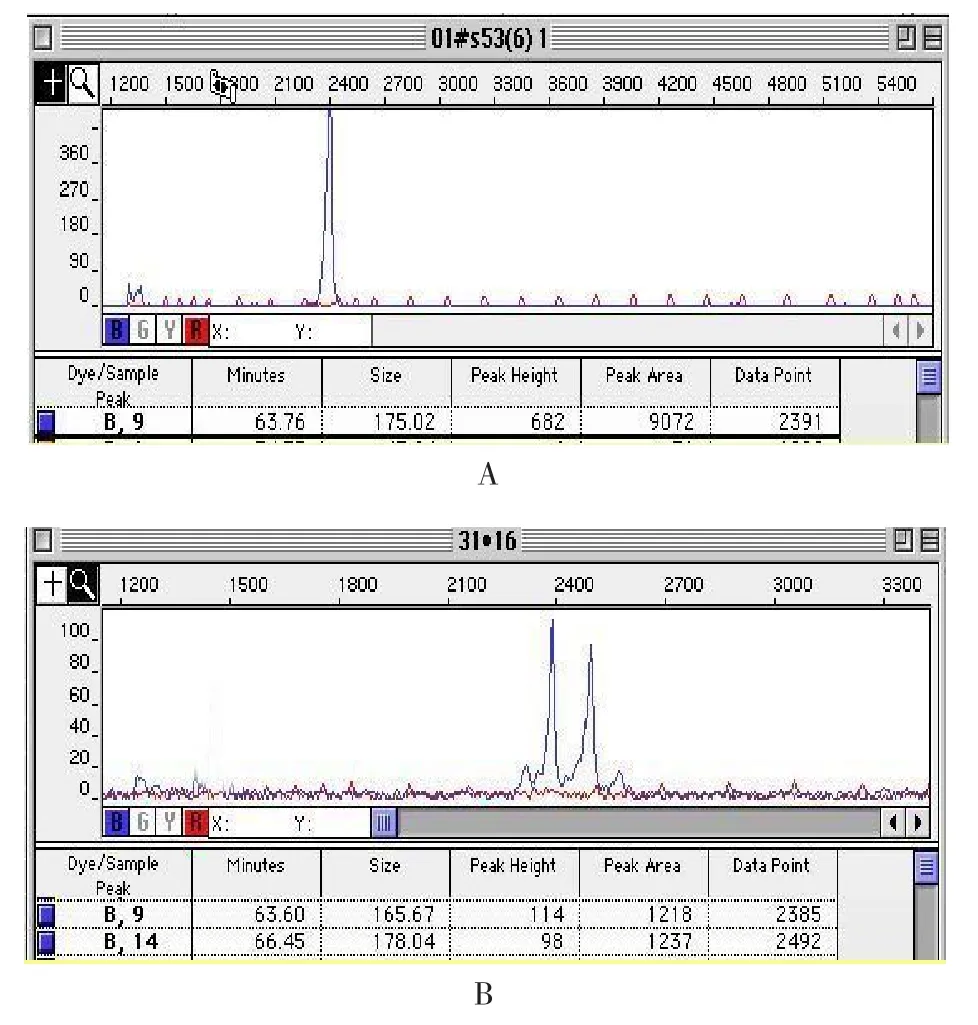
Figure 2 Results of GeneScan analysis of D18S53 STR locus图2 D18S53 STR基因座GeneScan分析结果图

Figure 3 Results of GeneScan analysis of D18S59 STR locus图3 D18S59 STR基因座GeneScan分析结果图

Figure 4 Results of GeneScan analysis of D18S488 STR locus图4 D18S488 STR基因座GeneScan分析结果图
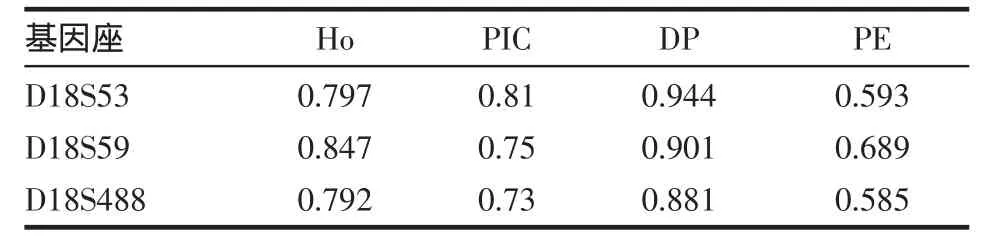
Table 3 The genetic polymorphism data of three STR loci表3 3个STR基因座遗传多态性数据
QF-PCR在英国乃至欧美国家已经广泛应用于常见染色体非整倍体的快速诊断[4],Hills等[5]回顾分析伦敦地区9 737例产前诊断样本,发现73例母血污染严重的样本单独应用QF-PCR可明确诊断。由于国内缺少相关的科研数据,因此还无法将QFPCR应用于常见染色体非整倍体的快速诊断中。本研究分别选取18号染色体着丝粒附近、短臂和长臂各1个STR基因座,通过研究其群体遗传学数据,为天津汉族群体ES基因诊断及产前基因诊断的研究提供实验依据;并且通过对QF-PCR结果峰面积定量的统计分析,为建立应用该方法进行基因诊断及产前基因诊断的标准提供实验依据。
目前国内外有关D18S53、D18S59和D18S488 3个STR基因座的群体遗传学数据鲜有报道,本研究结果显示,天津汉族胎儿这3个STR基因座Ho、PIC、DP及PE值与本课题组前期有关天津汉族群体遗传学数据一致[6]。一般认为所选取的STR基因座若Ho>0.7、PIC>0.5、DP>0.8且PE>0.5,则可作为良好的遗传标记,故本研究选取的D18S53、D18S59和D18S488 3个STR基因座可作为18号染色体良好的遗传标记,进一步用于ES的产前基因诊断。
QF-PCR以其经济、高效的特点一直受国内外学者关注。Gekas等[8]通过对110 948例孕妇产前诊断方案的研究发现,QF-PCR方法每诊断1例DS比核型分析可节约3 494美元。因此有必要建立符合天津地区人群特点的QF-PCR诊断方案。由于相同STR基因座在不同个体可能出现不同长度的等位基因,则QF-PCR扩增STR后可能出现2种情况:纯合子表现为1条带/峰;杂合子表现为2条带/峰,定量之比约为1∶1。本研究3个STR基因座共1 067个样本表现为杂合子,2个峰的峰面积比值为0.50~1.76,x=1.06,s=0.21,95%CI:0.65~1.47,与Faas等[9]的研究结果一致。
[1]Scott F,Murphy K,Carey L,et al.Prenatal diagnosis using com⁃bined quantitative fluorescent polymerase chain reaction and array comparative genomic hybridization analysis as a first-line test:re⁃sults from over 1000 consecutive cases[J].Ultrasound Obstet Gyne⁃col,2013,41(5):500-507.
[2]Edwards A,Civitello A,Hammond HA,et al.DNA typing and ge⁃netic mapping with trimetric and tetrameric tandem repeats[J].Am J Hum Genet,1991,49(4):746-756.
[3]Mansfield ES.Diagnosis of Down syndrome and other aneuploidies using quantitative polymerase chain reaction and small tandem re⁃peat polymorphisms[J].Hum Mol Genet,1993,2(1):43-50.
[4]Mann K,Ogilvie CM.QF-PCR:application,overview and review of the literature[J].Prenat Diagn,2012,32(4):309-314.
[5]Hills A,Donaghue C,Waters J,et al.QF-PCR as a stand-alone test for prenatal samples:the first 2 years’experience in the Lon⁃don region[J].Prenat Diagn,2010,30(6):509-517.
[6]刘静,张颖,岳天孚.天津汉族人群18号染色体3个短串联重复序列多态性[J].中国现代医学杂志,2010,20(8):1164-1167.
[7]Hui L,Bianchi DW.Recent advances in the prenatal interrogation of the human fetal genome[J].Trends Genet,2013,29(2):84-91.
[8]Gekas J,van den Berg DG,Durand A,et al.Rapid testing versus karyotyping in Down’s syndrome screening:cost-effectiveness and detection of clinically significant chromosome abnormalities[J].Eur J Hum Genet,2011,19(1):3-9.
[9]Faas BH,Cirigliano V,Bui TH.Rapid methods for targeted prenatal diagnosis of common chromosome aneuploidies[J].Semin Fetal Neo⁃natal Med,2011,16(2):81-87.
