化瘀通络方对局灶性脑缺血模型大鼠的保护作用
2014-12-03邱召娟谭喜莹朱萱萱朱吾元南京中医药大学附属医院南京009南京中医药大学药学院南京009
邱召娟,谭喜莹,朱萱萱,朱吾元(.南京中医药大学附属医院,南京009;.南京中医药大学药学院,南京 009)
化瘀通络方主要由葛根、当归、补骨脂、制大黄、水蛭等组成,具有活血化瘀、通络调和的作用。临床实践表明,化瘀通络方用于缺血性脑中风患者的治疗疗效确切[1]。药理实验证明,化瘀通络方能抑制脂质过氧化反应,促进自由基清除,提高脑组织自身抗氧化能力[2-3]。笔者通过观察化瘀通络方在局灶性脑缺血模型大鼠中对一氧化氮合酶(NOS)mRNA和血管内皮生长因子(VEGF)mRNA表达的影响,从分子生物学角度研究化瘀通络方对局灶性脑缺血模型大鼠内源性保护因子的作用,以探求该复方制剂防治急性缺血性卒中可能的作用靶点。
1 材料
1.1 仪器
Biophotometer蛋白核酸测定仪(美国Eppendorf公司);Z366型台式高速冷冻离心机(德国Hermle公司);iCycler iQ system型实时荧光定量聚合酶链反应(RT-PCR)仪(美国Bio-Rad公司);SDS-PAGE电泳及电转印装置(上海天能科技有限公司);凝胶图像分析系统(德国Pharmacia公司)。
1.2 药品与试剂
化瘀通络方(江阴天江药业有限公司,批号:0910119,规格:10 g/袋);脑血康胶囊(山东昊福制药有限公司,批号:20100202,规格:0.15 g/粒);青霉素(山东鲁抗医药股份有限公司,批号:B091107,规格:80万u);戊巴比妥钠(中国医药上海化学试剂公司,批号:F20091216);超氧化物歧化酶(SOD)、丙二醛(MDA)、NOS测试盒(南京建成生物工程研究所);Trizol、SYBR Green I Nucleic Acid Gel Stain(美国 Invitrogen公司);AMV反转录试剂盒(美国Promega公司);引物(南京金斯瑞生物公司合成);Taq PCR Master Mix Kit(德国Qiagen公司)。
1.3 动物
清洁级SD大鼠,♂,体质量280~320 g,由浙江大学实验动物中心提供[实验动物使用合格证号:SCXK(浙)2008-0033]。实验大鼠均分笼饲养,饲喂全价颗粒饲料,自由饮水,室温(22±2)℃,湿度55%~65%,光照适度,通风洁净。
2 方法
2.1 复制模型与分组、给药
采用Longa法制备大鼠局灶性脑缺血模型。线栓保留2 h后,小心拔除到颈总动脉分叉处恢复血流。手术后给予青霉素抗炎。观察模型大鼠清醒后的行为学改变,按Longa五级四分法评定动物神经功能,将第1、2、3级大鼠确定为成功模型。60只SD大鼠随机均分为6组,即假手术(等容生理盐水)组、模型(等容生理盐水)组、脑血康(0.9 g/kg)组与化瘀通络方高、中、低剂量(16.0、8.0、4.0 g/kg)组。术前4 d开始ig给药,每天1次,连续7 d。
2.2 大鼠脑组织总RNA的提取
取大鼠皮层组织约100 mg,称质量,组织块直接放入研钵中,加入少量液氮,迅速研磨,待组织变软,再加少量液氮,再研磨,加入Trizol。将悬液移入1.5 ml离心管中,按200 μl氯仿/ml Trizol加入氯仿,振荡混匀后室温放置15 min。然后于4℃下,以离心半径为13.5 cm、12 000 r/min离心15 min,取水相,加入0.5 ml异丙醇,混匀,室温放置10 min。4℃下,以离心半径为13.5 cm、12 000 r/min离心10 min,弃上清液,加75%乙醇(用DEPC水制备)1 ml洗涤沉淀;4℃下,以离心半径为13.5 cm、12 000 r/min离心5 min,尽可能将乙醇吸净,室温下干燥5~10 min,用20 μl DEPC水溶解,-20 ℃贮藏,备用。
2.3 反转录
取1 μg总RNA按照Promega A3500反转录试剂盒操作说明进行反转录反应。反应体系为:5×AMV Buffer 4 μl、10 mmol/L dNTP 2 μ l、25 mmol/L MgCl24 μ l、RNAsin 1 μ l(10 u/μ l)、Random primer 1 μl(0.5 μg)、AMV反转录酶1 μl(10 u/μl),加无核酶水至20 μl。37 ℃反应60 min,94 ℃5 min 灭活,-20 ℃贮藏,备用。
2.4 RT-PCR检测神经元型NOS(nNOS)、内皮型NOS(eNOS)、诱导型NOS(iNOS)与VEGF基因mRNA表达
引物用在线引物设计平台Primer-Blast设计(http://www.ncbi.nlm.nih.gov/tools/primer-blast/)。进行Realtime-PCR,琼脂糖凝胶电泳检测,凝胶成像系统扫描分析。引物序列见表1。

表1 引物序列Tab 1 Primer sequences
2.5 统计学方法
数据以±s表示,采用SPSS17.0软件处理分析实验数据。多组间单因素比较先用单因素分析其正态分布,后以LSD法进行统计。P<0.05为差异有统计学意义。
3 结果
3.1 化瘀通络方对模型大鼠脑组织nNOS mRNA表达的影响
与假手术组比较,模型组大鼠脑组织nNOS mRNA表达减弱,差异有统计学意义(P<0.01);与模型组比较,化瘀通络方高、中、低剂量组大鼠脑组织nNOS mRNA表达无明显改变(P>0.05)。化瘀通络方对模型大鼠脑组织nNOS mRNA表达的影响见表2。
表2 化瘀通络方对模型大鼠脑组织nNOS mRNA表达的影响(±s)Tab 2 Effects of Huayu tongluo fang on the expression of nNOS mRNA in cerebral tissue of rat(s±s)
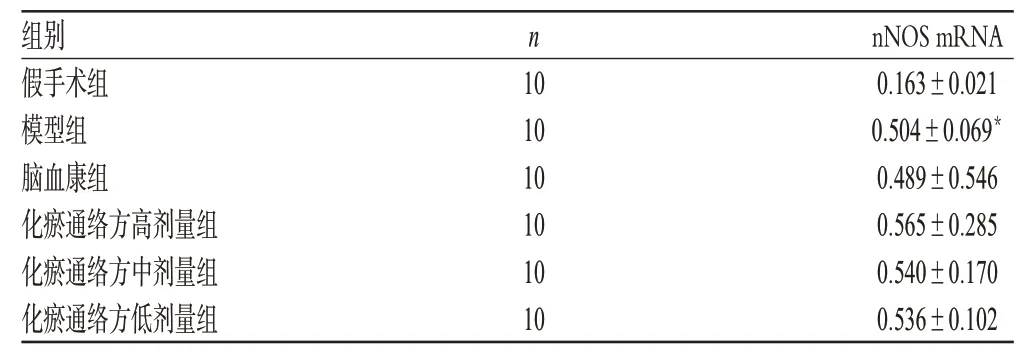
表2 化瘀通络方对模型大鼠脑组织nNOS mRNA表达的影响(±s)Tab 2 Effects of Huayu tongluo fang on the expression of nNOS mRNA in cerebral tissue of rat(s±s)
与假手术组比较:*P<0.01vs.sham operation group:*P<0.01
组别假手术组模型组脑血康组化瘀通络方高剂量组化瘀通络方中剂量组化瘀通络方低剂量组nNOS mRNA 0.163±0.0210.504±0.069*0.489±0.546 0.565±0.285 0.540±0.170 0.536±0.102 n 10 10 10 10 10 10
3.2 化瘀通络方对模型大鼠脑组织iNOS mRNA表达的影响
与假手术组比较,模型组大鼠脑组织iNOS mRNA表达增强,差异有统计学意义(P<0.01);与模型组比较,化瘀通络方高、中、低剂量组大鼠脑组织iNOS mRNA表达减弱,差异有统计学意义(P<0.01)。化瘀通络方对模型大鼠脑组织iNOS mRNA表达的影响见表3。
表3 化瘀通络方对模型大鼠脑组织iNOS mRNA表达的影响(±s)Tab 3 Effects of Huayu tongluo fang on the expression of iNOS mRNA in cerebral tissue of model rats (±s)

表3 化瘀通络方对模型大鼠脑组织iNOS mRNA表达的影响(±s)Tab 3 Effects of Huayu tongluo fang on the expression of iNOS mRNA in cerebral tissue of model rats (±s)
与假手术组比较:*P<0.01;与模型组比较:#P<0.01vs.sham operation group:*P<0.01;vs.model group:#P<0.01
?
3.3 化瘀通络方对模型大鼠脑组织eNOS mRNA表达的影响
与假手术组比较,模型组大鼠脑组织eNOS mRNA表达无明显差异(P>0.05);与模型组比较,化瘀通络方高、中、低剂量组大鼠脑组织eNOS mRNA表达增强,差异有统计学意义(P<0.01)。化瘀通络方对模型大鼠脑组织eNOS mRNA表达的影响见表4。
3.4 化瘀通络方对模型大鼠脑组织VEGFmRNA表达的影响
与假手术组比较,模型组大鼠脑组织VEGF mRNA表达增强,差异有统计学意义(P<0.01);与模型组比较,化瘀通络方高、中、低剂量组大鼠脑组织VEGF mRNA表达增强,差异有统计学意义(P<0.01)。化瘀通络方对模型大鼠脑组织VEGF mRNA表达的影响见表5。
表4 化瘀通络方对模型大鼠脑组织eNOS mRNA表达的影响(±s)Tab 4 Effects of Huayu tongluo fang on the expression of eNOS mRNA in cerebral tissue of model of model rats(±s)
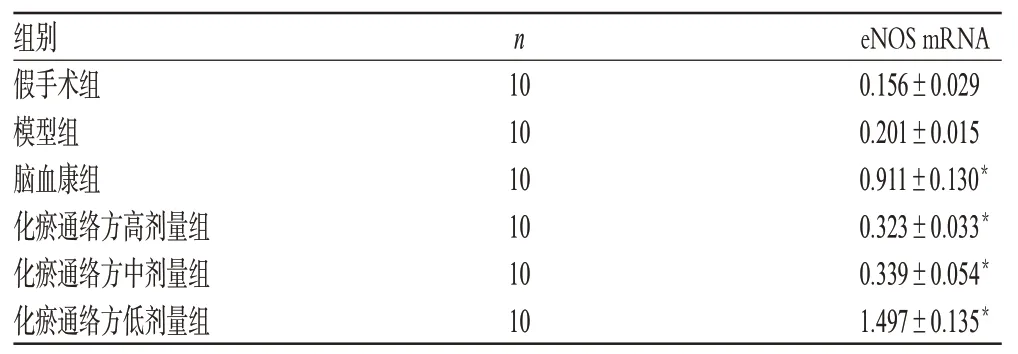
表4 化瘀通络方对模型大鼠脑组织eNOS mRNA表达的影响(±s)Tab 4 Effects of Huayu tongluo fang on the expression of eNOS mRNA in cerebral tissue of model of model rats(±s)
与模型组比较:#P<0.01 vs.model group:#P<0.01
组别假手术组模型组脑血康组化瘀通络方高剂量组化瘀通络方中剂量组化瘀通络方低剂量组eNOS mRNA 0.156±0.029 0.201±0.015 0.911±0.130*0.323±0.033*0.339±0.054*1.497±0.135*n 10 10 10 10 10 10
表5 化瘀通络方对模型大鼠脑组织VEGF mRNA表达的影响(±s)Tab 5 Effects of Huayu tongluo fang on the expression of VEGFmRNA in cerebral tissue of model of model rats(±s)
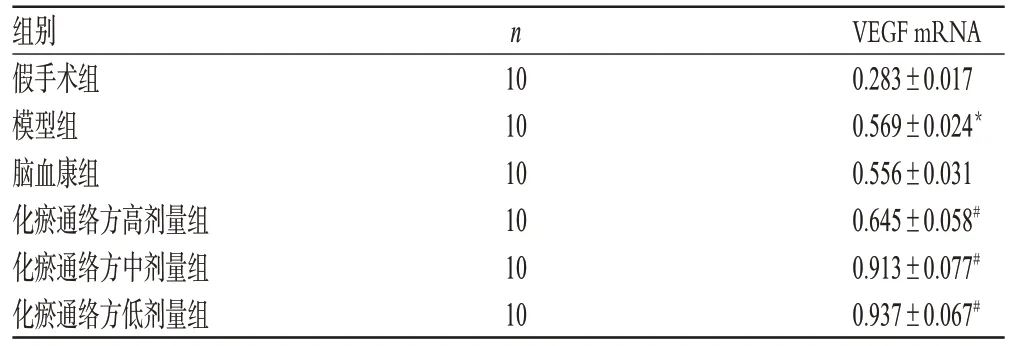
表5 化瘀通络方对模型大鼠脑组织VEGF mRNA表达的影响(±s)Tab 5 Effects of Huayu tongluo fang on the expression of VEGFmRNA in cerebral tissue of model of model rats(±s)
与假手术组比较:*P<0.01;与模型组比较:#P<0.01vs.sham operation group:*P<0.01;vs.model group:#P<0.01
假手术组模型组脑血康组化瘀通络方高剂量组化瘀通络方中剂量组化瘀通络方低剂量组0.283±0.017 0.569±0.024*0.556±0.0310.645±0.058#0.913±0.077#0.937±0.067#10 10 10 10 10 10
4 讨论
研究表明,局灶性脑缺血早期NO增多,而早期NO的增加在病程中起到双重作用,而这一作用与NOS的亚型相关[4]。NOS分为3种亚型:(1)nNOS,因其最早在神经元中发现而得名。它在生理状态下有表达,病理状态下可被诱导表达增高,是脑缺血早期神经元损伤的重要因素之一[5]。(2)eNOS,因其最早在内皮细胞中发现而得名。它的活性依赖于Ca2+浓度升高,eNOS活性对于维持脑血流有重要意义,是脑缺血后神经元的一个重要保护因子。一般在脑缺血后1 h活性增强,24 h达高峰[6]。(3)iNOS,其最早在巨噬细胞中被发现,活性不依赖于Ca2+浓度。它介导迟发性神经元损伤,是脑缺血晚期神经元损伤的重要因素之一。一般在脑缺血后12 h活性增强,48 h达高峰[7]。因此,选择性地调控不同类型的NOS表达具有重要的临床意义。本研究表明,化瘀通络方虽然对局灶性脑缺血模型大鼠nNOS mRNA的表达没有明显影响,但是却能通过抑制iNOS mRNA的表达在一定程度上降低NO相关的神经毒性;另一方面,化瘀通络方能诱导eNOS mRNA表达增强,这对于舒张血管增加损伤区域的血流,发挥NO(eNOS源性)早期脑保护作用,有着重要的意义。
VEGF能特异性地直接作用于血管内皮细胞,是促进新生血管形成的重要细胞因子。Jin KL[8]等研究发现,VEGF mRNA表达提高可有效地促进新生血管形成、保护神经及促进缺血后神经元再生,这对减少脑损伤及恢复神经功能起到不容忽视的作用。本研究证明,化瘀通络方对局灶性脑缺血模型大鼠脑组织的保护作用与其促进VEGF表达上调相关。
本研究证明,化瘀通络方对局灶性脑缺血模型大鼠具有保护作用。一方面它能通过促进eNOS和VEGF的表达从而增加内源保护因子达到保护作用;另一方面通过减少iNOS的表达,减轻iNOS介导的迟发性神经元损伤而起到保护作用。通过研究还发现,低剂量化瘀通络方对eNOS的影响明显高于高、中剂量组,而对iNOS和VEGF的影响,低剂量组和中剂量组差异无统计学意义(P>0.05),但是均高于高剂量组。提示化瘀通络方在后续研究和临床使用中需要控制剂量,以达到更佳的疗效。
[1]陈德芝,顾锡镇,余江毅,等.脑血通颗粒联合光氧合血液治疗脑出血急性期60例:临床与实验研究[J].中国微循环,2004,8(5):355.
[2]张忠华,朱萱萱,陈德芝,等.脑血通颗粒对脑缺血缺氧的实验研究[J].时珍国医国药,2003,14(12):736.
[3]邱召娟,朱萱萱,达庆国,等.化瘀通络方对局灶性脑缺血大鼠再灌注(MCAO)后脑组织氧自由基和NOS表达的影响[J].中华中医药学刊,2011,29(3):509.
[4]Moro MA,Cárdenas A,Hurtado O,et al.Role of nitric oxide after brain ischaemia[J].Cell Calcium,2004,36(3/4):265.
[5]Zhou L,Zhu DY.Neuronal nitric oxide synthase:structure,subcellular localization,regulation,and clinical implications[J].Nitric Oxide,2009 ,20(4):223.
[6]Toda N,Ayajiki K,Okamura T.Cerebral blood flow regulation by nitric xxide:recent advances[J].Pharmacol Rev,2009,61(1):62.
[7]del Zoppo G,Ginis I,Hallenbeck JM,et al.Inflammation and stroke:putative role for cytokines,adhesion molecules and iNOS in brain response to ischemia[J].Brain Pathol,2000,10(1):95.
[8]Jin KL,Mao XO,Greenberg DA.Vascular endothelial growth factor:direct neuroprotective effect in vitro ischemia[J].Proc Natl Acad Sci USA,2000,97(18):10 242.
