脂氧素受体激动剂BML-111对左向右分流型肺动脉高压大鼠肺动脉压力的影响
2014-12-03龚兴瑞陈永梅秦成名许先成王贤裕
龚兴瑞 陈永梅 秦成名 许先成 王贤裕 向 勇
(湖北医药学院附属太和医院麻醉科,湖北 十堰 442000)
肺动脉高压的发生与平滑肌细胞、成纤维细胞、内皮细胞的炎症浸润和异常增殖,肺动脉血栓形成密切相关〔1〕。临床治疗是针对基础疾病和诱发因素进行对症治疗,但疗效并不满意。脂氧素受体激动剂(BML-111)可通过激动脂氧素受体从而发挥一种促炎症介质消退作用,其机制包括抑制多条细胞内信号转导途径的激活,抑制炎症介质浸润等,因此有用来治疗肺动脉高压的可能〔2〕。本试验观察BML-111对左向右分流型肺动脉高压大鼠肺动脉压力及肺血管病理改变的影响。
1 材料与方法
1.1 实验动物 健康成年SD大鼠30只,体重400~450 g,由湖北医药学院动物实验中心提供,随机将大鼠平均分为三组:C组、B1组、B2组。实验器材包括:压力换能器、手术显微镜、手术器械、肝素、水合氯醛、青霉素等。
1.2 模型制备 将盐酸戊乙奎醚注射液1 mg和氟哌利多5 mg加入100 ml水合氯醛,采用腹腔注射3 ml/100 g进行麻醉,麻醉后将大鼠固定于手术台上,腹腔注射肝素2 mg/kg,术中持续使用面罩给氧,流量为1 L/min。动物模型的构建:将大鼠左侧颈斜形切开,游离左侧颈总动脉和颈外静脉,对颈外静脉远心端结扎,颈总动脉下段用血管夹夹住,于发出颈外分支前结扎剪断,剪取1 cm的BD20G动脉穿刺针作为导管连接颈总动脉近心端和颈外静脉近心端,结扎固定好导管,剪断颈外静脉远端,松开血管夹,颈外静脉变红且有搏动则说明分流成功洒青霉素5万单位后缝合伤口,将大鼠放回笼中饲养。6 w后开始,C组每天腹腔注射生理盐水,B1组每天腹腔注射1 mg·kg-1·d-1BML-111,B2 组每天腹腔注射 3 mg·kg-1·d-1BML-111连续4 w后将大鼠取出进行实验。大鼠一般情况所有大鼠分流术后与术前相比,进食、活动减少,毛发粗糙,精神较差。C组有一只大鼠在第9周死亡,进入最后实验的C组、B1、B2组分别有大鼠9只、10只、10只。
1.3 肺动脉压力检测 将大鼠按照如前的方式行腹腔注射麻醉,固定于手术台上,分离右侧颈外静脉,将右心导管充满肝素盐水后插入,连接换能器并与监护仪相连,当置入导管进入右心室时记录其右室收缩压(RDP),监护仪出现肺动脉波形时记录其平均肺动脉压力(PAMP)。压力测量完毕后处死大鼠,游离右室(RV)和左室(LV)+室间隔(S)并称重,计算 RV/(LV+S)。
1.4 组织病理学测定 用生理盐水冲洗肺动脉剩余的血液,同时用10%的中性甲醛在20 cm H2O压力下经气管注入肺内,约5 min后切取左肺于10%甲醛中固定48 h,常规石蜡包埋、切片,进行染色。
1.5 肺小动脉中膜厚度比 将处理好的切片经Elastin-Van Gieson染色,然后在光镜下观察,用Simple PCI图像采集系统处理,分别测量计算内、外弹力板之间的距离(R)和血管外径(D),每只大鼠测量30根肺部小动脉,直径位于30~100 μm,由公式计算中膜厚度百分比:2R/D100%。
1.6 肺小动脉纤维化百分比 将处理好的标本经Masson染色,在400倍显微镜下进行观察,用图像处理软件将蓝染的纤维组织和红色的其他组织以及白色的背景分割开,计算蓝染组织占总视野百分比。
1.7 细胞间黏附分子(ICAM-1)和白介素(IL)-8测定 将肺组织剪下后用缓冲液冲洗干净,加入裂解缓冲液于液氮下磨碎,离心后取上清液于-80℃深低温冰箱保存。采集大鼠静脉血2 ml,5 000 r/min离心5 min后取上清液于-80℃深低温冰箱保存。用ELISA测量肺组织匀浆和血浆ICAM-1和IL-8的含量,试剂购自R&D公司,操作步骤按照说明书进行。
1.8 统计学方法 采用SPSS13.0统计软件,选用完全随机设计的方差分析,采用LSD法分析各组与间差异。
2 结果
2.1 血流动力学改变 经术后10 w的饲养,B1、B2组大鼠相比 C 组,PAMP、RV/(LV+S)、RVSP 明显降低(P<0.05);且 B2组相比B1组 PAMP、RVSP降低更明显(P<0.05),见表1。
表1 各组大鼠血流动力学指标比较(s)
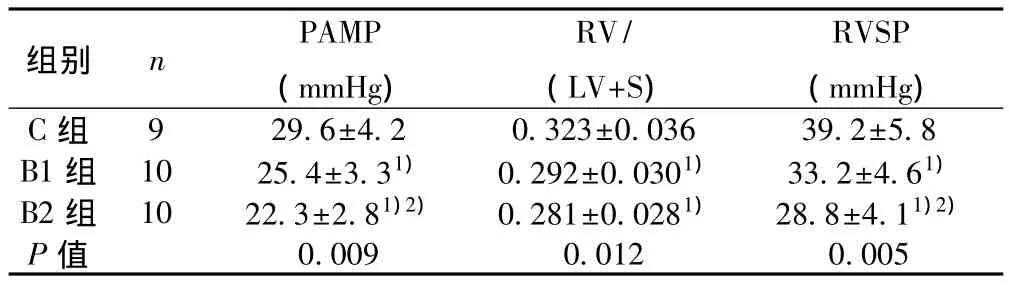
表1 各组大鼠血流动力学指标比较(s)
与 C 组比较:1)P<0.05;与 B1 组比较:2)P<0.05,下表同
组别 n PAMP(mmHg)RV/(LV+S)RVSP(mmHg)9 29.6±4.2 0.323±0.036 39.2±5.8 B1 组 10 25.4±3.31) 0.292±0.0301) 33.2±4.61)B2 组 10 22.3±2.81)2) 0.281±0.0281) 28.8±4.11)2)P值C组0.009 0.012 0.005
2.2 肺血管病理改变 B1、B2组大鼠相比C组,肺小动脉病理下观察发现其中膜厚度比和纤维化比均明显减轻,且B2组肺小动脉中膜厚度比略小于B1组(P<0.05)。见表2。
表2 各组大鼠肺血管中膜厚度比和纤维化比(s,%)

表2 各组大鼠肺血管中膜厚度比和纤维化比(s,%)
组别 n 25.1±4.9 32.6±7.8 B1 组 10 20.6±3.41) 24.3±4.91)B2 组 10 17.1±3.01)2) 21.2±4.61)P值中膜厚度百分比 纤维化百分比C组9 0.008 0.004
2.3 ICAM-1和IL-8测定 B1、B2组大鼠相比C组,肺组织和血浆中ICAM-1和IL-8浓度均明显降低(P<0.05),且血浆中ICAM-1和IL-8含量B2组比B1组降低更明显(P<0.05)。见表3。
表3 各组大鼠肺组织、血浆ICAM-1和IL-8含量(s)
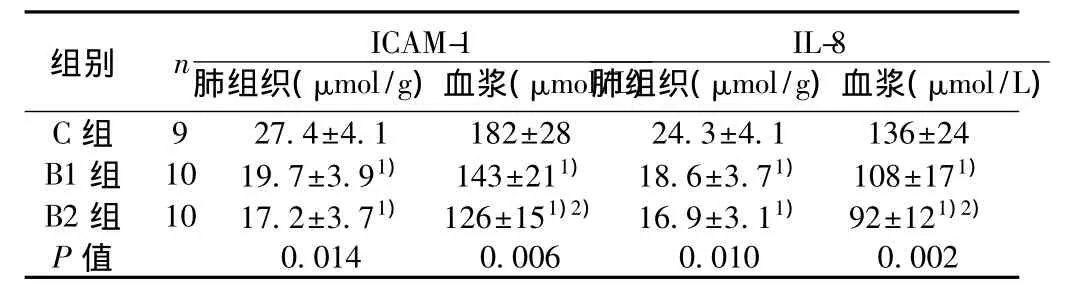
表3 各组大鼠肺组织、血浆ICAM-1和IL-8含量(s)
L)9 27.4±4.1 182±28 24.3±4.1 136±24 B1 组 10 19.7±3.91) 143±211) 18.6±3.71) 108±171)B2 组 10 17.2±3.71) 126±151)2) 16.9±3.11) 92±121)2)P值C组0.014 0.006 0.010 0.002
3 讨论
肺动脉高压是小儿先天性心脏病常见并发症,早期采用手术治疗纠正畸形,可有效预防肺动脉高压形成,但是有部分小儿在畸形矫正后肺动脉高压仍然向前发展。大量高速血流的冲击,血液的剪切力是肺动脉高压发生的起始因素,它可造成肺部小动脉内皮细胞损伤,长时间可造成肺小动脉中层增厚,新生内膜形成,肺血管纤维化,并最终导致管腔狭窄,小动脉闭锁,任由其发展最后导致右心衰竭,病人死亡〔3〕。血液流变学的改变是肺动脉高压的始动因素,炎症反应则是肺动脉高压发展过程的一个重要促进因素,通常包括一些IL释放、巨噬细胞、肥大细胞、树突细胞和淋巴细胞的激活,这些炎症因子和介质和肺动脉高压发展过程相伴,甚至与疾病预后有关系〔4〕,因此通过抑制机体炎症反应是治疗肺动脉高压的重要途径。
脂氧素是人体内重要的促进炎症消退的物质,在机体受到外来打击时,它可以抑制炎症反应的程度,从而避免炎症反应失控,减轻炎症反应所致的机体损伤,这些作用在肺、肝、心等多种器官损伤模型中已经得到证实〔5~7〕,其抗炎机制主要包括脂氧素受体激活后可有效抑制内皮细胞的增殖趋化,抑制白细胞介素、肿瘤坏死因子分泌的分泌和ICAM-1的表达等。由于脂氧素在人体内半衰期极短,因此试验中采用脂氧素受体激动剂BML-111腹腔注射,其与脂氧素作用机制相同,都是通过作用脂氧素受体而发挥作用,产生效果类似〔8〕。
大鼠分流型肺动脉高压模型主要有腹主动脉-下腔静脉分流型、左颈总动脉-颈外静脉分流型,本实验中采用吻合左颈总动脉-颈外静脉建立肺动脉高压动脉模型,主要是考虑到腹主动脉和下腔静脉位置较深,操作难度较颈部大,采用血管吻合,流量不够稳定;而颈部操作位置表浅,采用套管吻合,流量固定,由于颅内大脑动脉环的血流再分布,大鼠没有脑缺血性损伤的表现。C组肺动脉压力、右心压力更高,肺血管病变程度更重,右室肥厚更加明显。这种肺动脉压力与肺血管病理改变的差异可能与BML-111作用于受体后减轻机体炎症反应有关,而且实验中发现B2组3 mg·kg-1·d-1的剂量效果好于B1组1 mg·kg-1·d-1。
综上,BML-111作用于脂氧素受体后,可减轻大鼠肺动脉高压的发展,减慢肺血管病变形成,其作用机制可能与减轻机体炎症反应有关。通过激动脂氧素受体抑制炎症反应治疗肺动脉高压可能有一定的作用。
1 Humbert M,Montani D,Perros F,et al.Endothelial cell dysfunction and cross talk between endothelium and smooth muscle cells in pulmonary arterial hypertension〔J〕.Vasc Pharmacol,2008;49(4-6):113-8.
2 Wu SH,Liao PY,Dong L,et al.Signal pathway involved in inhibition by lipoxin A(4)of production of interleukins induced in endothelial cells by lipopolysaccharide〔J〕.Inflamm Res,2008;57(9):430-7.
3 Sakao S,Tatsumi K,Voelkel NF.Endothelial cells and pulmonary arterial hypertension:apoptosis,proliferation,interaction and transdifferentiation〔J〕.Respir Res,2009;10(1):95.
4 Price LC,Wort SJ,Perros F,et al.Inflammation in pulmonary arterial hypertension〔J〕.Chest,2012;141(1):210-21.
5 Birnbaum Y,Ye Y,Lin Y,et al.Augmentation of myocardial production of 15-epi-lipoxin-a4 by pioglitazone and atorvastatin in the rat〔J〕.Circulation,2006;114(9):929-35.
6 Jin SW,Zhang L,Lian QQ,et al.Posttreatment with aspirin-triggered lipoxin A4 analog attenuates lipopolysaccharide-induced acute lung injury in mice:the role of heme oxygenase-1〔J〕.Anesth Analg,2007;104(2):369-77.
7 Zhang L,Wan J,Li H,et al.Protective effects of BML-111,a lipoxin A(4)receptor agonist,on carbon tetrachloride-induced liver injury in mice〔J〕.Hepatol Res,2007;37(11):948-56.
8 Chen Y,Hao H,He S,et al.Lipoxin A4 and its analogue suppress the tumor growth of transplanted H22 in mice:the role of antiangiogenesis〔J〕.Mol Cancer Ther,2010;9(8):2164-74.
