癫痫大鼠海马和颞叶皮质中pleiotrophin的表达及意义
2014-12-03张淑芹王华梁峰
张淑芹 ,王华,梁峰
(1.中国医科大学附属盛京医院小儿神经内科,沈阳 110004,2.辽宁医学院附属第一医院儿科 辽宁 锦州 121000;3.辽宁医学院附属第一医院神经外科,辽宁 锦州 121000)
癫痫是一种严重威胁人类健康的可致残性疾病,约60%于儿童期发病[1]。在儿童癫痫中,经过抗癫痫药系统治疗仍有约30%的患儿不能得到有效控制而发展成难治性癫痫[2];颞叶癫痫(temporal lobe epilepsy,TLE)是难治性癫痫的主要类型,其发病机制至今尚未完全阐明[3]。有研究表明可能与脑组织调节分子异常、脑组织蛋白质异常聚集等有关[4]。多效生长因子或多效营养因子(pleiotrophin,PTN)是从围产期鼠脑组织中纯化得到的一种肝素结合蛋白[5]。其主要生理功能是刺激细胞增殖与迁移,促进血管生成,促进神经系统及骨发育等[6]。本实验应用氯化锂&x100ccf;匹鲁卡品诱发大鼠形成颞叶癫痫模型,通过观察颞叶海马和皮质中pleiotrophin表达的动态变化,来探讨此神经营养因子对癫痫的作用机制。
1 材料与方法
1.1 实验动物
取健康雄性SD大鼠幼鼠48只(出生11 d、清洁级、25~30 g,购自中国医科大学实验动物中心,随机数字表法均分为实验组(24只)和对照组(24只)。对照组、实验组分别又均分为2 h模型、3周模型、8周模型3组,每组8只。饲养于正常昼夜环境,室温19~22Ⅴ,给予标准饲料和饮水。
1.2 方法
1.2.1 模型制作:所有模型组幼鼠腹腔注射氯化锂(127 mg/kg,生理盐水配制)用以增强匹鲁卡品的敏感性,24 h后,模型组腹腔注射匹鲁卡品(30 mg/kg,生理盐水配制),对照组幼鼠腹腔注射等剂量生理盐水,模型组在注射匹鲁卡品30 min前腹腔注射苯巴比妥(25 mg/kg,生理盐水配制)用以拮抗匹鲁卡品导致外周胆碱能反应。每30 min给予匹鲁卡品(10 mg/kg)腹腔注射,直到出现癫痫持续状态。每只大鼠匹鲁卡品注射最大剂量限制在60 mg/kg,癫痫发作行为标准按照Racine标准判定。癫痫发作的程度分级0级:无惊厥;Ⅴ级:咀嚼、眨眼、立须等面部肌肉的抽搐;Ⅴ级:以点头运动为主的颈部肌肉的抽搐;Ⅴ级:单侧前肢的阵挛、抽搐;Ⅴ级:双侧前肢阵挛、抽搐伴身体立起;Ⅴ级:双侧后肢强直、身体背曲强直、跌倒;90 min后模型组癫痫动物发作级别均达到Ⅴ~Ⅴ级,给予地西泮(10 mg/kg)腹腔注射以终止癫痫持续状态发作,分别于模型建立2 h、3周、8周时间点时处死各组大鼠。
1.2.2 标本采集与处理:模型组大鼠分别于癫痫模型后2 h、3周、8周处死大鼠,对照组等时间点处死,用10%水合氯醛按350 mg/kg腹腔注射麻醉后,断头取脑。取鼠大脑颞叶皮质和海马组织在4%多聚甲醛中固定24 h、经石蜡包埋后,海马和皮质切片,厚度约5 μm、部分液氮速冻,-80冰箱保存。造模过程中死亡鼠已从总鼠中排除。
1.2.3 免疫组化染色(SABC法):检测大鼠海马和颞叶皮质中PTN的表达。实验步骤按照说明书进行。兔PTN多克隆抗体购自北京博奥森公司(货号bs&x100ccf;2444R),SABC试剂盒购自武汉博士德公司,PBS替代一抗作为阴性对照。
1.2.4 Real&x100ccf;time PCR:实验步骤按照操作流程进行,检测大鼠海马和颞叶皮质中PTN的表达。
1.2.5 图像分析:每只大鼠测3张切片,每张切片海马、颞叶皮质分别随机选取1个视野(×200),测量平均光密度(mean optical density,MOD)值;利用ExicyclerTM96荧光定量仪进行荧光定量分析。
1.3 统计学处理
实验数据应用SPSS 18.0软件进行统计学处理,检测结果用±s表示,样本均数比较采用方差分析及t检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠行为学观察
对照组均未出现癫痫发作,模型组大鼠在给予匹鲁卡品后出现点头、咀嚼、眨眼、立须等面部痉挛动作,随后出现前肢阵挛、前肢阵挛伴站立,再发展为全身强直阵挛发作伴站立、跌倒反复发作,90 min后均达到级发作,达到癫痫持续状态。
2.2 各组大鼠海马和颞叶皮质pleiotrophin免疫组化结果
Pleiotrophin阳性染色于细胞质和细胞核中,为棕黄色颗粒。对照组大鼠海马和颞叶皮质中pleiotrophin阳性细胞散在分布。模型组大鼠癫痫持续后2 h后海马和颞叶皮质pleiotrophin阳性细胞显著表达,而3周,8周阳性细胞表达逐渐升高,8周达高峰,见图1。2 h、3周,8周模型组海马和颞叶皮质中pleiotrophin阳性细胞与其对应的对照组比较差异均有统计学意义(P值分别为0.006、0.007、0.000;0.008、0.003、0.000),见表1。
2.3 癫痫大鼠海马和皮质中PTN mRNA的表达
Real&x100ccf;time PCR结果显示:癫痫大鼠大脑颞叶皮质2 h、3周、8周模型组PTN mRNA表达水平逐渐上升,8周达高峰,与其相应对照组比较差异有统计学意义(P值分别为0.005、0.007、0.000)。癫痫大鼠海马2 h、3周、8周模型组PTN mRNA表达水平逐渐上升,8周达高峰,与其相应对照组比较,差异有统计学意义(P值分别为0.007、0.009、0.000),见图2、3,表2。
3 讨论
癫痫是一种由大脑神经元异常放电所引起的以短暂脑功能异常为特征的慢性脑部疾病[7],发病机制中神经营养因子的作用不容忽视,在癫痫动物模型中,许多神经营养因子表达增加,是癫痫发生的抑制因子。利用氯化锂-匹鲁卡品诱发大鼠癫痫模型,可较好的模拟人类癫痫行为学、电生理学和病理学等特点,是世界上业内人士公认的一种成熟的颞叶癫痫动物模型[8,9]。pleiotrophin 与神经营养因子关系最密切,它的表达产物是一种分泌性生长因子,可分泌到细胞外体液(包括血液)中,同肝素具有高亲和性。具有刺激细胞增殖与迁移、促进血管生成、促进神经系统及骨发育等功能[10]。自发现以来,因其在肿瘤发生中的重要作用而备受关注,在神经系统中的作用也越来越受到重视,特别是与阿尔兹海默病中研究广泛,但在癫痫中的研究较少。
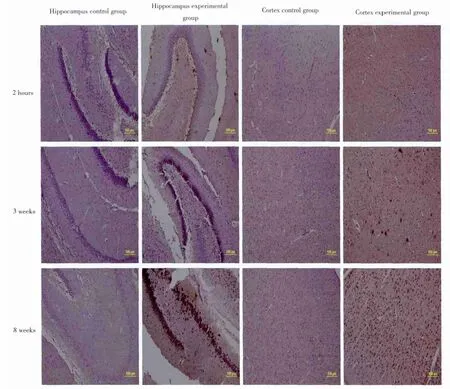
图1 免疫组化显示应用匹鲁卡品后幼鼠海马中PTN阳性细胞和其临近的皮质中PTN阳性细胞,而对照组海马和皮质中呈弱阳性表达,PTN在海马和皮质中从癫痫后2h~8周免疫染色阳性表达逐渐增强比例尺=100μmFig.1 Immunohistochemistry shows PTN positive cells in the hippocampus and adjacent cortex of immature rats following pilocarpineadministration. Faint immunoreactive staining of PTN is seen in the hippocampus and adjacent cortex of a control rat,while gradualincreased immunoreactive staining of PTN was observed in the hippocampus and adjacent cortex of a rat from 2 h to 8 weekspost seizure Scale bar = 100
表1 各组大鼠颞叶皮质和海马中pleiotrophin阳性细胞M O D值比较(±s)Tab.1 Comparison of mean density of positive cells of pleiotrophin in hippocampus of rats among groups(±s)
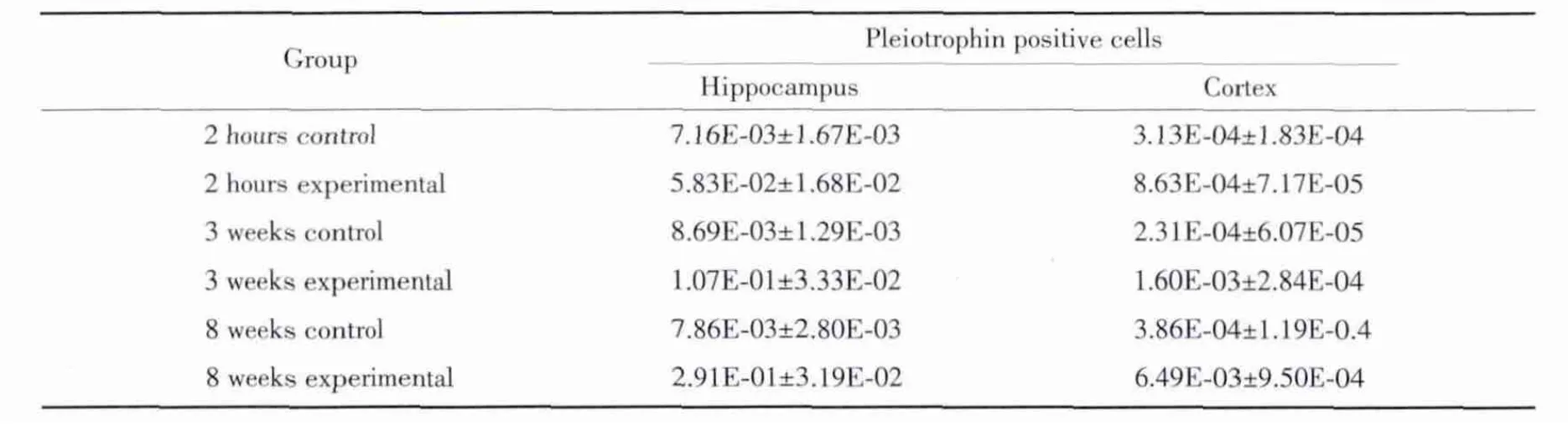
表1 各组大鼠颞叶皮质和海马中pleiotrophin阳性细胞M O D值比较(±s)Tab.1 Comparison of mean density of positive cells of pleiotrophin in hippocampus of rats among groups(±s)
?
表2 Real&x100ccf;timePCR检测各组大鼠脑颞叶皮质和海马中PTN mR NA的表达(±s)Tab.2 Expression of PTN mRNA in the temporal lobe cortex and hippocampus of rats(±s)
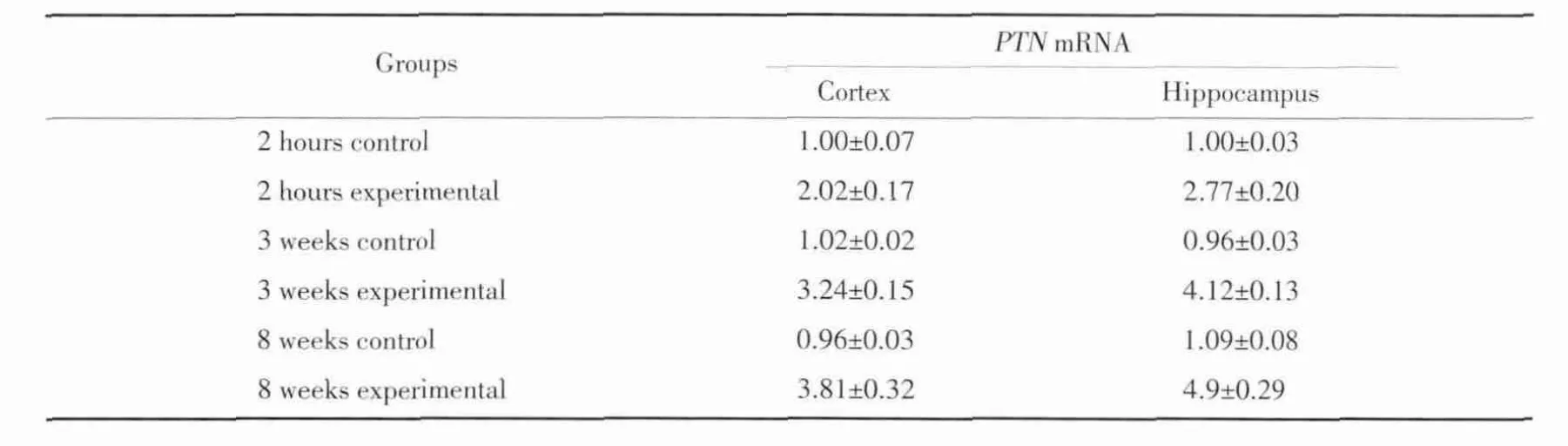
表2 Real&x100ccf;timePCR检测各组大鼠脑颞叶皮质和海马中PTN mR NA的表达(±s)Tab.2 Expression of PTN mRNA in the temporal lobe cortex and hippocampus of rats(±s)
Groups PTN mRNA Cortex Hippocampus 2 hours control 1.00±0.07 1.00±0.03 2 hours experimental 2.02±0.17 2.77±0.20 3 weeks control 1.02±0.02 0.96±0.03 3 weeks experimental 3.24±0.15 4.12±0.13 8 weeks control 0.96±0.03 1.09±0.08
Wanaka等[11]研究显示pleiotrophin在大鼠神经系统中高表达,提示pleiotrophin可能与癫痫的发作有关;Kim等[12]研究表明pleiotrophin在海人酸诱导的大鼠癫痫模型中表达增加,证实pleiotrophin阻滞海人酸诱导的海马癫痫的发生和抑制细胞凋亡,除此之外,在脑损伤、脑退行性变如帕金森、亨廷顿病,多发性硬化和中风中,pleiotrophin表达增高,也起到神经保护作用,这为多种神经功能紊乱方面疾病提供了有效的治疗方法。本研究显示在匹鲁卡品诱导的癫痫模型中pleiotrophin在癫痫大鼠海马和颞叶皮质中表达明显升高,这与以往研究结果相似,为下一步研究pleiotrophin在癫痫发作中的保护作用机制研究奠定基础。
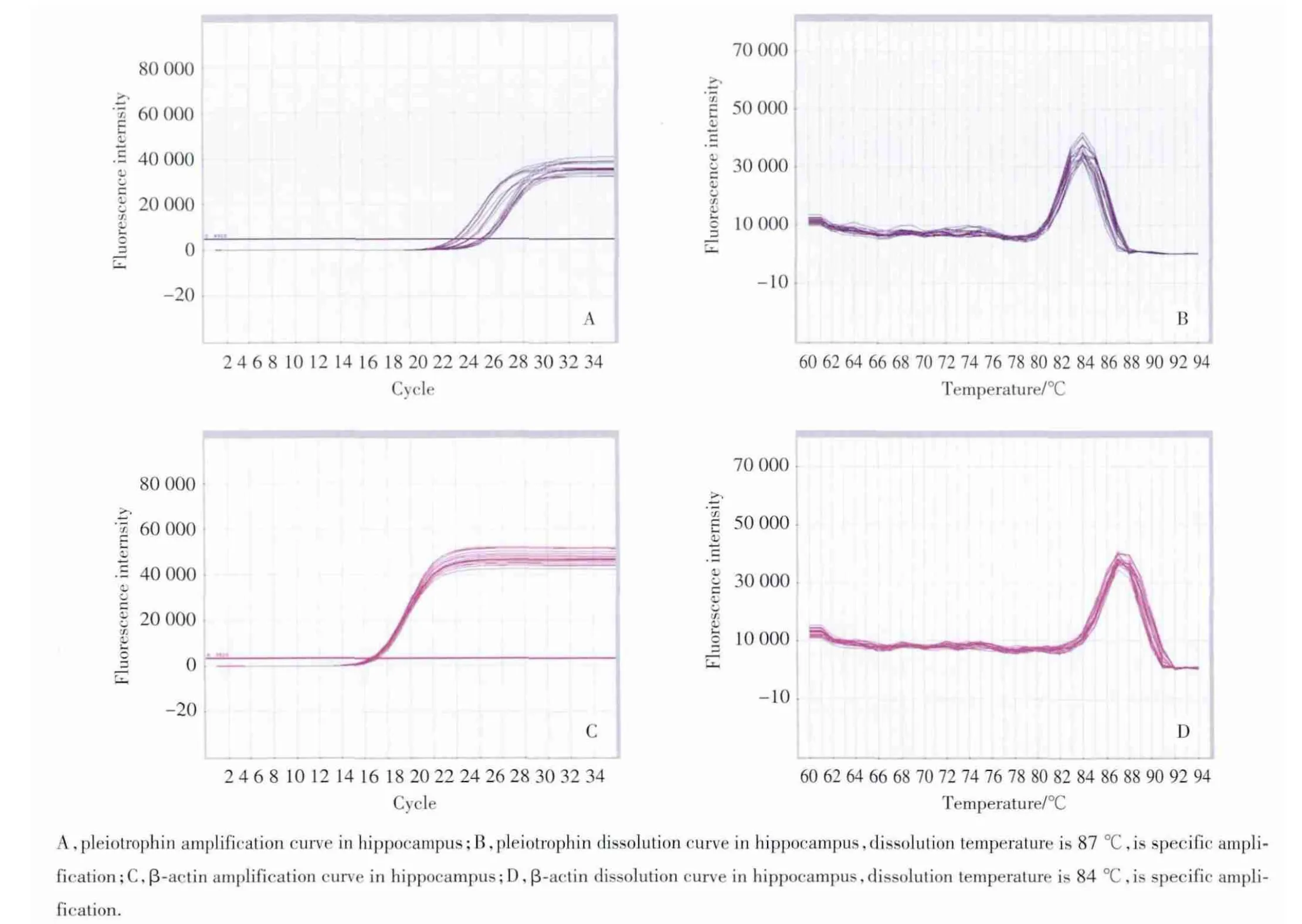
图3 R eal&x100ccf;timePCR检测大鼠海马中PTN mR NA的表达Fig.3 Expression of PTN mRNA in hippocampus of rats
PTN与神经系统疾病研究较早,机制研究也较多。研究发现,在胚胎期的中枢神经系统,PTN mRNA主要在大脑室管膜下层正在发育的神经胶质母细胞以及室管膜细胞中表达[13],表明PTN在大脑的神经、血管母细胞分化中起着重要作用。成年后,PTN在大脑中的表达水平较出生时明显降低,而主要集中在海马和大脑皮层[14]。有研究表明,PTN增加具有神经营养和神经保护功能[15,16]。
综上所述,癫痫后大脑颞叶皮质和海马pleiotrophin表达明显增加并且持续很长时间,进一步研究及揭示癫痫后pleiotrophin表达增加的机制,可能为癫痫治疗提供新的思路。
[1]Pujar SS,Neville BG,Scott RC,et al.Death within 8 years after childhood convulsive status epilepticus:a population&x100ccf;based study[J].Brain,2011,134(10):2819-2827.
[2]Tan GH,Liu YY,Hu XL,et al.Neuregulin 1 represses limbic epileptogenesis through ErbB4 in parvalbumin&x100ccf;expressing interneurons[J].Nat Neurosci,2012,15(2):258-259.
[3]French JA.Refractory epilepsy:clinical overview[J].Epilepsia,2007,48(1):3-7.
[4]Rogawski MA,Löscher W.The neurobiology of antiepileptic drugs[J].Nat Rev,2004,5(7):553-554.
[5]Milner PG,Li YS,Hoffman RM,et al.A novel 17 kD heparin&x100ccf;binding growth factor in bovine uterus:purification and N&x100ccf;terminal amino acid sequence[J].Biochem Biophys Res Commun,1989,165(3):1196-1103.
[6]Deuel TF,Zhang N,Yeh HJ,et al.Pleiotrophin:a cytokine with diverse functions and a novel signaling pathway[J].Arch Biochem Biophys,2002,397(2):162-171.
[7]Zamponi GW,Lory P,Perez&x100ccf;Reyes E.Role of voltage&x100ccf;gated calcium channels in epilepsy[J].Arch Eur J Physiol,2010,460(2):395-403.
[8]Bankstahl M,Bankstahl JP,Löscher W.Pilocarpine&x100ccf;induced epilepsy in mice alters seizure thresholds and the efficacy of antiepileptic drugs in the 6&x100ccf;Hertz psychomotor seizure model[J].Epilepsy Res,2013,107(3):205-216.
[9]Zhang YF,Xiong TQ,Tan BH,et al.Pilocarpine&x100ccf;induced epilepsy is associated with actin cytoskeleton reorganization in the mossy fiber&x100ccf;CA3 synapses[J].Epilepsy Res,2014,108(3):379-389.
[10]Winkler C,Yao S.The midkine family of growth factors:diverse roles in nervous system formation and maintenance[J].Br J Pharmacol,2014,171(4):905-912.
[11]Wanaka A,Carroll SL,Milbrandt J.Developmentally regulated expression of pleiotrophin,a novel heparin binding growth factor,in the nervous system of the rat[J].Brain Res Dev Brain Res,1993,72(1):133-144.
[12]Kim YB,Ryu JK,Lee HJ,et al.Midkine,heparin&x100ccf;binding growth factor,blocks kainic acid&x100ccf; induced seizure and neuronal cell death in mouse hippocampus[J].BMC Neuroscience,2010,11(42):2-8.
[13]Chen C,Yuan H,Gu H,et al.Experimental study on transfection of pleiotrophin gene into adipose&x100ccf;derived stem cells of mice[J].Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi,2013,27(8):897-901.
[14]Papadimitriou E,Mikelis C,Lampropoulou E,et al.Roles of pleiotrophin in tumor growth and angiogenesis[J].Eur Cytokine Netw,2009,20(4):180-190.
[15]Kong Y,Bai PS,Nan KJ,et al.Pleiotrophin is a potential colorectal cancer prognostic factor that promotes VEGF expression and induces angiogenesis in colorectal cancer[J].Int J Colorectal Dis,2012,27(3):287-298.
[16]Mikelis C,Koutsioumpa M,Papadimitriou E.Pleiotrophin as a possible new target for angiogenesis&x100ccf;related diseases and cancer[J].Recent Pat Anticancer Drug Discov,2007,2(2):175-186.
