二维斑点追踪成像评价原发性二尖瓣反流患者左室收缩功能隐匿性减低
2014-12-03王晓冰陈昕马春燕杨军
王晓冰,陈昕,马春燕,杨军
(中国医科大学附属第一医院心功能科,沈阳 110001)
原发性二尖瓣反流(primary mitral regurgitation,PMR)患者在长期的容量超负荷及神经体液因素作用下,左室心肌易发生重构,从而导致功能受损。在代偿期,心肌本身的收缩性进行性受损可能会导致隐匿性左室收缩功能减低,而前负荷的增加使左心室搏出量维持在一定水平,从而没有临床症状。临床上,这部分隐匿性左室收缩功能减低的患者在术前应用容量依赖性常规指标评价左心室收缩功能在正常范围,而在进行二尖瓣反流矫治术后由于容量负荷的改变出现左心室搏出量减少,发生心衰。因此临床需要更准确的指标评价PMR状态下左心功能的改变。超声斑点追踪成像(speckle tracking imaging,STI)技术能够相对不依赖容量变化评价左室心肌功能,本研究应用STI技术研究PMR患者在左室功能正常和隐匿性减低的状态下左室纵向应变及应变率,探讨反映左室收缩功能减低的敏感指标。
1 材料与方法
1.1 研究对象
PMR组:选择2012年3月至2014年3月于我院住院准备行二尖瓣修补或置换的中、重度PMR患者52例,所有患者术前左室射血分数(ejection fractions,EF)≥55%。排除标准:冠状动脉造影提示重度冠状动脉狭窄、超声提示心肌节段性运动异常,高血压级,糖尿病,明显的心律失常,重度肺高压,主动脉瓣反流或狭窄程度大于轻度,二尖瓣狭窄程度大于轻度,心肌病和先天性心脏病。病因:Barlow病(27例),纤维弹性组织退行性变(15例),心内膜炎(9例),风湿性病变(1例)。
正常对照组:选择年龄、性别匹配的20例健康志愿者,无高血压级病史,无冠心病病史,经病史采集、查体、血生化检查、肝肾功能检查、心电图、胸部X线、超声心动图等检查,结果无异常。
1.2 研究方法
1.2.1 仪器:GE Vivid 7 Dimension彩色多普勒超声成像仪。M3S探头,频率1.5~5.0 MHz。
1.2.2 常规超声心动图检查:所有受检者均进行常规超声心动图检查和STI图像采集,PMR患者于术前7 d及术后7 d进行超声心动图检查。受试者测量身高、体质量,将其输入超声诊断仪自动计算出体表面积。取左侧卧位,嘱平静呼吸,同步记录心电图。按照美国超声心动图学会推荐的方法,测量左室舒张末期内径、室间隔舒张末期厚度、左室后壁舒张末期厚度。依据Devereux公式计算左心室质量:左心室质量(g)=1.04×[(左室舒张末期内径+左室后壁舒张末期厚度+室间隔舒张末期厚度)3-左室舒张末期内径3]-13.6。计算左室质量指数:左心室质量指数(g/m2)=左心室质量/体表面积。用改良双平面Simpson方法计算左室舒张末期容积、左室收缩末期容积及EF。PISA法[1]计算二尖瓣有效反流口面积和二尖瓣反流容积。左室舒张末期内径、左室舒张末期容积和左室收缩末期容积采用BSA进行校正。依据2006年ACC/ASE心脏瓣膜病管理指南[2]及2001年欧洲心脏病协会关于收缩性心衰的诊断标准[3],根据术后EF将PMR患者分成2组:PMR1组(左室收缩功能正常组,n=31),术后EF≥55%;PMR2组(左室收缩功能减低组,n=21),术后EF<55%。
1.2.3 STI的图像采集及指标测定:采集并存储心尖左室长轴、四腔心、两腔心切面,帧频40~80帧/s,每幅图像至少采集3个心动周期。将图像传输到EchoPAC工作站,进入工作站二维应变软件程序,分别在3个切面于收缩末期勾画左室心内膜,系统自动勾画心肌的感兴趣区(ROI)。根据心肌厚度调整ROI宽度,然后选定processing键,系统自动将左室壁分为6个节段,并分别对各节段追踪效果进行评分。追踪满意评为√,不满意评为×,选取所有节段为√的数据进行分析。左室整体纵向应变为3个切面各节段收缩期总体峰值纵向应变的均值,左室整体收缩期纵向峰值应变率为3个切面各节段收缩期总体峰值纵向应变率的均值。左室基底段、中间段纵向峰值应变和收缩期峰值应变率分别为6个基底段及中间段纵向峰值应变及收缩期峰值应变率的均值。
1.3 统计学分析
2 结果
2.1 常规超声心动图参数
与正常对照组相比,PMR1组和PMR2组的左室舒张末期内径、舒张末期容积、收缩末期容积、质量指数和二尖瓣反流容积增高,差异有统计学意义(P<0.05)。与PMR1组相比,PMR2组的舒张末期容积和收缩末期容积增高,差异有统计学意义(P<0.05)。见表1。
2.2 STI参数
与正常对照组相比,PMR1组的左室整体纵向应变、应变率和左室基底段、中间段收缩期峰值应变率有增高趋势,但差异无统计学意义(P>0.05),PMR2组左室基底段、中间段的纵向峰值应变和收缩期峰值应变率均减低,差异有统计学意义(P<0.05)。与PMR1组相比,PMR2组的左室整体纵向应变和应变率、中间段收缩期峰值应变率及左室基底段纵向峰值应变和收缩期峰值应变率减低,差异有统计学意义(P<0.05)。见表1、图1。
2.3 术前各超声参数与术后EF的相关性
PMR患者左室舒张末期内径、左室舒张末期容积、左室收缩末期容积、左室质量指数和二尖瓣反流容积与术后EF呈低的负相关(P<0.05),左室整体纵向峰值应变和整体及中间段收缩期峰值应变率与术后EF呈中等程度正相关(P<0.05),左室基底段纵向峰值应变和中间段、基底段收缩期峰值应变率与术后EF呈高度正相关(P<0.001)。见表2。
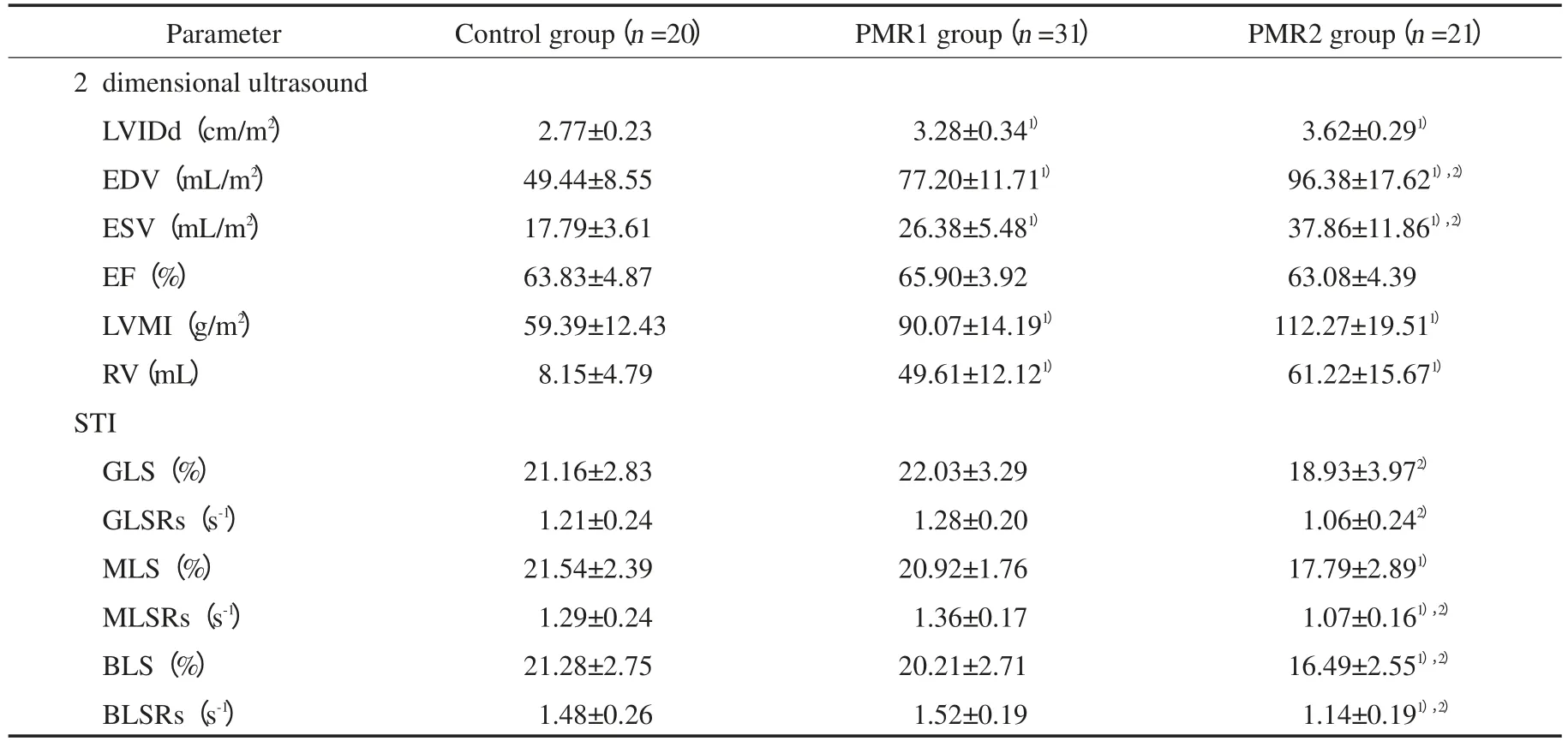
表1 3组患者常规超声及S TI指标比较Tab.1 Comparison of conventional ultrasound and STI parameters among 3 groups
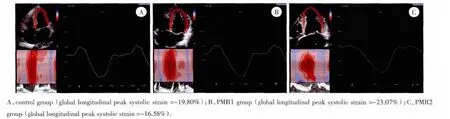
图1 心尖四腔左室纵向应变曲线Fig.1 LV longitudinal strain curve of apical 4 chamber
3 讨论
PMR患者在代偿期左室搏出量可仍维持在正常的水平,但心肌本身的收缩性进行性受损会导致隐匿性的收缩功能减低[2]。二尖瓣反流矫治术后,由于前负荷减少,这种被掩盖的心肌收缩功能减低便可表现出来,从而导致心衰的发生[4]。因此有学者提出,严重的二尖瓣反流患者无论是否术前存在收缩功能减低均应尽早实施二尖瓣反流矫治术,以最大限度的保护左心功能[3]。然而由于存在手术风险性和长期预后的不确定性等因素,一些学者对尽早手术还有质疑[5,6]。因此,通过识别二尖瓣反流患者心肌收缩功能的早期变化,将会帮助临床医生判断手术时机,从而避免发生左室功能不良并提高生存质量。
常规二维超声心动图的容积和功能指标依赖于左室前、后负荷的改变,难以准确评价PMR患者左室收缩功能[2]。二尖瓣反流程度是影响患者预后的重要因素,但研究表明反流程度与心肌收缩功能间相关性较差[7]。本研究结果显示,与收缩功能正常PMR患者相比,收缩功能隐匿性减低患者仅左室舒张末期容积和收缩末期容积增高,2组比较左室舒张末期内径、EF、左室质量指数和二尖瓣反流容积均无统计学差异,左室舒张末期内径、左室舒张末期容积、收缩末期容积、左室质量指数和二尖瓣反流容积与术后EF仅存在弱的负相关,术前EF与术后EF间亦无统计学相关性。因此,常规的超声心动图指标没有敏感的反映出本研究中各组间左室收缩功能的差异。
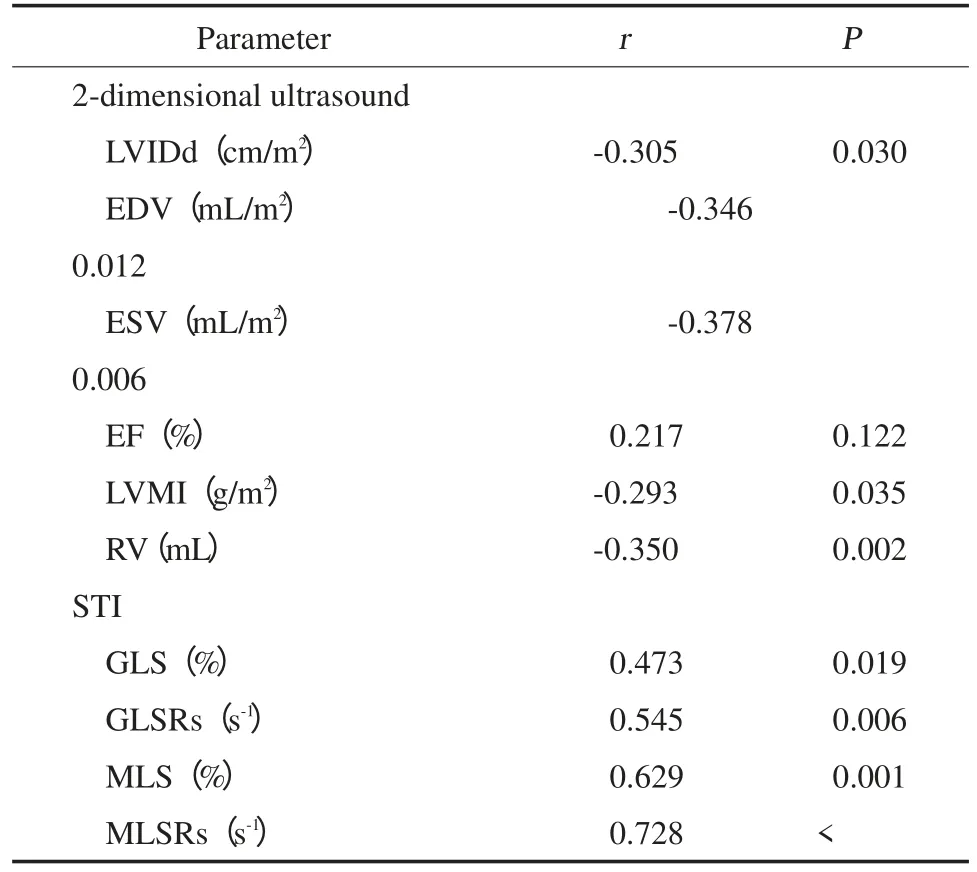
表2 PM R患者术前各超声参数与术后EF的相关性Tab.2 Correlation between postoperative EF and preoperativeecho parameters
STI技术是超声近年来发展的新技术,反映心肌纤维自身的形变特征,与心肌收缩功能直接相关,受心脏负荷及其他因素影响相对小,评价左室功能更加客观准确[8]。在容量负荷状态下,左室心内膜下心肌受应力最大,最易发生心肌功能障碍,而心内膜下心肌主要呈纵行,因此左室的纵向功能最易受损[9]。因此本研究应用左室纵向应变及应变率来评价PMR患者左室收缩功能。
本研究结果显示,PMR左室收缩功能正常组与正常对照组相比,左室整体和局部纵向应变及应变率指标均无统计学差异,但左室整体纵向峰值应变和左室整体、中间段及基底段收缩期峰值应变率有增高趋势,表明PMR患者在心肌尚未明显受损时,由于容量负荷的影响,心肌收缩功能代偿性增加,导致纵向应变指标有所增高。PMR患者心肌出现隐匿性受损时,左室整体和基底段纵向峰值应变,左室整体、中间段及基底段收缩期峰值应变率均较PMR左室收缩功能正常组减低,中间段和基底段纵向峰值应变、收缩期峰值应变率较正常对照组减低,表明其对收缩功能的早期损害有较高的敏感性。Weidemann等[10]证明纵向应变率减低出现在没有临床症状的重度反流的患者中,并且可以作为早期左室功能失调的预测因子。STI参数与术后EF进行对比分析显示,各参数与术后EF均呈中等程度以上的正相关,其中左室基底段纵向峰值应变和中间段、基底段收缩期峰值应变率与术后EF呈高度正相关,表明术前纵向应变参数较常规超声更能够敏感的检测左室收缩功能。
本研究的局限性:(1)应用术后1周EF值作为术后收缩功能的评价还不完善,有待于术后进一步长期随访研究PMR术后心肌功能恢复情况;(2)采用二维STI技术,尚存在斑点移除采集切面造成测量误差,最新的三维STI技术可以避免这种误差,有望成为评价PMR患者左室功能的新的诊断方法。
本研究结果表明,应用二维STI技术测量左室纵向应变及应变率能够敏感的评价PMR患者左室收缩功能隐匿性减低,从而帮助临床选择手术时机。
[1]Lancellotti P,Tribouilloy C,Hagendorff A,et al.Recommendations of the echocardiographic assessment of native valvular regurgitation:an executive summary from the European association of cardiovascular imaging [J].Eur Heart J Cardiovasc Imaging,2013,14(7):611-644.
[2]Bonow RO,Carabello BA,Kanu C,et al.ACC/AHA 2006 guidelines for the management of patients with valvular heart disease:a report of the American College of Cardiology/American Heart Association Task Force in Practice Guidelines(writing committee to revise the 1998 Guidelines for the Management of Patients With Valvular Heart Disease):developed in collaboration with the Society of Cardiovascular Anesthesiologists:endorsed by the Society for Cardiovascular Angiograhy and Interventions and the Society of Thoracic Surgeons[J].Circulation,2006,114(5):e84-e231.
[3]Schuler G,Peterson KL,Johnson A,et al.Temporal response of left ventricular performance to mitral valve surgery[J].Circulation,1979,59(6):1218-1231.
[4]Urschel CW,Covell JW,Graham TP,et al.Myocardial systolic velocities and deformation assessed by speckle tracking for early detection of left ventricular dysfunction in asymptomatic patients with severe primary mitral regurgitation[J].Echocardiography,2012,29(3):326-333.
[5]Ross J Jr.Adaptations of the left ventricular to chronic volume overload[J].Circ Res,1974,35(SupplⅤ):64-70.
[6]Perry GJ,Wei C,Hankes GH,et al.Angiotensin Ⅴ receptor blockade does not improve left ventricular function and remodeling insubacute mitral regurgitation in the dog[J].J Am Coll Cardiol,2002,39(8):1374-1379.
[7]Rosenhek R,Rader F.Outcome of watchful waiting in asymptomatic severe mitral regurgitation[J].Circulation,2006,113(18):2238-2244.
[8]Bertini M,SenguptAPP,Nucifora G,et al.Role of left ventricular twist mechanics in the assessment of cardiac dyssynchrony in heart failure[J].JACC Cardiovasc Imaging,2009,2(12):1425-1435.
[9]SenguptAPP,Krishnamorthy VK,Korinek J,et al.Left ventricular form and function revisited:applied translational science to cardiovascular ultrasound imaging[J].J Am Soc Echocardiogr,2007,20(5):539-551.
[10]Weidemann F,Jamal F,Sutherland GR,et al.Myocardial function defined by strain rate and strain during alterations in inotropic states and heart rate[J].Am J Physiol Heart Circ Physiol,2002,283(2):H792-H799.
