柴胡、黄芩含药血清对异烟肼致肝细胞HepG2损伤的预防作用
2014-12-02唐永翠孙付军李贵海
唐永翠,严 敏,孙付军,李贵海
(1五莲县人民医院,山东日照262300;2山东省疾病预防控制中心;3山东省中医药研究院)
柴胡、黄芩是临床常用的配伍“药对”,最早出自《伤寒论》,是仲景柴胡系列方剂中最具代表意义的基本配伍,在小柴胡汤、柴葛解肌汤、大柴胡汤、龙胆泻肝汤等诸多经典方剂中配伍应用。柴胡疏肝升阳、和解表里,黄芩疏风清肺、宣肺止咳,二者和用具有清热疏肝及和解少阳之功能,在临床有广泛的应用基础。本研究通过观察柴胡、黄芩不同配伍比例的含药血清对异烟肼所致肝细胞损伤的影响,探讨柴胡与黄芩主要药效学作用的最佳配伍关系,为中医临床用药和中药复方的基础研究提供依据。
1 材料与方法
1.1 实验动物及药物 雄性Wistar大鼠30只,体质量250~300 g,SPF级,由山东大学实验动物中心提供,合格证号:SCXK(鲁)20090001。柴胡(批号:060501)、黄芩(批号:20070601)购于山东济南天一中药饮片有限公司,经山东中医药研究院中药资源研究室鉴定为伞形科植物柴胡Bupleurum chinense DC(北柴胡)和唇形科植物黄芩Scutellaria baicalensis Georgi的干燥根,受试液由山东省千佛山医院药剂科制备,柴胡、黄芩不同比例的配伍受试液分别为1∶0、1∶2、1∶1、2∶1、0∶1,每种受试药均制成每毫升含生药量1 g的溶液备用。
1.2 不同配伍比例柴、黄芩含药血清的制备方法取雄性Wistar大鼠,用柴胡、黄芩配伍比例分别为1∶0、1∶2、1∶1、2∶1、0∶1 药液按 10 mL/kg 灌胃,2次/d,连续7 d。末次灌胃给药90 min后,大鼠腹主动脉无菌采血。3 000 r/min离心15 min,无菌收集血清,56℃灭活30 min,经0.22 μm 滤器抽滤除菌后-70℃保存,备用。
1.3 肝细胞 HepG2培养及处理方法 肝细胞HepG2接种于6孔细胞板,每孔加入1.5 mL,37℃、5%CO2培养箱中培养24 h后换液。将细胞分为对照组、模型组、给药组1、给药2、给药组3、给药组4和给药组5。给药组1、2、3、4、5分别用含10%不同配伍比例柴胡、黄芩(比例分别为 1∶0、1∶2、1∶1、2∶1、0∶1)含药血清的 RPMI1640 基础培养液培养;对照组和模型组含药血清用正常鼠血清代替。同时,根据HepG2细胞株半数细胞病变率(TCD50)及凋亡情况,用4 mg/mL异烟肼接种于除对照组外其他组细胞。培养48 h后,观察各组细胞病变程度并进行细胞凋亡检测。
1.4 观察方法 ①显微镜下记录细胞不同程度的病变:(+)表示约25%细胞发生病变;(++)为50%细胞发生病变;(+++)为75%细胞发生病变;(++++)为全部细胞发生病变。②细胞凋亡检测:收集培养24 h的 HepG2细胞,PBS洗2次,1×Bingding Buffer重悬细胞(1×106)。取100 μL(1×105)细胞加入到 TruCount管。加5 μL FITC AnnexinV 和 5 μL PI。轻轻涡旋细胞,室温避光孵育 15 min。加 400 μL 1×Bingding Buffer,待检,1 h内上机检测。流式细胞仪检测Annexin/PI阳性染色率,其中Annexin V+为早期凋亡,PI+为坏死,Annexin V+/PI+为坏死或晚期凋亡,以上各项相加为细胞总凋亡率。③Fas、FasL(CD95/CD95Ligand)检测:收集培养24 h的HepG2细胞,PBS洗涤2次,PBS重悬 HepG2细胞。取100 μL(1×106)细胞加入到 TruCount管。再加 20 μL FITC CD95和 5 μL PE anti-human CD95Ligand。轻轻涡旋细胞,室温避光孵育15~30 min。加 2 mL PBS,1 000 r/min离心。弃上清,加入500 μL鞘液,上机检测。
1.5 统计学方法 采用SPSS12.0统计软件。计量资料以±s表示,组间比较采用成组t检验。P≤0.05为差异有统计学意义。
2 结果
与对照组相比,模型组细胞发生肿胀变性及细胞脱落死亡的情况严重,各给药组细胞病变情况不同程度减轻,其中减轻程度以给药组2最为明显,其次为给药组1、给药组3、给药组4,给药组5减轻程度相对较弱。各组镜下病变情况分别为对照组(-),模型组(+++),给药组1(+),给药组2(±),给药组3(+),给药组4(+),给药组5(+)。各组肝细胞HepG2凋亡检测结果见表1。各组肝细胞HepG2Fas、FasL相对表达量见表2。
表1 各组肝细胞HepG2凋亡检测结果(%,±s)
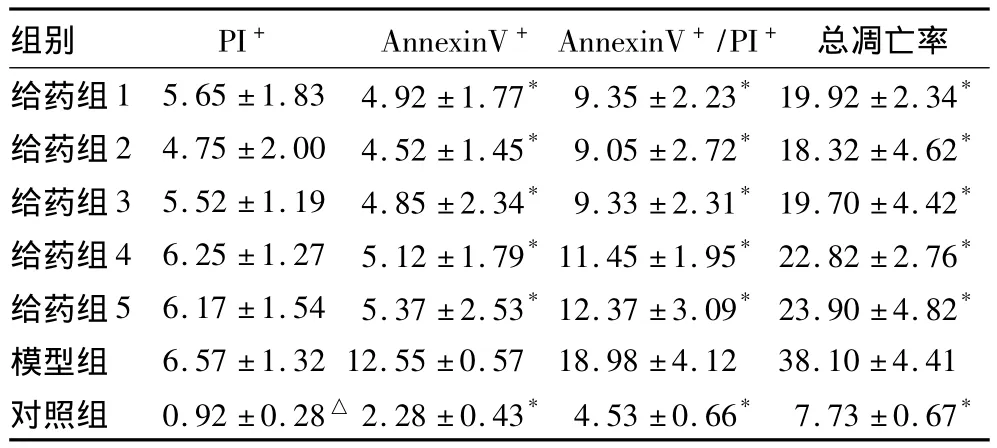
表1 各组肝细胞HepG2凋亡检测结果(%,±s)
注:与模型组比较,*P <0.05,△P <0.01
组别 PI+ AnnexinV+AnnexinV+/PI+总凋亡率给药组1 5.65 ±1.83 4.92 ±1.77* 9.35 ±2.23*19.92 ±2.34*给药组2 4.75 ±2.00 4.52 ±1.45* 9.05 ±2.72*18.32 ±4.62*给药组3 5.52 ±1.19 4.85 ±2.34* 9.33 ±2.31*19.70 ±4.42*给药组4 6.25 ±1.27 5.12 ±1.79*11.45 ±1.95*22.82 ±2.76*给药组5 6.17 ±1.54 5.37 ±2.53*12.37 ±3.09*23.90 ±4.82*模型组 6.57 ±1.32 12.55 ±0.57 18.98 ±4.12 38.10 ±4.41对照组 0.92 ±0.28△ 2.28 ±0.43* 4.53 ±0.66* 7.73 ±0.67*
表2 各组肝细胞HepG2Fas、FasL相对表达量(%,±s)
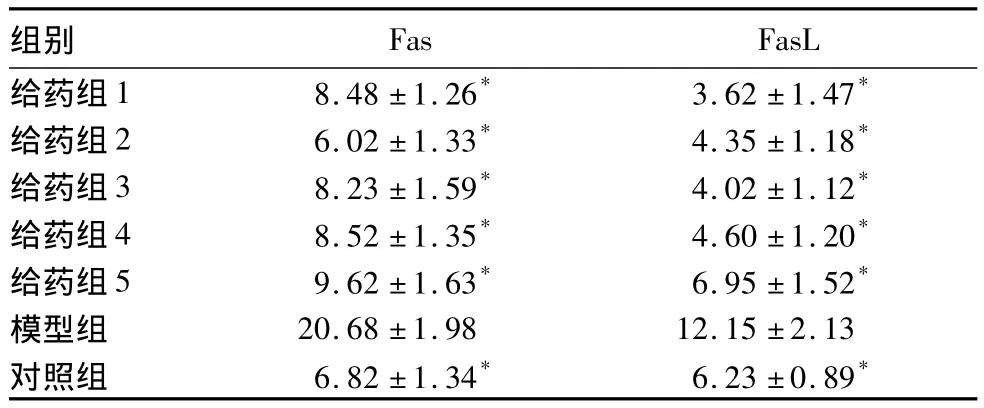
表2 各组肝细胞HepG2Fas、FasL相对表达量(%,±s)
注:与模型组比较,*P <0.05
Fas FasL给药组1 8.48 ±1.26* 3.62 ±1.47组别*给药组2 6.02 ±1.33* 4.35 ±1.18*给药组3 8.23 ±1.59* 4.02 ±1.12*给药组4 8.52 ±1.35* 4.60 ±1.20*给药组5 9.62 ±1.63* 6.95 ±1.52*模型组 20.68 ±1.98 12.15 ±2.13对照组 6.82 ±1.34* 6.23 ±0.89*
3 讨论
中药研究的基本困难在于起作用的物质基础不明确,因此对于其作用机制和生物转化、代谢过程的研究更加困难。血清药理学主要是通过研究给药动物血清的生物学活性来揭示药物作用机制。动物灌胃后一定的时间内采血,分离血清,用含此药物成分的血清来检验其生物学活性。血清药理学实验方法具有体外实验可控性强、药物效应易于检测、可深入揭示药物作用机理等优点,并代表了药物在体内产生作用的真正有效成分。中药血清药理学最早在80年代由日本京都大学学者田代真一首先提出。这种研究方法可以有效避免普通中药体外实验可能产生的误差。因为药物口服后经过吸收、分布、代谢等一系列过程,部分在体外实验为有效成分,经过一系列吸收代谢后可能某些有效成分失活或不被吸收而不能在体内发挥作用;而有些在体外实验时的无效成分可能经过体内代谢转化为活性物质。中药血清可以模拟代谢后药物的情况,更准确地反映药物真实作用;防止中药粗制剂理化因素(如电解质、渗透压、pH等)对实验的干扰。本实验采取中药血清药理学研究方法,能更准确客观地反映药物代谢后真正效用[1]。
Fas和FasL是介导细胞凋亡的一对膜蛋白,两者通过结合胞内的死亡受体FADD/MORT1或DAXX,进而激活Capase-8或Jnk通路引起表达Fas的细胞凋亡[2,3]。在多种肝病中可发现其介导的肝细胞凋亡。在慢性乙型、丙型病毒性肝炎等肝病中,国内外研究均发现肝细胞表面Fas和FasL表达同时增加,在汇管区等炎症活跃的区域增加明显,并随炎症的严重程度而增加。这些发现打破了经典的Fas介导的凋亡途径,即肝细胞仅表达Fas,而CTL、NK细胞表达FasL。Fas、FasL表达是慢性肝细胞凋亡的一种重要机制之一,抑制肝细胞Fas、FasL表达将有助于减轻肝细胞损伤程度。减少Fas和FasL诱导的肝细胞凋亡成为抗肝损伤研究的新亮点[4~8]。本研究采用流式细胞仪 AnnexinV/PI染色法验证了异烟肼干预的HepG2细胞出现凋亡和坏死,并发现异烟肼作用于HepG2细胞后与对照组相比伴随凋亡率的增加,HepG2细胞中Fas、FasL表达增高,提示Fas、FasL活化参与了异烟肼致HepG2细胞凋亡过程,此为进一步研究异烟肼的肝毒性以及相应治疗提供了理论依据。但凋亡和Fas、FasL阳染所占比例较低,提示Fas/FasL通路不是异烟肼致肝细胞凋亡的惟一通路,凋亡亦不是异烟肼致HepG2细胞死亡的主要原因[9~13]。给予含不同比例柴胡、黄芩配伍血清后Fas及FasL表达比例减少,且细胞病变情况不同程度减轻,细胞总凋亡率降低,提示柴胡、黄芩含药血清可以通过抑制Fas、FasL表达进而减少肝细胞凋亡,达到抗肝损伤的目的。
[1]张玮函,吴咸中.药物血清在中药复方药理研究中的应用及其发展[J].中国中西医结合外科杂志,2007,13(4):190-193.
[2]Kaufmann SH,Earnshaw WC.Induction of apoptosis by cancer chemotherapy[J].Exp Cell Res,2000,256(1):42-49.
[3]Timmer T,de Vries EG,de Jong S.Fas receptor-mediated apoptosis:a clinical application[J].J Pathol,2002,196(2):125-134.
[4]吴灵飞,苏建东,李国平,等.腺苷体外对人肝癌HepG2细胞凋亡的诱导作用及其作用机制[J].中国药理学与毒性学杂志,2008,22(3):205-211.
[5]任宁,王世明,董秀山,等.自噬对肝癌HepG2细胞增殖及对细胞周期影响的研究[J].中国当代医药,2012,19(11):8-10.
[6]宋淑亮,肖曾平,吉爱国,等.绞股蓝多糖对HepG2细胞酒精性肝损伤的保护作用[J].中国生化药物杂志,2008,29(5):302-305.
[7]丁晓蕾,张阳,吴涛.索拉菲尼逆转肝癌细胞株HepG2/GEM耐药作用的实验研究[J].中华肿瘤防治杂志,2010,17(15):1160-1163.
[8]耿秀芳,杨利丽,潘智芳,等.银杏叶总黄酮对人肝癌HepG2细胞增殖和凋亡的影响[J].医学研究生学报,2010,23(6):601-603.
[9]闵亮.补肾健脾中药联合5-FU对肝癌HepG2细胞增殖和凋亡影响的血清药理学研究[J].辽宁中医药大学学报,2010,8(8):109-110.
[10]李鹏辉.大蒜素对人肝癌HepG2细胞增值抑制作用的研究[J].中国现代医生,2010,48(16):7-13.
[11]杨春光,弓晓杰,孙长滨.人参皂苷代谢产物衍生物对HepG2细胞凋亡及相关蛋白表达的影响[J].中国现代医学杂志,2010,20(14):2100-2102.
[12]杨华,程金建,梁钢.丹酚酸C诱导肝癌HepG2细胞有丝分裂阻滞及凋亡的研究[J].中国药理学通报,2010,26(9):1208-1212.
[13]陈莉,尚娟,王志凤,等.硝酸酯/齐墩果酸杂合物的合成及HepG2细胞凋亡抑制活性的研究[J].药学学报,2010,45(12):1516-1522.
