阿利吉仑对阿霉素肾病小鼠肾脏的保护作用
2014-12-02伍巧源廖蕴华杨桢华周颖川
伍巧源,廖蕴华,杨桢华,郭 谊,周颖川
(1广西医科大学第一附属医院,南宁530021;2广西医科大学研究生院)
肾素—血管紧张素系统(RAS)过度激活是肾脏疾病发生、发展的重要机制之一,故抑制RAS是治疗肾脏病的有效途径。但20%~40%肾脏病患者应用血管紧张素转换酶抑制剂(ACEI)或血管紧张素受体阻断剂(ARB)抑制RAS后蛋白尿仍持续存在,并可能导致血管紧张素(AngⅡ)水平增高,出现醛固酮逃逸。阿利吉仑是新型肾素抑制剂,可阻断RAS的初始步骤,使AngⅠ、AngⅡ水平明显降低,能更彻底地阻断RAS。有研究表明,阿利吉仑有延缓糖尿病肾病肾损害进展的作用。但在原发肾脏疾病中,阿利吉仑能否发挥良好的防治作用,相关报道较少。为此,本研究观察了阿利吉仑对阿霉素肾病小鼠肾脏的保护作用,以探寻其对原发慢性肾脏病的治疗价值。
1 材料与方法
1.1 材料 8周龄、雄性BALB/c小鼠30只,由广西医科大学实验动物中心提供。采用抽签法随机均分为5组:正常对照组、阿霉素肾病组、阿利吉仑组、缬沙坦组及阿利吉仑+缬沙坦组。注射用盐酸阿霉素:浙江海正药业股份有限公司;阿利吉仑及缬沙坦:瑞士诺华制药有限公司。
1.2 方法
1.2.1 阿霉素肾病小鼠模型的建立、分组及处理除正常对照组外,各组均一次性尾静脉注射阿霉素(10 mg/kg)建立阿霉素肾病模型。其中,阿利吉仑组给予阿利吉仑3 mg/(kg·d);缬沙坦组给予缬沙坦5 mg/(kg·d),阿利吉仑+缬沙坦组分别给予单用剂量。正常对照组给予一次性尾静脉注射等量生理盐水。成模标准为注射阿霉素6周后,小鼠出现明显蛋白尿、低蛋白血症等特征性改变及出现进展性肾小球硬化和肾小管间质损害。
1.2.2 血生化指标检测 各组研究开始后第2、6周行24 h尿蛋白定量、尿蛋白/肌酐测定。在阿霉素注射后第6周处死小鼠。处死前心脏穿刺取血标本,用邻苯三酚红比色法检测24 h尿蛋白定量,全自动生化分析仪检测血清肌酐、白蛋白和胆固醇。
1.2.3 肾脏组织病理学观察 处死小鼠后,取部分肾组织以10%甲醛固定,石蜡包埋。肾组织石蜡切片行PAS、HE和Masson染色,观察肾组织肾小球硬化程度和肾小管损害程度。肾小球硬化程度按0~4分的半定量计分法评价:无硬化改变,为0分;硬化占整个肾小球面积的25%以下,为1分;占整个肾小球面积的26%~50%,为2分;占整个肾小球面积的51%~75%,为3分;占整个肾小球面积的76%~100%,为4分。每只小鼠至少评价30个肾小球,肾小球硬化的最终评分由所评价小鼠所有肾小球计分的平均值得出。评分采用盲法。肾小管间质的损伤定义为近端小管刷状缘消失、肾小管扩张、萎缩以及间质纤维化形成,按程度以0~4分的半定量计分方法评价:正常,为0分;小管间质损害<25%,为1分;小管间质损害25%~50%,为2分;小管间质损害51%~75%,为3分;小管间质损害>75%,为4分。每只小鼠至少评价30个连续非重叠的皮质区高倍镜下视野(×400),最终评分由所有高倍镜下视野计分的平均值得出,评分采用盲法。
1.2.4 统计学方法 采用SPSS17.0统计软件,计量资料以±s表示,结果比较采用方差分析。P≤0.05为差异有统计学意义。
2 结果
2.1 各组血生化指标比较 见表1。
表1 各组血生化指标结果比较(±s)
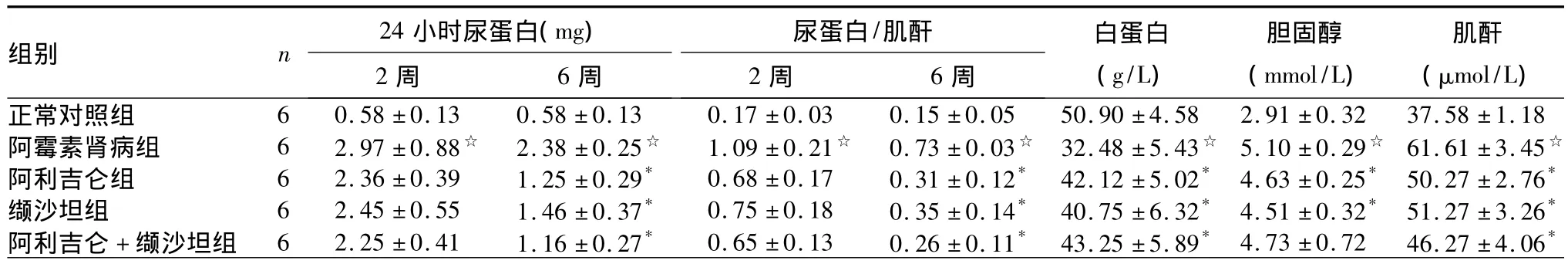
表1 各组血生化指标结果比较(±s)
注:与正常对照组比较,☆P<0.05;与阿霉素肾病组比较,*P<0.05
组别 n 24小时尿蛋白(mg)2周 6周肌酐2周 6周尿蛋白/白蛋白(g/L)胆固醇(mmol/L)肌酐(μmol/L)正常对照组 6 0.58 ±0.13 0.58 ±0.13 0.17 ±0.03 0.15 ±0.05 50.90 ±4.58 2.91 ±0.32 37.58 ±1.18阿霉素肾病组 6 2.97 ±0.88☆ 2.38 ±0.25☆ 1.09 ±0.21☆ 0.73 ±0.03☆ 32.48 ±5.43☆ 5.10 ±0.29☆ 61.61 ±3.45☆阿利吉仑组 6 2.36 ±0.39 1.25 ±0.29* 0.68 ±0.17 0.31 ±0.12* 42.12 ±5.02* 4.63 ±0.25* 50.27 ±2.76*缬沙坦组 6 2.45 ±0.55 1.46 ±0.37* 0.75 ±0.18 0.35 ±0.14* 40.75 ±6.32* 4.51 ±0.32* 51.27 ±3.26*阿利吉仑 + 缬沙坦组 6 2.25 ±0.41 1.16 ±0.27* 0.65 ±0.13 0.26 ±0.11* 43.25 ±5.89* 4.73 ±0.72 46.27 ±4.06*
2.2 各组肾脏组织病理损害情况比较 注射阿霉素6周后,与正常对照组比较,阿霉素肾病组肾脏出现局灶性节段性肾小球硬化,甚至个别球性硬化、肾间质广泛纤维化和小管萎缩。相比于阿霉素肾病组,阿利吉仑组、缬沙坦组或阿利吉仑+缬沙坦组肾小球硬化和小管间质损害等病变均得到有效改善,其中阿利吉仑组肾小球硬化和小管间质损害程度均较缬沙坦组改善明显,但无统计学差异;而阿利吉仑+缬沙坦组较二者单用小管间质的损害显著改善(P<0.05)。各组肾小球硬化半定量评分、肾小管兼职损伤半定量评分比较见表2。
表2 各组肾脏组织病理损害情况比较(分,±s)
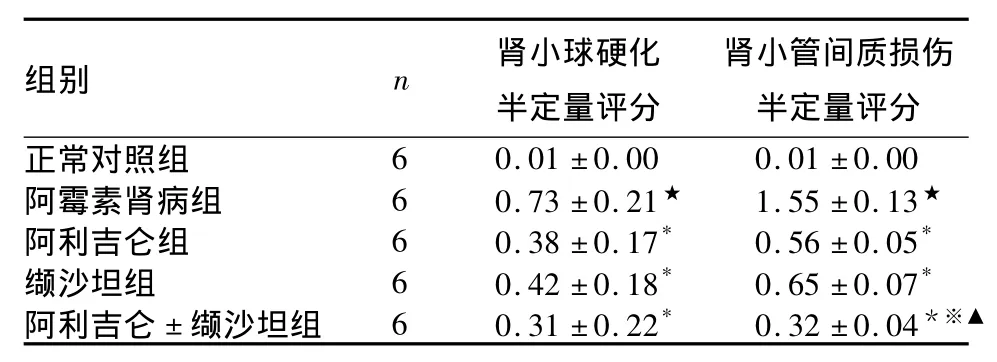
表2 各组肾脏组织病理损害情况比较(分,±s)
注:与正常对照组比较,★P<0.05;与阿霉素肾病组比较,*P<0.05;与缬沙坦组比较,※P <0.05;与阿利吉仑组比较,▲P <0.05
组别 n 肾小球硬化半定量评分肾小管间质损伤半定量评分正常对照组6 0.01 ±0.00 0.01 ±0.00阿霉素肾病组 6 0.73 ±0.21★ 1.55 ±0.13★阿利吉仑组 6 0.38 ±0.17* 0.56 ±0.05*缬沙坦组 6 0.42 ±0.18* 0.65 ±0.07*阿利吉仑 ± 缬沙坦组 6 0.31 ±0.22* 0.32 ±0.04*※▲
3 讨论
慢性肾脏疾病(CKD)的主要组织学特点包括肾小球硬化、小管间质纤维化、肾小管萎缩等[1],这些病理改变都与RAS各组分之间有着重要关系。AngⅡ是RAS的主要活性肽,AngⅡ可通过压力依赖性途径及非压力依赖性途径使肾脏出现蛋白尿、细胞外间质增多、胶原沉积等变化,最终出现肾小球硬化、肾间质纤维化[2]。抑制RAS各个环节均为肾脏病治疗的有效途径,故ACEI或ARB类药物能延缓慢性肾脏病的进展[3,4]。尽管ACEI或ARB类药物能很大程度上延缓慢性肾脏病的进展,但该类药物仍有其不足之处:①ACEI或ARB可导致醛固酮逃逸。已有研究证实,醛固酮参与肾脏损伤,醛固酮逃逸者GFR下降率快于无逃逸者[5]。②长期应用ACEI,可导致AngⅠ堆积,使旁路激活,循环及组织中AngⅡ浓度逐渐回升到治疗前水平,出现所谓的“AngⅡ逃逸”现象。③ARB高度特异性地拮抗血管紧张素1型受体(AT1),阻断了AngⅡ绝大多数的生物学功能,但长期应用可导致AngⅠ、AngⅡ升高,血管紧张素2型受体(AT2)等过度激活,导致心脏肥大或血管纤维化等不良后果。
相比于ACEI或ARB类药物,肾素抑制剂阻断RAS的初始步骤是使AngⅠ、AngⅡ水平明显减低,更彻底地抑制RAS系统,减少醛固酮逃逸现象。阿利吉仑是一种非肽类肾素抑制剂,具有吸收快、水溶性好、生物利用度高和半衰期长等特点[16]。目前关于该药的研究主要集中于糖尿病继发肾损害。研究发现,阿利吉仑可减少糖尿病肾病小鼠蛋白尿,延缓肾小球硬化进展,而且其抑制间质纤维化的作用要强于 ACEI[7]。Parving 等[8]研究发现,阿利吉仑联合络沙坦可使糖尿病肾病患者尿白蛋白/肌酐下降20%,其中24.7%患者该指标下降50%。另一研究也证实,阿利吉仑与ARB联合应用对糖尿病肾损害有协同保护作用[9]。
小鼠阿霉素肾病模型类似于人类的局灶性节段性肾小球硬化,其病理特征为进展性的肾小球硬化、小管间质损害等[10],是研究人类肾小球疾病的重要模型之一。本研究中,所有注射阿霉素的小鼠均出现以蛋白尿、低蛋白血症、高脂血症和肾功能损害为特征的阿霉素肾病,与人类局灶性节段性肾小球硬化患者肾病综合征的发展一致。给予阿霉素肾病小鼠阿利吉仑、缬沙坦及二者联合应用后,24 h尿蛋白均有显著改善,血清白蛋白显著上升,明显延缓了肾功能恶化。组织学评价显示,阿利吉仑、缬沙坦及二者联合应用均可明显减轻肾小球硬化和肾小管间质损害。但二药单用小鼠尿蛋白减少及肾间质纤维化改善程度差异无统计学意义。由于阿利吉仑可消除ARB致AngⅡ堆积的效应,二者具有联合应用的理论基础。已有临床试验证实,二者联合应用对RAS 的抑制有协同作用[11,12];新近有报道,慢性肾脏病患者给予ARB联合阿利吉仑较ARB联合苯那普利有更好的降尿白蛋白效果[13]。本研究发现,相比于二药单用,联合用药后阿霉素肾病小鼠尿蛋白有下降趋势,但是差异无统计学意义;而小管间质的损害较二者单用显著改善,提示二者联合应用对肾脏病理损害有协同保护效应。
综上所述,阿利吉仑对阿霉素肾病小鼠有良好的肾脏保护作用,与ARB类药物联合应用具有协同保护作用。
[1]Diamond JR,Ricardo SD,Klahr S.Mechanisms of interstitial fibrosis in obstructive nephropathy[J].Semin Nephrol,1998,18(6):594-602.
[2]侯凡凡,谢迪.慢性肾脏病应用肾素—血管紧张素系统阻断剂的治疗目标[J].中华高血压杂志,2007,15(z1):z32-z34.
[3]Nakao N,Yoshimura A,Morita H,et al.Combination treatment of angiotensin-Ⅱreceptor blocker and angiotensin-converting-enzyme inhibitor in non-diabetic renal disease(COOPERATE):a randomised controlled trial[J].Lancet,2003,361(9352):117-124.
[4]Brenner BM,Cooper ME,de Zeeuw D,et al.Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy[J].N Engl J Med,2001,345(12):861-869.
[5]Remuzzi G,Ferico N,Macia M,et al.The role of rennin-angiotensin-aldosterone system in the progression of chronic kidney disease[J].Kidney Int Suppl,2005,99:S57-S65.
[6]韩蕊,叶志斌.直接肾素抑制剂(DRI)阿利吉仑在慢性肾脏疾病(CKD)中的应用进展[J].复旦学报(医学版),2012,39(4):422-427.
[7]Kelly DJ,Zhang Y,Moe G,et al.Aliskiren,a novel renin inhibitor,is renoprotective in a model of advanced diabetic nephropathy in rats[J].Diabetologia,2007,50(11):2398-2404.
[8]Parving HH,Persson F,Lewis JB,et al.Aliskiren combined with losartan in type 2 diabetes and nephropathy[j].N Engl J Med,2008,358(23):2433-2446.
[9] Persson F,Rossing P,Reinhard H,et al.Renal effects of aliskiren compared with and in combination with irbesartan in patients with type 2 diabetes,hypertension,and albuminuria[J].Diabetes Care,2009,32(10):1873-1879.
[10]Wang Y,Wang YP,Tay YC,et al.Progressive adriamycin nephropathy in mice:sequence of histologic and immunohistochemical events[J].Kidney Int,2000,58(4):1797-1804.
[11]Bakris GL,Oparil S,Purkayastha D,et al.Randomized study of antihypertensive efficacy and safety of combination aliskiren/valsartan vs valsartan monotherapy in hypertensive participants with type 2 diabetes mellitus[J].J Clin Hypertens(Greenwich),2013,15(2):92-100.
[12]周光宇,苏雪松,杜丰,等.阿利吉仑对2型糖尿病db/db小鼠肾脏损伤的保护作用[J].中华肾脏病杂志,2011,27(11):844-849.
[13]Ohsawa M,Tamura K,Kanaoka T,et al.Addition of aliskiren to Angiotensin receptor blocker improves ambulatory blood pressure profile and cardiorenal function better than addition of benazepril in chronic kidney disease[J].Int J Mol Sci,2013,14(8):15361-15375.
